苍耳子炮制前后挥发性成分及水煎液中酚酸性成分分析
2022-02-12康连香刘陆楠柴清军潘国良王华德
康连香,刘陆楠,柴清军,潘国良,王华德
(1. 漯河市中医院,河南 漯河 462000;2. 漯河市药品检验所,河南 漯河 462000;3. 河南中医药大学第一附属医院,河南 郑州 450000)
苍耳子是苍耳带总苞的果实,在我国具有丰富的物种资源,广泛分布于我国各地。《神农本草经》记载:“葈耳实,味甘,性温……主风头寒痛,风湿周痹……”。苍耳子归肺经,主治风寒头痛、鼻渊流涕等症[1],现代药理研究证明,苍耳子具有降血糖、抗菌消炎等作用,对呼吸系统、心血管系统、免疫系统及凝血功能等均有影响,是鼻通丸、鼻炎康片、鼻炎胶囊等治疗鼻炎、鼻窦炎等中药制剂的重要组成成分[2]。苍耳子也具有一定的毒性,《本草品汇精要》《南方主要有毒植物》均有记载,其可对肝脏、肺、脑等器官造成损伤,中毒后可引起头痛、恶心、呼吸抑制、胃肠道反应等症状,因此入药前需加工处理[3]。中药炮制在我国历史悠久,苍耳子具有成熟的炮制工艺和翔实的文献记载,主要有“烧法”“炒法”“蒸法”“捣法”,现代炮制通常以炒制为主[4]。苍耳子主要含有挥发油、脂肪油、酚酸、苍术苷类、杂环类、蒽类、酮类和生物碱等成分,其毒性是以苍术苷等水溶性苷类成分为主[5],通过炒制加热可使其失活而降低毒性,但炮制过程中是否会对苍耳子有效成分造成影响,且不同地区的苍耳子化学成分也具有一定的差异[6],炮制后其化学成分的变化情况目前尚缺乏深入的研究和报道。因此,本研究通过分析本地区采摘的苍耳子在炮制前后挥发性成分及酚酸性成分的含量变化情况,从而探讨炮制对苍耳子有效成分的影响。
1 仪器与试剂
1.1 主要仪器及耗材
美国Agilent 公司7250 GC/Q-TOF 型气质联用系统及配套试剂耗材;美国Agilent 公司1260 Infinity Ⅱ型液相色谱系统及配套试剂耗材;深圳市洁盟清洗设备有限公司JM-05D-40 型超声波清洗仪;瑞士梅特勒-托利多XPR 微量分析天平;美国Agilent 公司PAL3 Ⅱ智能仪器及SPME Arrow PDMS/DVB(PDMS/二乙烯基苯)纤维头。
1.2 主要试剂
绿原酸(CAS:327-97-9,Catalog #C109403)、新绿原酸(CAS:906-33-2,Catalog #N110185)、隐绿原酸(CAS:905-99-7,Catalog #C117944)、洋蓟素(1,5-二咖啡酰奎宁酸,CAS:30964-13-7,Catalog#D117948)、异绿原酸A(3,5-二咖啡酰奎宁酸,CAS:2450-53-5,Catalog #I117946)和异绿原酸C(4,5-二咖啡酰奎宁酸,CAS:32451-88-0,Catalog#I111374)等分析标准品均购于上海阿拉丁生化科技股份有限公司;甲醇(CAS:67-56-1,Catalog #1.06007)、乙腈(CAS:75-05-8,Catalog#1.00030)均购于美国Sigma 公司;苍耳子自行采摘于河南省漯河市临颍县,经鉴定为菊科植物苍耳属植物苍耳(Xanthium sibiricumPatr.)干燥成熟带总苞的果实,除去梗、叶等杂质。
2 方法
2.1 苍耳子样本处理
2.1.1 炮制
称取生苍耳子500 g,参照《中华人民共和国药典》[7]炮制通则中清炒法,将苍耳子置于炒制容器内,用中火(260 ℃)炒至表面黄褐色刺焦色取出(约9 min),放凉备用。
2.1.2 水煎液制备
称取生苍耳子500 g 及炮制后苍耳子,分别加入4 000 mL 纯净水煎煮90 min 后过滤,所得残渣再加入3 000 mL 纯净水进行第二次煎煮60 min,过滤除去残渣。将2 次所得滤液合并浓缩至500 mL,制成1 g/mL的苍耳子水煎液。吸取5 mL 水煎液置100 mL 棕色容量瓶中,加入50%甲醇水溶液稀释至刻度,吸取1 mL溶液置入10 mL 棕色容量瓶内,向容量瓶加入50%甲醛水溶液稀释至刻度。
2.2 萃取
分别称取1.0 g 炮制前后的苍耳子,捣碎后置于15 mL 顶空瓶中插入萃取头,连接智能萃取仪器顶空萃取10 min后取出,用于气相色谱仪进样。
2.3 色谱
美国Waters 公司规格为100 mm × 2.1 mm、直径1.7 μm 的Acquity UPLC BEH C18色谱柱;以乙腈-0.1%磷酸水溶液为流动相,梯度洗脱,0~1 min 为3%乙腈、1~2.5 min为3%~5%乙腈、2.5~9 min为5%~15%乙腈、9~9.5 min 为15%~18%乙腈、9.5~16 min为18%乙腈、16~16.5 min 为18%~28%乙腈、16.5~19 min 为28%乙腈、19~21 min 为28%~50%乙腈、21~22 min 为50%乙腈、22~25 min 为3%乙腈;流速为1.0 mL/min,色谱柱温度为25 ℃;检测波长为327 nm。
2.4 质谱
离子源设置:EI,230 ℃,70 eV;四极杆温度设置:150 ℃;管电压设置:1.2 kV;接口温度设置:280 ℃;扫描范围设置:35~550 m/z。所得质谱图谱与美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)发布的2020 版质谱数据库比对,分析其化学成分及含量。
2.5 酚酸性成分测定
2.5.1 标准品溶液制备
精密称定绿原酸1.32 mg、新绿原酸2.93 mg、隐绿原酸1.26 mg、洋蓟素2.33 mg、异绿原酸A 0.91 mg 和异绿原酸C 1.24 mg,分别置10 mL 棕色容量瓶内,向容量瓶加入50%甲醛水溶液溶解并稀释,摇匀并定容至刻度,制备标准品溶液。分别精密量取上述标准品溶液各1 mL,置入10 mL 棕色容量瓶内,向容量瓶加入50%甲醛水溶液稀释至刻度,配制为标准品混合溶液(溶液Ⅰ)。精密量取溶液Ⅰ2 mL,置入10 mL 棕色容量瓶内,向容量瓶加入50%甲醛水溶液稀释至刻度,最终制成含绿原酸、新绿原酸、隐绿原酸、洋蓟素、异绿原酸A、异绿原酸C 浓度分别为58.6、26.4、25.2、46.6、18.2、24.8 μg/mL 的标准品混合溶液(溶液Ⅱ)。
2.5.2 精密度试验
精密吸取10 μL 溶液Ⅱ,以相同色谱条件连续进样检测6 次,比较标准品每次进样的色谱图,计算标准品6 次进样的保留时间及峰面积。绿原酸、新绿原酸、隐绿原酸、洋蓟素、异绿原酸A、异绿原酸C 的RSD 分别为1.68%、1.75%、1.25%、1.81%、1.16%、1.49%。
2.5.3 重复性试验
精密吸取6 份10 μL 溶液Ⅱ,以相同色谱条件进样,比较每份标准品的色谱图,计算6 份标准品的保留时间及峰面积。绿原酸、新绿原酸、隐绿原酸、洋蓟素、异绿原酸A、异绿原酸C的RSD分别为1.08%、1.12%、1.03%、1.18%、1.06%、1.13%。
2.5.4 稳定性试验
精密吸取10 μL 溶液Ⅱ,以相同色谱条件分别在0、2、4、8、12、24 h进样检测,比较每个时点标准品的色谱图,计算标准品6 个时点的保留时间及峰面积。绿原酸、新绿原酸、隐绿原酸、洋蓟素、异绿原酸A、异绿原酸C 的RSD 分别为1.13%、1.09%、1.21%、1.18%、1.02%、1.25%。
2.5.5 标准曲线
分别精密吸取10、4、3 μL 溶液Ⅰ及10、5、2、1 μL溶液Ⅱ,加50%甲醛水溶液至10 μL,以相同色谱条件进样,计算各标准品样本峰面积。以标准品进样量为横坐标、峰面积为纵坐标,绘制标准曲线及线性回归。绿原酸的回归方程为:Y = 2 701.359X + 8.262(r=0.999 9);新绿原酸的回归方程为:Y = 947.436X +3.376(r=0.999 9);隐绿原酸的回归方程为:Y =945.102X + 1.57(r=0.999 9);洋蓟素的回归方程为:Y = 1 015.751X + 3.78(r=0.999 9);异绿原酸A 的回归方程为:Y = 3 226.042X + 7.851(r=0.999 9);异绿原酸C 的回归方程为:Y = 1 130.026X + 9.448(r=0.999 9)。
2.5.6 酚酸性成分定量
吸取6 份10 μL 的水煎液稀释溶液,以相同色谱条件进样,计算各标准品样本峰面积,根据“2.5.5”项下所得标准曲线计算绿原酸、新绿原酸、隐绿原酸、洋蓟素、异绿原酸A、异绿原酸C 的浓度,并换算为水煎液原始浓度。使用SPSS 22.0 软件统计分析,计量资料以均数±标准差(±s)表示,统计学方法采用t检验。
3 结果
3.1 炮制前后苍耳子挥发性成分分析
生品苍耳子34 种质谱图经对比分析共得到29 种化合物,炮制后苍耳子33 种质谱图经对比分析共得到26 种化合物。生品苍耳子的挥发性成分占比为65.6%,炮制后苍耳子挥发性成分占比为76.82%,炮制前后苍耳子共有21 种共有成分,生品占比前三的分别为十八碳-9,12-二烯酸、2-茨醇和1-十一碳炔,炮制后苍耳子占比前三的分别为十八碳-9,12-二烯酸、2-茨醇和石竹烯。见表1。

表1 炮制前后苍耳子挥发性成分
3.2 炮制前后苍耳子酚酸性成分分析
炮制后绿原酸、新绿原酸、隐绿原酸与炮制前比较含量明显较高(P<0.05);洋蓟素、异绿原酸A 与炮制前比较含量明显较低(P<0.05)。见表2。
表2 炮制前后苍耳子酚酸性成分含量分析(±s,mg/mL)
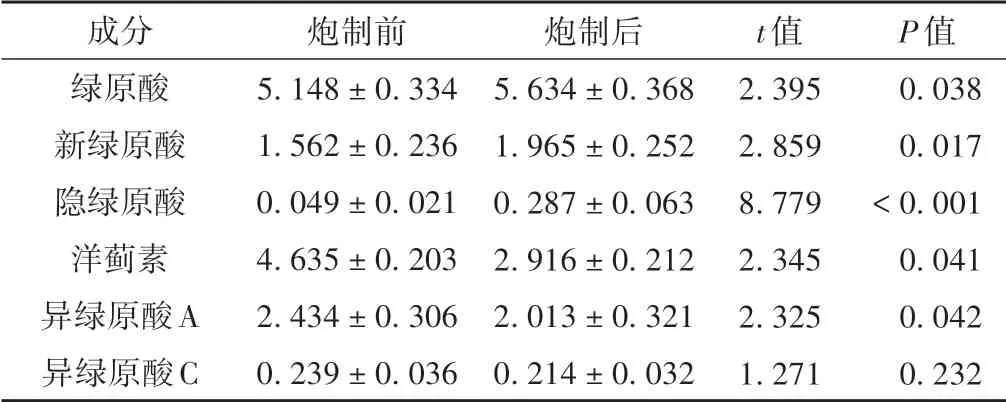
表2 炮制前后苍耳子酚酸性成分含量分析(±s,mg/mL)
成分绿原酸新绿原酸隐绿原酸洋蓟素异绿原酸A异绿原酸C炮制前5.148±0.334 1.562±0.236 0.049±0.021 4.635±0.203 2.434±0.306 0.239±0.036炮制后5.634±0.368 1.965±0.252 0.287±0.063 2.916±0.212 2.013±0.321 0.214±0.032 t值2.395 2.859 8.779 2.345 2.325 1.271 P值0.038 0.017<0.001 0.041 0.042 0.232
4 讨论
中药炮制技术是我国传统中医药学独特的制药手段,对中药具有重要的意义。中药炮制有炒法、煅法、蒸煮法及烘法等,炮制过程均需加热,加热不仅能够降低药物毒性,使中药的化学成分发生变化,还可改变药物的性味、功能,影响药物成分在肠道的吸收,引起体内转运、作用靶点的改变,影响中药的疗效,因此分析炮制前后中药化学成分的变化有利于更深入地研究炮制机制及药理机制[8-9]。生苍耳子带有毒性,入药前需要对其进行炮制以降低毒性。炒制是苍耳子最常用的炮制方法,炒制的介质、温度及时间均对苍耳子的成分有一定的影响,徐玉田[10]发现苍耳子在260 ℃温度下炒制9 min 能达到最佳的减毒增效的效果,温度过高会使有效成分大幅降低。李蒙等[11]通过小鼠动物实验发现炮制后的苍耳子镇痛、抗炎作用更显著。
挥发油类、脂肪油类等挥发性成分是苍耳子中种类最丰富的化学成分。HS-SPME 具有操作简便、无需溶剂、无污染、富集效率高等优点,特别适合于低含量挥发性成分的测定,广泛运用于食品、药品的挥发性成分的鉴定与分析研究[12-13]。HS-SPME 的萃取过程是一个非常复杂的传质过程,受到萃取头材料、时间、温度、时间等多种因素的影响。因此本研究为保证良好的萃取质量,通过称取1 g 苍耳子、PDMS/DVB 萃取纤维头、120 ℃的萃取温度等条件控制,保障了质谱峰数目、峰面积分辨良好。分析结果显示,生品苍耳子的挥发性成分占比为65.6%,炮制后苍耳子挥发性成分占比为76.82%。十八碳-9,12-二烯酸(亚油酸)生品8.5%,炮制后为15.35%。亚油酸对人体正常生命活动具有重要作用,作为细胞膜的重要组成来源,可转化为多种不饱和脂肪酸,并参与细胞信号转导过程,与机体炎症、癌症等过程有密切关联,可对鼻炎起到一定的缓解作用[14]。2-茨醇(冰片)生品6.89%,炮制后为16.24%。冰片可调节中枢神经兴奋性,具有提神醒脑、镇痛镇静的功效,还能调节血脑屏障的通透性,能促进其他药物的吸收,与其他药物联用可发挥抗微生物、抗炎等功效[15]。炮制后含量增多的石竹烯、花柏烯等也具有抑菌活性及抗肿瘤的作用。
苍耳子水煎液中的酚酸成分主要包含绿原酸、新绿原酸、隐绿原酸、洋蓟素、异绿原酸A 等咖啡酰奎宁酸类,具有良好的抗氧化、抗炎、抗微生物等作用,但其具有不稳定,易受热被分解、转化的特点[16]。胡晓雪等[17]发现不同的温度对于酚酸成分含量影响不同,随着温度的升高,绿原酸、新绿原酸、隐绿原酸含量增加,洋蓟素、异绿原酸A 等含量降低,而当温度超过260 ℃后,咖啡酰奎宁酸类均出现明显的降低。本研究分析炮制后绿原酸、新绿原酸、隐绿原酸高于炮制前,洋蓟素、异绿原酸A 低于炮制前,与姜海等[18]研究的结果相近。
综上所述,适当条件的炮制有利于保留苍耳子挥发油类、脂肪油类等挥发性成分及煎煮过程中苍耳子中咖啡酰奎宁酸类等酚酸成分的煎出,既增强药效又去除毒性。
