4′-氯地西泮和二氯西泮的大鼠肝微粒体体外代谢研究
2022-01-25赵君博邓虹霄范先煜刘万卉
李 乐,赵君博,严 慧,邓虹霄,范先煜,刘万卉,向 平
(1.烟台大学药学院,山东 烟台 264005;2.司法鉴定科学研究院,上海市法医学重点实验室,上海市司法鉴定专业技术服务平台,上海 200063)
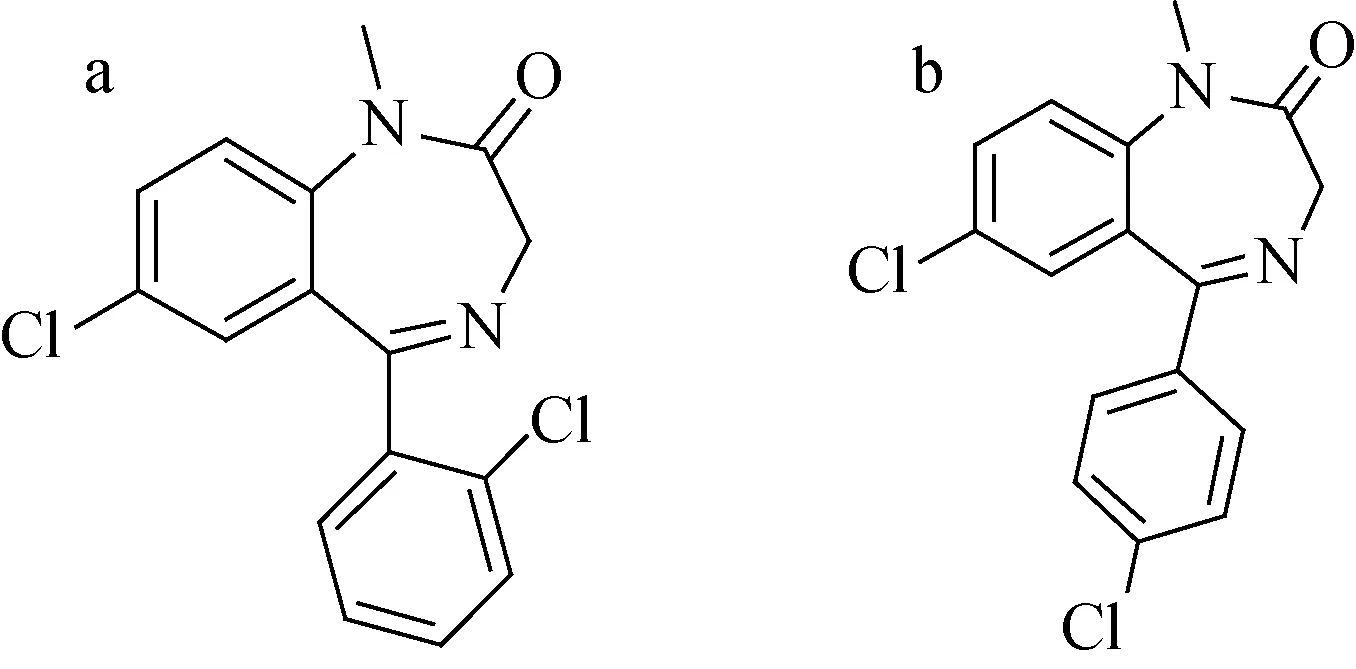
图1 二氯西泮(a)和4′-氯地西泮(b)的结构式Fig.1 Chemical structures of diclazepam (a) and 4′-chlorodiazepam (b)
肝微粒体体外温孵法可以较好地模拟人体内的代谢过程,肝脏血流量丰富而且含有大部分代谢酶,其中细胞色素P450(CytochromeP450, CYP450)酶是药物Ⅰ相代谢的重要酶系,在生物转化过程中发挥着至关重要的作用[13]。药物代谢可分为2类:Ⅰ相(氧化、还原和水解)和Ⅱ相(共轭)。该模型已经在医药学领域内广泛应用,具有简便、代谢过程快、重现性好、易大量操作等优势,在法庭科学领域对新型毒品代谢物的研究方面具有良好的应用前景。目前,美国国家科学技术研究院(National Institute of Standard and Technology, NIST)GC-MS质谱库(2017版)中缺乏二氯西泮的信息,关于这2种化合物代谢物的详细信息更是鲜有报道[14-15]。
本工作拟采用液相色谱-Q-Exactive组合型四极杆Orbitrap质谱(LC-Q-Exactive-Orbitrap-MS)技术分离并检测4′-氯地西泮和二氯西泮在体外肝微粒体孵育体系中的代谢产物,结合二级质谱(MS/MS)鉴定代谢产物的结构,并推测其代谢途径,旨为建立生物样品中该类物质的检验方法提供依据。
1 实验部分
1.1 仪器与装置
Thermo Fisher Ultimate 3000液相色谱仪,配备LC-Q-Exactive Orbitrap MS:美国Thermo Fisher公司产品,配有电喷雾离子源(HESI)及Xcalibur数据处理系统;DK-S22电热恒温水浴锅:上海精宏试验设备有限公司产品;Minspin高速离心机:德国Eppendorf公司产品;XW-80A涡旋混合器:上海医大仪器有限公司产品;Milli-Q Synthesis超纯水纯化系统:美国Millipore公司产品。
1.2 材料与试剂
二氯西泮、4′-氯地西泮: 美国Cerilliant公司产品;甲醇、乙酸铵(色谱纯): 瑞士Fluk公司产品;乙腈(色谱纯):美国Sigma-Aldrich公司产品;甲酸(色谱纯):上海安谱实验科技有限公司产品;Wistar大鼠肝微粒体(雄性,20 g/L),NADPH再生系统(1.3 mmol/L NADP+、3.3 mmol/L 6-磷酸葡萄糖、3.3 mmol/L氯化镁、0.4 U/mL 6-磷酸葡萄糖脱氢酶、0.05 mmol/L柠檬酸钠):北京汇智泰康医药技术有限公司产品。
肝微粒体送达后在室温下解冻、分装,储存于-80 ℃冰箱中。
1.3 实验条件
1.3.1色谱条件 色谱柱:Agilent Eclipse plus C18柱(100 mm×2.1 mm×5 μm),Zorbax C18保护柱(12.5 mm×2.1 mm×5 μm);流动相:A为20 mmol/L乙酸铵-0.1%甲酸-5%乙腈,B为乙腈;梯度洗脱程序:0~0.5 min(98%A),0.5~10 min(98%~2%A),10~15 min(2%A),15~16 min(98%A);柱温25 ℃;流速0.3 mL/min;进样量10 μL。
1.3.2质谱条件 电喷雾离子源正离子模式,鞘气流速35 L/h,辅助气流速15 L/h,喷雾电压3.5 kV,毛细管温度325 ℃,辅助气温度300 ℃,使用的气体均为高纯氮气,采用一级全扫描和自动触发二级(Full scan-ddMS2)的数据采集模式。
Full scan-ddMS2参数设置如下:Full MS分辨率为70 000,dd-MS2分辨率为17 500,自动增益控制为3×106,最大注入时间为200 ms,质量扫描范围为m/z70~1 050,归一化碰撞能量设置为20、40、60 eV。
1.4 肝微粒体实验
将4′-氯地西泮和二氯西泮溶解于甲醇中,制成1 g/L溶液,取2 μL加入新配制的NADPH再生系统溶液(终体积200 μL:0.01 mol/L磷酸缓冲盐溶液(pH 7.4),1.3 mmol/L NADPH+,3.3 mmol/L 6-磷酸葡萄糖,3.3 mmol/L氯化镁,0.05 mmol/L柠檬酸钠,0.4 U/mL 6-磷酸葡萄糖脱氢酶,Wistar大鼠雌雄混合混合肝微粒体)中混合,将该混合溶液置于37 ℃水浴锅中孵育4 h,再加入10 μL葡萄糖醛酸(UDPGA),孵育1 h,最后向反应体系中加入200 μL冰乙腈终止反应,涡旋3 min,13 500 r/min离心5 min,取100 μL上清液至玻璃进样瓶中,进样量为10 μL,进行LC-HRMS分析。
用相同的方法设置了3个对照组,分别是:对照组1(不添加肝微粒体)、对照组2(不添加NADPH)、对照组3(不添加底物)。
2 结果与讨论
2.1 4′-氯地西泮的质谱分析
在正离子模式下,4′-氯地西泮的保留时间为9.09 min,准分子离子峰[M+H]+为m/z319。在ESI离子源下,m/z319经碰撞诱导解离后产生的主要碎片离子为m/z291、256、227、154。其中m/z291是丢失了1个中性碎片CO形成的,裂解产生的m/z256碎片离子峰比m/z291碎片离子小35 u,表明丢失了1个氯原子,m/z256断裂失去1个中性碎片CH2NH形成碎片子离子m/z227,在此基础上断裂5位上的苯环,从而产生了特征峰强度最高的碎片离子m/z154,详细的裂解途径示于图2。
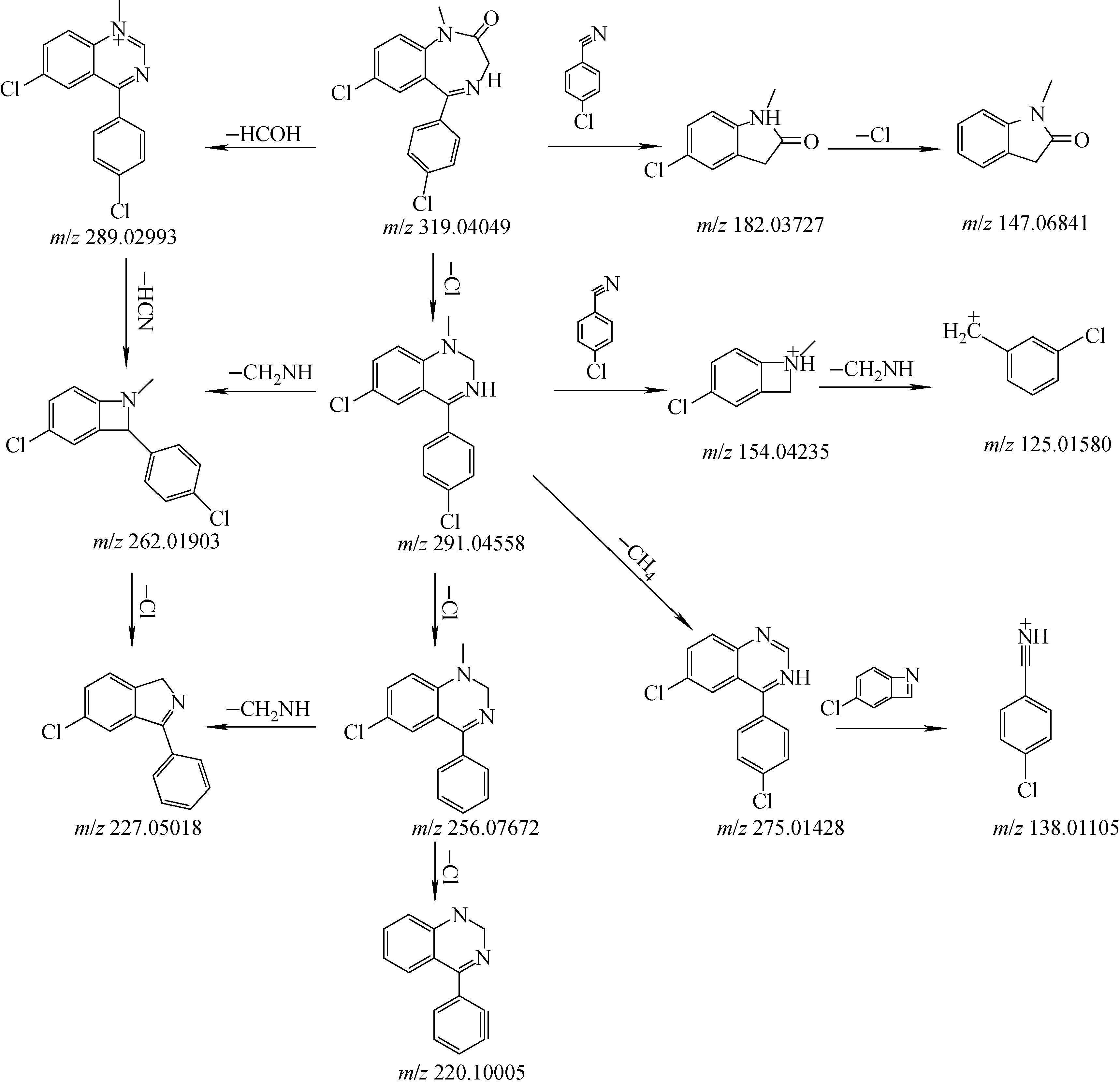
图2 在正离子模式下,4′-氯地西泮的质谱裂解途径Fig.2 Fragmentation pathways of 4′-chlorodiazepam in positive ion mode
2.2 4′-氯地西泮的代谢产物分析
采用LC-Q-Exactive Orbitrap MS进行分析,通过对比实验组和空白组的质谱图,结合碎片离子信息和4′-氯地西泮的裂解规律,根据精确质量数、同位素分布、二级质谱图特征碎片离子等信息,对可能的代谢物进行定性分析,从样品的总离子流图中共鉴定出5种Ⅰ相代谢产物和2种Ⅱ相代谢产物,对应的提取离子流图示于图3。4′-氯地西泮的主要生物转化途径包括羟基化、脱烷基化以及与葡萄糖醛酸结合。4′-氯地西泮经肝微粒体体外代谢产物的反应类型、化学结构式、保留时间、质子化分子离子[M+H]+质量数(m/z)及质量偏差列于表1。4′-氯地西泮 (M0)及其代谢产物(M1~M7)的二级质谱图示于图4。
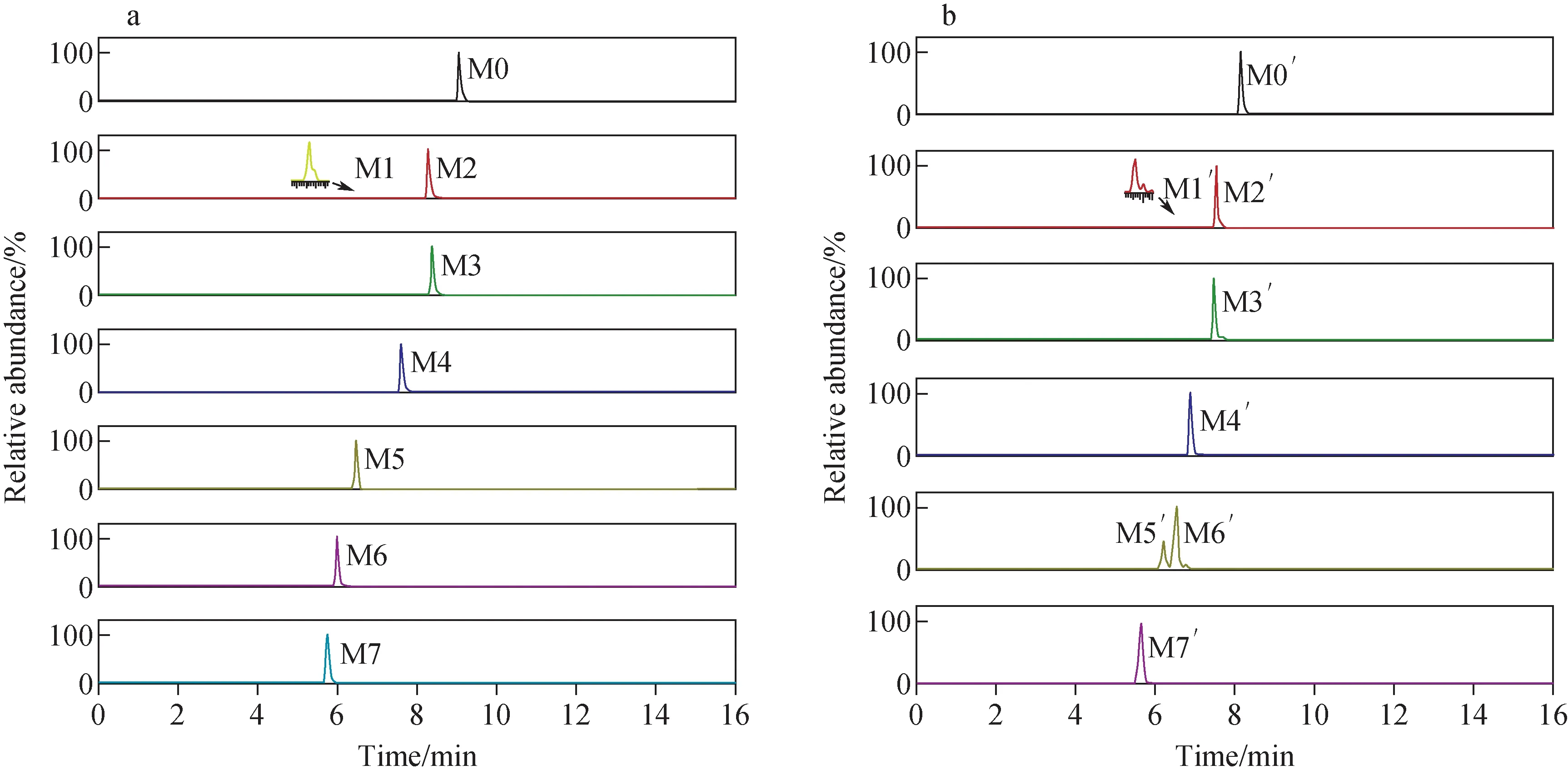
图3 4′-氯地西泮(a)、 二氯西泮(b)及其代谢产物的LC-MS提取离子流图Fig.3 Extracted ion chromatograms (EIC) of 4′-chlorodiazepam (a), diclazepam (b) and its metabolites
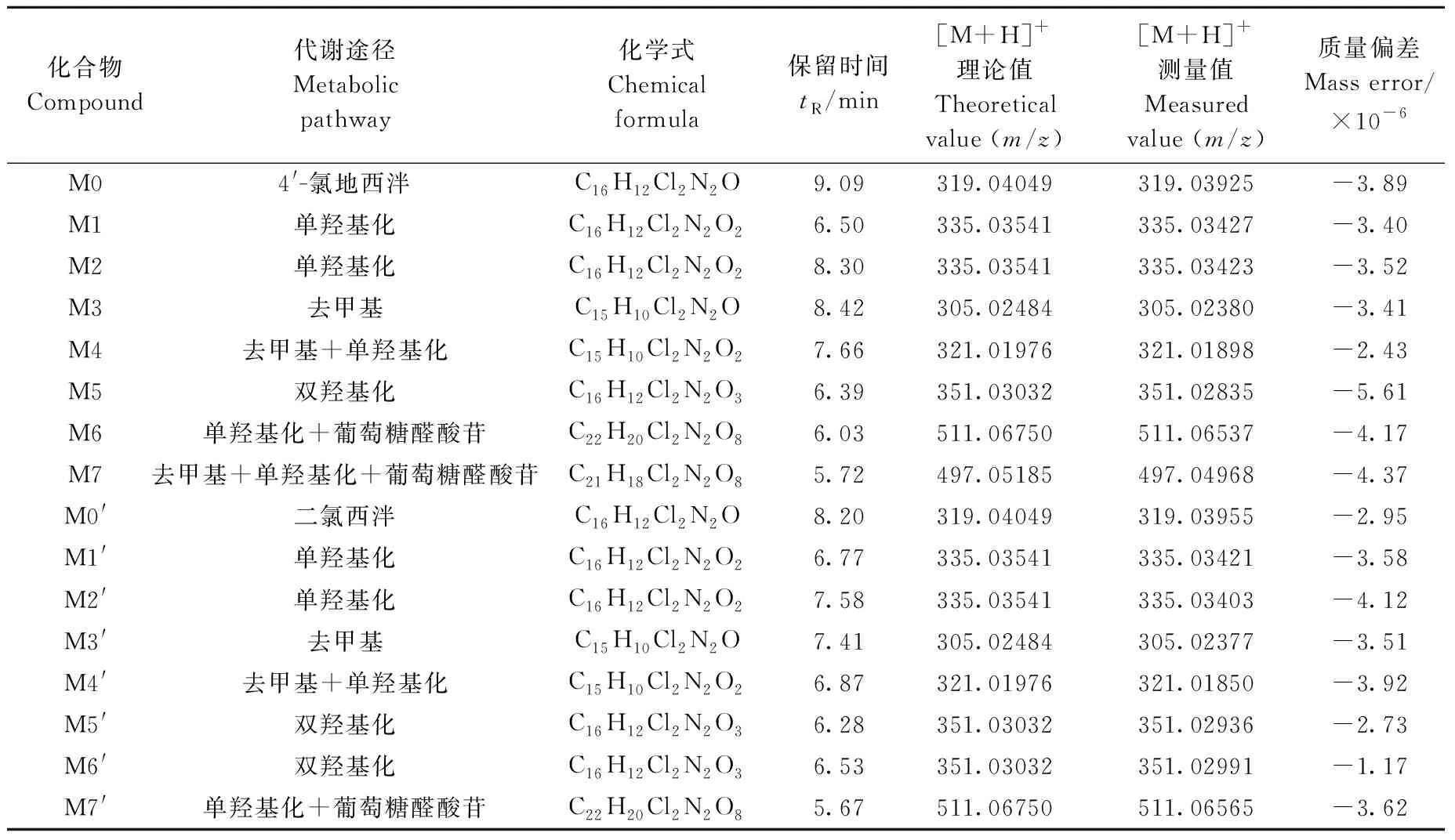
表1 4′-氯地西泮和二氯西泮经肝微粒体体外代谢的代谢产物信息Table 1 Data of metabolism of 4′-chlorodiazepam and diclazepam in liver microsomes in vitro

图4 4′-氯地西泮及其代谢产物经碰撞诱导解离后的MS2图Fig.4 MS2 spectra of 4′-chlorodiazepam and its metabolites by collision induced dissociation
2.2.1M1和M2代谢物分析 代谢物M1和M2的准分子离子均为m/z335[M+H]+,保留时间分别为6.63、8.30 min,比4′-氯地西泮准分子离子大16 u,推测是单羟基化代谢产物。4′-氯地西泮分子中含有2个氯原子,因此,M1和M2也应含有2个氯原子,且出现同位素峰[M+H+2]+(m/z337)和[M+H+4]+(m/z339),同时出现峰强度比值[M+H]+(m/z335)∶[M+H+2]+(m/z337)∶[M+H+4]+(m/z339)=9∶6∶1,推测M1和M2可能是4′-氯地西泮的氧化代谢产物,属于同分异构体。此外,M1准分子离子峰m/z335的二级碎片离子m/z289是在分子离子峰的基础上同时脱去1分子CO和H2O形成的,继续脱去CH2NH形成离子m/z260,推测可能是代谢产物M1-1或M1-2。而M2是4′-氯地西泮主要的代谢产物之一,其特征碎片是m/z317和m/z289,准分子离子[M+H]+m/z335首先脱掉1分子水形成碎片离子m/z317,在此基础上脱去1分子CO后形成m/z289,与4′-氯地西泮的裂解方式一致。结果表明,M2为3位上的羟基取代的代谢产物(氯甲西泮),主要碎片离子与相关文献[14]报道一致。
2.2.2M3代谢物分析 代谢物M3的准分子离子峰m/z305[M+H]+,保留时间为8.42 min,与4′-氯地西泮的准分子离子m/z319相差14 u,因此,推测丢失了CH2,即M3是在4′-氯地西泮的基础上N-脱烷基化得到的代谢产物(地洛西泮)。代谢产物M3也含有2个氯原子,且符合同位素峰[M+H]+(m/z305):[M+H+2]+(m/z307):[M+H+4]+(m/z309)=9∶6∶1,准分子离子m/z305的特征碎片为m/z277和242,与4′-氯地西泮的特征碎片m/z291和256分别相差14 u,可参考原药4′-氯地西泮的断裂方式,苯二氮环上脱去1分子CO形成碎片离子m/z277,在此基础上C—Cl键断裂形成m/z242。
2.2.3M4代谢物分析 代谢物M4的准分子离子峰[M+H]+m/z321,保留时间为7.66 min,与4′-氯地西泮的准分子离子相差2 u,去甲基后的相对分子质量减少了14 u,氧原子的相对原子质量为16 u,推测M4′是经过N-脱烷基和单羟基化得到的代谢产物(劳拉西泮)。代谢产物M4中含有2个氯原子,同样符合同位素峰[M+H]+(m/z321)∶[M+H+2]+(m/z323)∶[M+H+4]+(m/z325)=9∶6∶1,进一步证实了该推测。准分子离子[M+H]+m/z321的主要碎片离子为m/z303、275和138,其中碎片离子m/z321脱去1分子水后形成m/z303,在此基础上失去1分子CO形成碎片离子m/z275。
2.2.4M5代谢物分析 代谢物M5的准分子离子峰[M+H]+m/z351,保留时间为6.39 min,与4′-氯地西泮的准分子离子相差32 u,氧原子的相对原子质量为16 u,推测该化合物为4′-氯地西泮的双氧化代谢产物,同时符合同位素峰[M+H]+(m/z351):[M+H+2]+(m/z353)∶[M+H+4]+(m/z355)=9∶6∶1,进一步证实了推测。但因为该代谢产物的浓度较低,没有得到相应的二级质谱图,故推测M5为双羟基化代谢产物。
2.2.5M6和M7代谢物分析 代谢物M6的准分子离子峰[M+H]+m/z511,保留时间为5.97 min,与4′-氯地西泮的准分子离子相差192 u,葡萄糖醛酸苷的相对分子质量为176 u,同时符合同位素峰[M+H]+(m/z511)∶[M+H+2]+(m/z513)∶[M+H+4]+(m/z515)=9∶6∶1,推测其为Ⅰ相代谢物M1或者M2的葡萄糖醛酸结合物。根据图4可知,代谢物M6在裂解过程中还形成了碎片离子m/z317、239和180,进一步验证了该化合物为M2的葡萄糖醛酸结合物。
代谢物M7的准分子离子峰[M+H]+m/z497,保留时间为5.72 min,与4′-氯地西泮的准分子离子相差178 u,其中葡萄糖醛酸苷的相对分子质量为176 u,去甲基后的相对分子质量减少了14 u,符合同位素峰[M+H]+(m/z497)∶[M+H+2]+(m/z499)∶[M+H+4]+(m/z501)=9∶6∶1,推测M7先发生了去甲基化和羟基化反应生成代谢产物,在此基础上与葡萄糖醛酸苷结合形成代谢物M7。同时根据图4可得,代谢物M7在裂解过程中形成碎片离子m/z303和275,证实了代谢物M7是M4的葡萄糖醛酸结合物。
2.3 二氯西泮的代谢产物鉴定
采用LC-Q-Exactive Orbitrap MS得到了二氯西泮实验组和空白组的总离子流图。通过对比2组质谱图,结合碎片离子信息和二氯西泮的裂解规律,从样品的总离子流图中共鉴定出6种Ⅰ相代谢产物和1种Ⅱ相代谢产物,对应的提取离子流图示于图3。根据二氯西泮的结构特点和在肝微粒体中主要发生的代谢反应,总结了二氯西泮经肝微粒体体外代谢产物的反应类型、化学结构式、保留时间、质子化分子离子[M+H]+质量数(m/z)及质量偏差,列于表1。二氯西泮(M0′)及其代谢产物(M1′~M7′)的二级质谱图示于图5。
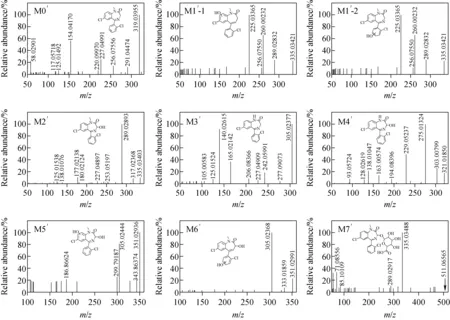
图5 二氯西泮及其代谢产物经碰撞诱导解离后的MS2图Fig.5 MS2 spectra of diclazepam and its metabolites by collision induced dissociation
在正离子模式下,二氯西泮的保留时间为8.20 min,准分子离子峰为[M+H]+m/z319,在ESI离子源下,m/z319经碰撞诱导解离后产生的主要碎片离子为m/z291、256、227、154、125。其中m/z291是丢失了1个中性碎片CO产生的,裂解产生的m/z256碎片离子比m/z291小35 u,表明丢失了1个氯原子,m/z256的碎片子离子断裂失去1个中性碎片CH2NH产生碎片子离子m/z227,碎片离子m/z291继续断裂5位上的苯环,从而产生碎片离子m/z154,失去1分子CH2NH生成m/z125,裂解途径可参考图2。
代谢产物M1′、M2′、M3′、M4′的裂解途径可参考4′-氯地西泮的代谢产物M1、M2、M3、M4的碎片裂解途径,这里不再赘述。
代谢物M5′和M6′与二氯西泮的准分子离子相差32 u,推测该化合物为二氯西泮的双氧化代谢产物,同时符合同位素峰[M+H]+(m/z351)∶[M+H+2]+(m/z353)∶[M+H+4]+(m/z355)=9∶6∶1,进一步证实了推测。代谢产物M5′、M6′的保留时间分别为6.28和6.53 min,表明都是在二氯西泮的基础上发生了双羟基化反应,主要碎片离子为m/z305,表明碎裂时首先失去了1分子水生成m/z333离子,失去1分子CO生成m/z305离子,但难以确定羟基化的具体位置,故推测M5′、M6′为双羟基化代谢产物。
代谢产物M7′的准分子离子为m/z511,与m/z335相差176 u,推测为单羟基化Ⅰ相代谢产物的葡萄糖醛酸结合物,同时符合同位素峰[M+H]+(511)∶[M+H+2]+(513)∶[M+H+4]+(515)=9∶6∶1,进一步证实了推测。碎裂时首先失去葡萄糖醛酸苷,得到了代谢产物M2′,且M7′产生的特征碎片离子m/z317和289与M2′的碎片离子一致,故推测代谢物M7′为代谢产物M2′的葡萄糖醛酸结合物。
2.4 讨论
本研究通过大鼠肝微粒体体外孵育体系模拟人体内的代谢,对4′-氯地西泮和二氯西泮的代谢物和代谢途径进行了研究,利用LC-Q-Exactive-Orbitrap-MS联用技术分析得到代谢产物。4′-氯地西泮在大鼠肝微粒体中经代谢共产生5种Ⅰ相代谢产物和2种葡萄糖醛酸化的Ⅱ相代谢产物,其中N-去甲基-4′-氯地西泮、3-羟基-4′-氯地西泮和N-去甲基-3-羟基-4′-氯地西泮有文献[14]报道。二氯西泮在大鼠肝微粒体中经过代谢共产生6种Ⅰ相代谢产物和1种葡萄糖醛酸化的Ⅱ相代谢产物,其中氯甲西泮、地洛西泮和劳拉西泮有文献[14]报道,主要涉及的代谢途径包括去甲基化、羟基化和葡萄糖醛酸化。根据鉴定所得的代谢产物结构可以推断出4′-氯地西泮和二氯西泮及其代谢产物之间的代谢途径,分别示于图6和图7。4′-氯地西泮和二氯西泮原药及其代谢产物的裂解途径具有类似的裂解过程(脱掉CO、H2O、CH4等中性碎片)和相同的质谱碎片,碎片离子的丰度存在差异,但根据保留时间可以进行较好区分。其中,双羟基代谢产物为首次发现,4′-氯地西泮经过肝微粒体体外孵育后共得到2个双羟基代谢产物,而二氯西泮只获得1种双羟基代谢产物,推测可能是氯原子取代位置的不同使化合物的化学性质发生改变,原因有待进一步研究。实验发现,代谢物M2、M3、M4、M2′、M3′、M4′的含量较其他的代谢产物高,因此,M2、M3、M4可作为4′-氯地西泮临床或滥用监测的代谢标志物,M2′、M3′、M4′可作为二氯西泮滥用监测的代谢标志物。今后研究可通过实际案件中收集到的阳性血、尿样品加以证实。
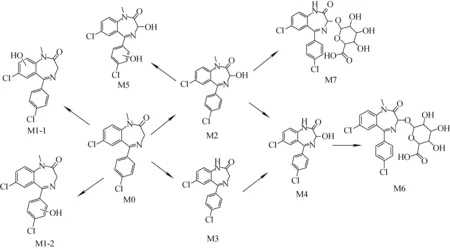
图6 4′-氯地西泮肝微粒体体外代谢的代谢途径Fig.6 Metabolic pathways of 4′-chlorodiazepam with liver microsome in vitro

图7 二氯西泮肝微粒体体外代谢的代谢途径Fig.7 Metabolic pathways of diclazepam with liver microsome in vitro
3 结论
本研究通过大鼠肝微粒体体外孵育体系结合LC-Q-Exactive-Orbitrap-MS联用技术分析各代谢产物的色谱保留时间、高分辨质谱数据以及碎片离子信息等,共鉴定到7种4′-氯地西泮的代谢产物和7种二氯西泮的代谢产物,推测主要发生了脱烷基化、羟基化和葡萄糖醛酸结合等代谢反应,初步阐明了4′-氯地西泮和二氯西泮的Ⅰ相和Ⅱ相代谢途径。该结果可为研究4′-氯地西泮和二氯西泮在人体内的代谢行为提供借鉴,为临床医学及法医学实验室及相关案件的检测提供参考。
