重组Klotho蛋白对骨髓来源M1型巨噬细胞向M2型巨噬细胞转变的影响*
2022-01-24许志华曾晓聪
陈 明,许志华,曾晓聪
(广西医科大学第一附属医院心内科,南宁 530021)
Klotho 是1997 年Kuro-o 等发现的一种哺乳动物抗衰老基因[1],大多数表达于肾脏远曲小管和大脑脉络膜丛。其在细胞内分别有膜结合型Klotho(α-Klotho)、可溶型Klotho(β-Klotho)和分泌型Klotho(γ-Klotho)3种形式蛋白[2-3]。膜结合型Klotho(α-Klotho)主要通过介导骨分泌激素纤维母细胞生长因子(fibroblast growth factor,FGF)23的活性来调节钙磷离子。而分泌型Klotho 和可溶型Klotho 主要作为激素释放到体液靶向作用于细胞,从而发挥抗氧化应激、能量代谢和抗炎症等作用[4]。有研究报道,Klotho 表达的降低通过促进M1 型极化加速了糖尿病肾病的进展[5],表明Klotho 可能存在对巨噬细胞极化调控。
巨噬细胞在遭遇宿主的感染时会在功能上极化为M1 和M2 巨噬细胞。在体外实验中,M1 型巨噬细胞由脂多糖(lipopolysaccharide,LPS)和干扰素-γ(interferon-γ,IFN-γ)诱导,M2 巨噬细胞常用白细胞介素4(interleukin-4,IL-4)诱导[6]。每种巨噬细胞表型都具有特定生物标志物定义,M1 型标志物有一氧化氮合酶(inducible nitric oxide synthase,iNOS)和CD86[7]。M1 亚型巨噬细胞分泌大量的促炎反应因子,如肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、白细胞介素-1β(interleukin-1 beta,IL-1β),这些炎症因子会抑制组织再生和伤口修复。M2 表型的标志物包括CD206、白细胞介素-10(interleukin-10,IL-10)、精氨酸酶1(arginase 1,Arg-1),具有促进组织修复、血管生成和抗炎等多重作用[8]。因此,在炎症的发展中如何调控M1 和M2 型巨噬细胞之间平衡显得尤为重要。本研究主要探讨Klotho 对骨髓来源M1 型巨噬细胞向M2 型巨噬细胞转变的影响,从而为Klotho在临床治疗中的应用提供理论依据。
1 材料和方法
1.1 实验动物、试剂和主要仪器
从广西医科大学实验动物中心购买无特定病原体(specific pathogen free,SPF)6 周龄C57BL/6J小鼠(许可证号:SYXK 2014-0003);重组Klotho 蛋白(R&D 公司);F4/80、CD11b 流式抗体(BD 公司);DMEM 培养基和胎牛血清(美国Gibco 公司);iNOS 单克隆抗体、TNF-α 单克隆抗体和Arg-1 多克隆抗体(美国cell signaling Technology 公司);巨噬细胞集落刺激因子M-CSF(美国PeproTech 公司);脂多糖LPS(sigma 公司);全套RT-PCR 试剂(日本TaKaRa 公司);细胞培养箱(Thermo,美国);FACSCantoII 流式细胞仪(BD,美国);酶标仪购于美国Thermo Fisher Scientific 公司;Odyssey 双色红外荧光成像系统购于美国LI-COR公司。
1.2 骨髓来源巨噬细胞培养
取若干只6 周龄左右雄性小鼠,1.25%阿佛丁0.5 mL麻醉后脱颈处死,在细胞超净台上剥离小鼠的股骨和胫骨,酒精灯旁用PBS反复冲洗骨髓腔至骨质透亮,收集冲洗液经100 μm 细胞筛网过滤,于4 ℃,离心7 min得细胞沉淀,然后在细胞沉淀中加入3 mL 红细胞裂解液,混匀冰上静置10 min,然后加入20 mL PBS 液重悬,离心弃上清液,重新10 mL PBS 洗涤1 次,离心。加入含有30 ng/mL MCSF 培养基进行细胞计数铺于6 孔板。3 d 后换液加浓度为30 ng/mL M-CSF 的DMEM 低糖培养基,继续培养4 d后进行实验。
1.3 细胞免疫荧光鉴定BMDMs 并检测TNF-α 和Arg1蛋白表达
收集细胞,用4%多聚甲醛固定15 min,结束后用PBST 洗涤。然后8%左右的山羊血清封闭2 h,孵育F4/80(1∶100)、CD11b(1∶100)、TNF-α(1∶200)、Arg-1(1∶200) 4 度过夜,次日PBS 清洗完后室温避光孵育荧光二抗(1∶200),最后滴加DAPI 1~2 滴,倒置荧光显微镜观察荧光并拍照。
1.4 细胞流式术验证骨髓来源巨噬细胞
收集细胞,取100 万左右细胞置于流式管中,100 μL PBS重悬,设立阴性管,单阳管,各管分别加入0.5 μL PE-F4/80、PE/Cy5-CD11b流式抗体进行单标和双标,避光孵育40 min。300 μL PBS 重悬上机检测。
1.5 骨髓来源性巨噬细胞干预和分组
将BMDMs 细胞分成空白组、LPS 组、LPS+Klotho组,分别对各组进行相应处理。空白组:普通培养基培养6 h 后换新培养基继续培养42 h;LPS组:含LPS(100 ng/mL)的培养基培养6 h,后换成普通血清培养基培养42 h;LPS+Klotho 组,用含LPS(100 ng/mL)的血清培养基培养6 h,后换成含有1 μg/mL Klotho 蛋白培养基培养42 h。上述各组细胞分别收集细胞进行检验。
1.6 RT-qPCR检测IL-10、IL-6、IL-1β、iNOS和Arg-1 mRNA含量
RNA 提取:收集细胞,6 孔板每孔加入1 mL 的RNA 裂解液,收集裂解液并且加入0.2 mL 氯仿,充分震荡成乳白色后静置5 min,在离心机12 000×g离心15 min 完后液体分成3 层,小心吸取上层溶液转移新的离心管并加入1 mL异丙醇,上下混匀静置10 min,然后12 000×g 离心10 min 得RNA 沉淀,1 mL 70%乙醇清洗RNA 沉淀,最后在用20 μL DEPC 水溶解总RNA。RNA 的浓度值和纯度用紫外分光光度计测量,浓度在500~800 ng/μL,OD260/OD280 在1.8~2.0 之间。逆转录:用逆转录试剂将1 000 ng RNA进行逆转录cDNA。RT-qPCR:按说明书设定PCR 上机参数,预变性(95 ℃,30 s),变性(95 ℃,5 s),退火(60 ℃,31 s),40个循环。2-ΔΔCt法分析样本mRNA 含量。选用内参基因GAPDH进行校准。每个实验组设计4 复孔,引物均由生工公司设计合成。引物序列如下:IL-10 正向5’-CAAGGCAGTGGAGCAGGTGAAG-3’,反向5’-CGCTTTGGTGAGTAGACAGAGGTC-3’;IL-6 正向5’-CTT-CTTGGGACTGATGCTGGTGAC-3’,反向5’-TCTGTTGGGAGTGGTATCCTCTGTG-3’;IL-1β 正向5’-AGCTTCAGGCAGGCAGTATC-3’,反向5’-TCATC-TCGGAGCTGTAGTG-3’;iNOS正向5’-ATCTTGGAGCGAGTTGTGGATTGTC-3’,反向5’-TAGGTGAGGGCTTGGCTGAGTG-3’;Arg-1 正向5’-AGACAGCAGAGGAGGTGAAGAGTAC-3’,反向5’-AAGGTAGTCAGTCCCTGGCTTATGG-3’;GAPDH 正向5’-AGAACATCATCCCTGCCTCTACT-3’,反向5’-GATGTCATCATATTTGGCAGGTT-3’。
1.7 Western blotting 检测iNOS 和Arg-1 蛋白表达水平
收集细胞,在冰上加入RIPA(含1%PMSF)裂解液提取BMDMs 总蛋白,离心取上层清液,制作BCA标准曲线并测样本蛋白溶度,15孔板每孔上样量35 μg 蛋白进行电泳分离,电泳结束转移PDVF(0.45 μm)上转膜(100 V,80 min),结束后快速封闭液封闭15 min,孵育Arg-1(1∶1 000)、iNOS(1∶1 000)4 ℃过夜。次日TBST洗涤液清洗3次,每次15 min,孵育荧光二抗(1∶15 000)室温摇床45 min,用双色红外激光成像系统显影,重复4 次,采用GAPDH 作为内参,用Image J 软件对蛋白灰度值分析。
1.8 统计学方法
采用GraphPad Prism 7 分析数据,计量资料采用均数±标准差()表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 骨髓来源性巨噬细胞形态与鉴定
免疫荧光显示,大多数细胞都是CD11b(绿色)和F4/80(红色)双阳性细胞,细胞呈现不同的多边形不规则形态(图1A);细胞流式结果显示,用MCSF 刺激因子诱导的骨髓来源性巨噬细胞高表达F4/80 和CD11b,双阳性细胞占总的细胞数目的98.4%(图1B);普通光镜下观看到诱导成熟骨髓来源性巨噬细胞形态,呈现不规则形态(图1C)。
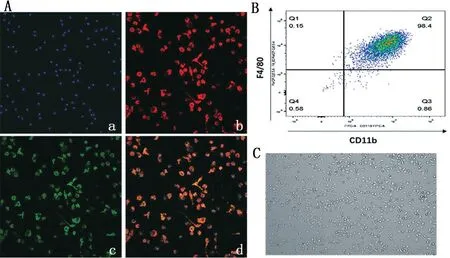
图1 骨髓来源性巨噬细胞的鉴定和形态
2.2 巨噬细胞极化相关分子mRNA 及相关蛋白表达
RT-qPCR 结果显示,LPS 组的IL-1β、iNOS、IL-6 mRNA 表达量高于空白组(P<0.001)。而与LPS组相比,LPS+Klotho 组Arg-1 和IL-10 的mRNA 表达量显著增高,iNOS、IL-1β 和IL-6 mRNA 降低(P<0.001)。与空白组相比,LPS组高表达iNOS蛋白,低表达Arg-1 蛋白;与LPS 组比较,LPS+Klotho组Arg-1 蛋白表达显著增加(P<0.001),iNOS 蛋白表达降低(P<0.001),见图2。
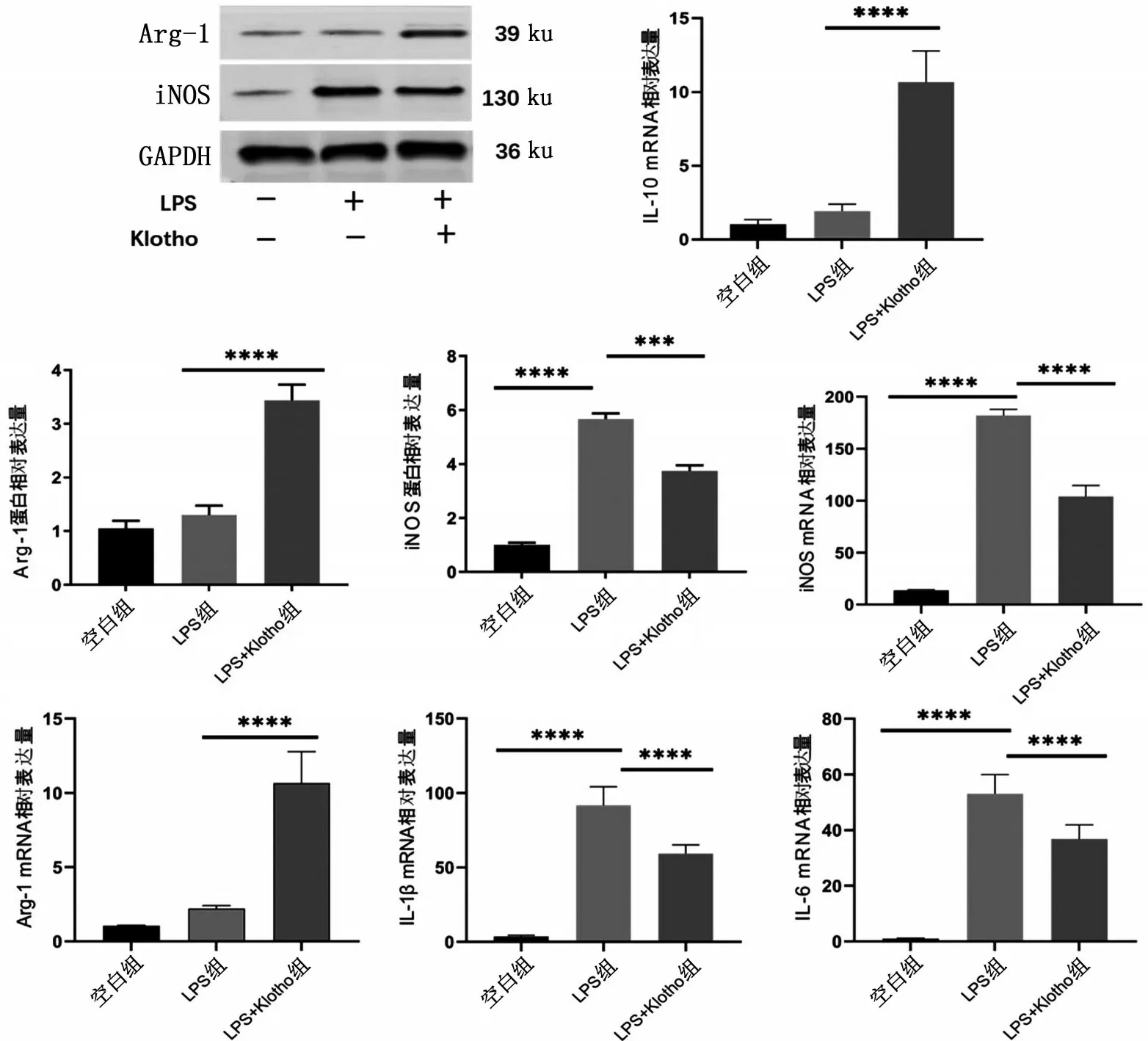
图2 3组骨髓来源性巨噬细胞分型相关分子mRNA和蛋白表达情况
2.3 TNF-α和Arg-1蛋白免疫荧光
与空白组相比,LPS 组高表达TNF-α(绿色)。与LPS组相比,LPS+Klotho组降低TNF-α(绿色)的含量,显著提高Arg-1(红色)的表达,见图3。

图3 3组骨髓来源性巨噬细胞TNF-α和Arg-1蛋白表达情况
3 讨论
炎症反应在生物体内有利有弊,适度的炎症可以帮助机体防御病毒和细菌,但过度的炎症造成组织损伤。有相关研究表明,巨噬细胞极化在心血管疾病中产生巨大影响[9-11]。IKKɑ在LPS刺激后调节MEK1/2-ERK1/2 和下游p65 信号级联,通过负调节巨噬细胞极化到M1 表型来防止心肌I/R 损伤的发展[12]。MSC-Exo 通过miR-182 调控toll 样受体4(TLR4)改变巨噬细胞极化状态从而减轻小鼠的心肌I/R损伤[12]。在整个炎症的发生发展中,决定巨噬细胞的极化方向因子很多,比如细胞内的传导信号通路和刺激因子。而巨噬细胞的亚型处于一个动态平衡,最终决定炎症的方向是巨噬细胞向哪一个方向极化。细菌性脂多糖是一种用来诱导炎症的革兰阴性菌的毒素,能诱导巨噬细胞M0向M1型巨噬细胞转变,同时促进细胞因子IL-6、TNF-α 的分泌,以及提高iNOS蛋白的表达,常用来建立细胞炎症模型[13]。在炎症发展的最初阶段,主要是以M1型巨噬细胞为主,但是随着炎症的进展,机体内巨噬细胞会由M1 型巨噬细胞会转换成M2 型巨噬细胞,进而对机体进行修复。所以,在炎症发展的过程中,如何让M1 型巨噬细胞加快结束,促进M2 型巨噬细胞的提前到来成为了现今的研究方向。但是,最新的研究显示,M1型巨噬细胞在体内很难向M2型巨噬细胞转变[14]。所以,如何在疾病炎症中平衡巨噬细胞M1/M2的表型又成为今后的研究热点。
关于Klotho 是否影响骨髓来源性巨噬细胞表型转变的研究尚不多见。因此,本研究采用巨噬细胞集落刺激因子M-CSF 将小鼠骨髓干细胞诱导成巨噬细胞M0,并对其进行流式细胞术和细胞免疫荧光双重鉴定,证实了诱导分离的是骨髓来源性巨噬细胞,符合国际巨噬细胞指南[15]。首先用脂多糖(LPS)刺激M0巨噬细胞成为M1型巨噬细胞,然后用重组Klotho蛋白对M1型巨噬细胞进行干预。本研究结果显示,LPS 显著上调骨髓来源性巨噬细胞M0的TNF-α、IL-6、iNOS表达,提示诱导M0巨噬细胞成M1型巨噬细胞。但是进行Klotho干预后,M1型标志物iNOS 和TNF-α 表达降低。M2 型巨噬细胞标志物IL-10、Arg1 蛋白明显增高,证实了Klotho可抑制LPS 诱导的巨噬细胞向M1 型极化,促进巨噬细胞向M2 型转换,但是具体的调控方式还需要进一步研究。最近关于Klotho 在炎症相关疾病的研究很多,有研究表明,炎症因子TWEAK和TNF-α减低了肾脏Klotho 的表达[16],与本文研究结果一致。除此之外,Klotho除了抗衰老,还具有特别广泛的功能,包括抗氧化损伤、细胞凋亡、矿物质代谢调节、纤维化和高血压等[3,17-21],具有广泛的研究前景。
综上所述,Klotho蛋白能够抑制巨噬细胞向M1型极化,促进向M2型巨噬细胞转变,为Klotho治疗心血管疾病提供了体外理论上的支持。
