弗林蛋白酶的研究进展*
2022-01-24宋方茗高一洁刘志娟王闻楚徐家科
宋方茗,高一洁,刘志娟,刘 倩,王闻楚,徐家科△
(1.广西医科大学 广西再生医学重点实验室 再生医学研究中心,南宁 530021;2.澳大利亚西澳大学生物医学系,珀斯 6009 ;3.再生医学与医用生物资源开发应用协同创新中心,南宁 530021;4.广西医科大学生命科学研究院,南宁 530021;5.广西医科大学长寿与老年相关疾病教育部重点实验室,南宁 530021)
弗林蛋白酶(Furin)属于内切蛋白酶,在机体内发挥重要作用,Furin 主要存在于哺乳动物体内,并且与酵母Kexin 蛋白酶及枯草杆菌蛋白酶(Subtilisin)有同源性。Furin基因最早由Roebroek[1]发现位于第15 号染色体原癌基因c-fes/fps的上游,该基因编码的蛋白产物命名为Furin。后来,Fuller等[2]发现Furin 在催化结构域上与酵母kexin 有高度同源性,因此证实了Furin 是哺乳动物前体转化。作为一种关键的剪切酶,Furin 能切割前体蛋白,使前体蛋白获得生物活性,维持细胞内环境的稳定。然而,近年有关Furin 的研究发现,Furin 与许多疾病的发生过程都密切相关,例如肿瘤、病毒感染、骨相关疾病等[3]。因此,本文对近几年的Furin生物学功能展开综述,通过相关疾病发病机制的最新研究,为疾病预防和治疗提供新靶点。
1 Furin 生物学背景
1.1 结构特点
Furin 是一种由794 个氨基酸残基组成的Ⅰ型跨膜蛋白,其前体蛋白相对分子质量为104 ku,活化后的相对分子质量为98 ku[4]。Furin 蛋白的主要结构包括信号肽、前体肽、枯草杆菌蛋白酶样催化结构域、P-结构域、富含半胱氨酸的结构域、疏水性的C-端跨膜结构域以及由58 个残基组成的C 端细胞质结构域[5],如图1 所示。信号肽提供转运的信号,决定Furin 在内质网中的定位。信号肽之后是一段含有约100 个氨基酸残基的前体肽,该前体肽对Furin 的催化活性和运输非常重要,在Furin 蛋白翻译后加工的过程中,它不仅能作为分子伴侣使蛋白质正确折叠,而且在加工时被切除的前体肽能与蛋白质非共价结合,一起运输到反高尔基体网络(trans-golgi network,TGN)和未成熟分泌小体(immature secretory granules,ISG)[6]。Furin的催化结构域包含丝氨酸蛋白酶特有的氨基酸残基:丝氨酸(Ser)、组氨酸(His)、天冬氨酸(Asp),负责切割底物,在催化过程中起关键作用。P-结构域能帮助蛋白质正确折叠以及增强蛋白质的稳定性,它对pH和Ca2+浓度有依赖性,在pH 为7.0、1 mmol/L Ca2+条件下Furin 活性最高。与P-结构域相邻的是一段富含半胱氨酸的结构域,该区域含有与蛋白质折叠有关的信息[7]。疏水性的C-端跨膜结构域能帮助Furin 定位在细胞的膜结构上。在跨膜结构域之后的细胞质结构域引导成熟Furin 在不同胞内部位的转运和定位,Furin的转运由该区域丝氨酸残基的磷酸化和去磷酸化控制[5]。
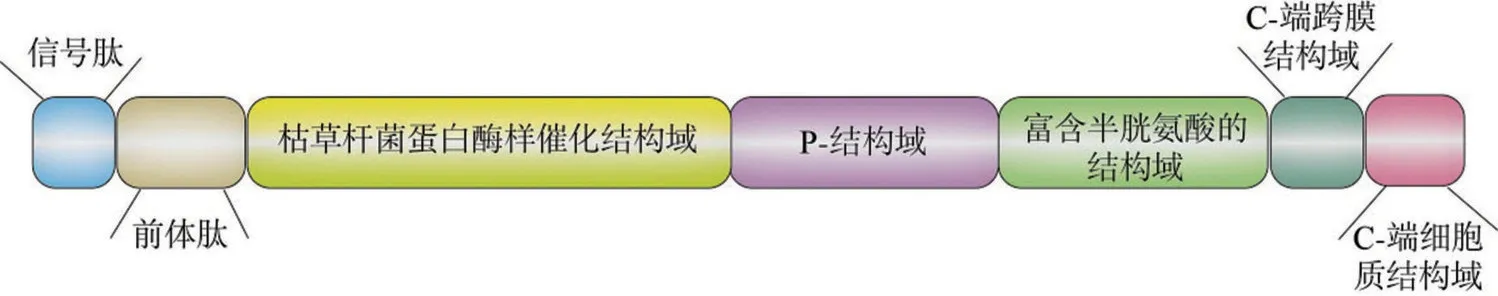
图1 Furin结构图
1.2 Furin自剪切活化
Furin前体分子在内质网中合成,其包含前肽和Furin 蛋白两部分,其中前肽由83 个氨基酸残基组成,在前肽中含有一段信号肽,可指引Furin 前体定位至内质网[8]。Furin前体经过前肽的两次自剪切后活化。第一次自剪切在中性的内质网中进行,Furin前体在氨基酸序列Arg-Ala-Lys-Arg107的羧基末端切割,此过程非常迅速[9]。切割后的前肽以非共价的形式与Furin相连,抑制其活性[10]。第二次自剪切在Ca2+浓度较高、pH为6.5的高尔基体中进行,切割位点是Arg-Gly-Val-Thr-Lys-Arg75的羧基末端[11]。经过两次切割后,Furin 蛋白与前肽彻底分离,活化成为有生物活性的Furin,从而参与到其他前体蛋白的成熟过程[12]。
1.3 Furin作用底物和酶的特性
Furin在众多生理过程发挥作用,因此其作用底物也具有多样性。它能通过水解作用来激活多种蛋白质的前体,主要包括激素、生长因子、基质金属蛋白酶、血清蛋白酶和细菌外毒素等[13]。Furin在切割蛋白质底物时优先识别的氨基酸序列为-Arg-XLys/Arg-Arg↓-(Arg:精氨酸;Lys:赖氨酸;X:任意氨基酸;↓:切割位点),其最短氨基酸识别序列为-Arg-X-X-Arg↓-[14]。在切割序列中P1 位必须为Arg,且P2、P4 和P6 位中最少有两个碱性氨基酸。若P2 位是碱性氨基酸(Lys 或Arg)时,则会提高Furin的切割效率[12]。
Furin 在切割底物时对pH 的范围有一定的要求,一般pH 在6.0~8.5 范围内能使酶保持催化活性。同时,作为一种钙依赖性的酶,在1 mmol/L Ca2+的浓度条件下Furin 的活性最大[15]。除此之外,Furin 还能与Mg2+结合,20 mmol/L Mg2+能使其活性增强[16]。
1.4 细胞定位
Furin 经过两次自剪切活化成有生物活性的分子,在表达稳定期,它主要位于高尔基体[15]。也有一部分存在于细胞膜上。Furin 可以从高尔基体经过组成型分泌途径被转运到细胞膜,从而释放到细胞外。部分位于细胞膜上的Furin被转运至高尔基体,其转运依赖于细胞膜的内吞作用[12],由此形成一个循环。
2 Furin 生物学功能
在前体蛋白转化酶家族中,Furin是最重要的成员之一,它在机体众多的生理过程中处于必不可少的位置,主要体现在机体内众多前体蛋白和生长因子的加工成熟过程,例如激素成熟及水平变化、神经和胚胎生长发育过程等[16]。
研究表明,Furin 是β-神经生长因子(β-Nerve growth factor,β-NGF)前体的主要内切蛋白酶,正是Furin 对其进行加工使得神经元具有活性,因此,Furin 在决定神经元形成突触复合体或凋亡过程发挥重要作用[17-18]。在胚胎发育中,人类Notch1(hNotch1)最初合成为350 ku 的前体糖蛋白,在转运到细胞表面的过程中,它在S1 位点被Furin 加工,产生由非共价结合的细胞外和跨膜组成的异二聚体亚基,继而引发蛋白解裂从而诱导信号传导,并参与促发育基因的转录激活,以此来加强细胞间的信息交流;而未被Furin剪切的片段则有相反的作用,该片段可以通过参与介导另一通路来抑制细胞的分化[19]。
Furin可以识别诸多调控因子的前体蛋白,例如转化生长因子β1(transforming growth factor-β1,TGF-β1)、骨形态发生蛋白6(bone morphogenetic protein 6,BMP6)和骨形态发生蛋白2(BMP2)。已知一种可以诱导前蛋白转化酶Furin 表达的细胞因子——TGF-β。在缺氧介导的屏障损伤过程中,辅酶a 通过介导TGF-β 的作用损害内皮完整性,研究显示,靶向Furin 或激活素受体样激酶5(Activin receptor-like kinase 5,ALK5)途径可能为疾病期间改善血脑屏障稳定性和中枢神经系统功能提供新的治疗策略[20]。TGF-β1 显著诱导胶质细胞源性神经营养因子(Glial cell linederived neurotrophic factor,GDNF)和Furin 的表达,进而增加成熟GDNF 的产生,研究也显示,Furin 是诱导GDNF 产生的主要前蛋白转化酶[21]。此外,当T 细胞被激活并裂解pro-TGF-β1以释放活性蛋白时,Furin会被上调,调节性T 细胞(Treg)中Furin 的缺失导致TGF-β1 活性降低并抑制Treg 功能[22]。同样,现有的研究已经证明,BMP6和TGF-β参与哺乳动物卵泡功能调节和卵母细胞成熟的过程。而在通过BMP6 来诱导产生TGF-β1 的过程中,Furin 扮演的角色起到极为关键的作用,并且进一步研究显示激活素受体样激酶2(ALK2)和激活素受体样激酶3(ALK3)都参与BMP6 诱导的Furin 上调[23]。内源性Furin 的敲除部分减弱了BMP2 诱导的血清脑源性生长因子(Brain-derived neurotrophic factor,BDNF)产生的增加,表明Furin参与了BDNF 的成熟过程。此外,通过药理学(激酶受体抑制剂)和siRNA 介导的抑制方法,证明BMP2诱导的BDNF和Furin表达上调最有可能由激活素受体样激酶(ALK)2/ALK3-SMAD4 信号通路介导[24]。
Furin 的过度表达通过参与多种蛋白质的成熟过程来影响细胞和病毒的生物学功能。目前最新研究表明,Furin 在人类胰岛中高度表达,而可能提供冗余的PC 以相当低的水平表达[25]。Jin等[26]在有关脂蛋白脂肪酶(lipoprotein lipase,LPL)的研究中发现,血管生成素样蛋白(angiopoietin-like protein,ANGPTL)3、4 和8 是特征明显的LPL 蛋白抑制剂,数据表明ANGPTL3/8 促进Furin 介导的LPL 切割。此外,研究显示,Furin 可以作为足月分娩子宫激活的刺激剂,介导分娩的起始[27]。Furin与其他真核生物前蛋白相比,在富含Mg2+离子的环境中,病毒包膜糖蛋白突变可以增加对细胞内Furin 的易感性,从而使病毒感染性提高[16]。
3 Furin 相关疾病
3.1 Furin与病毒传染性疾病
多种病毒利用组成型蛋白质分泌途径的Furin和其他前蛋白转化酶(PCs)来调节其细胞进入机制和传染性。全身细胞中普遍存在的Furin 和相关的PCs使得这些蛋白酶容易被病毒利用[28]。Furin介导多宿主与病原体蛋白水解切割,并在促进病毒包膜糖蛋白的成熟方面发挥重要作用。腮腺炎病毒(mumps virus,MuV)通过其包膜与靶细胞的质膜融合进入细胞,膜融合由病毒附着蛋白和Furin 介导,Furin 将MuV-F 裂解为两个亚基是膜融合和病毒感染的先决条件[29]。
目前最受关注的病毒传染性疾病是2019 年末爆发的由新型冠状病毒感染引起的肺炎(Corona virus disease 2019,COVID-19),其病原体被命名为“严重急性呼吸综合征冠状病毒2(Severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)”。SARS-CoV-2可能通过棘突蛋白(Spike protein,S蛋白)与人类细胞表面的血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)相互作用,从而感染人类呼吸上皮细胞[30]。S蛋白是新冠病毒进入细胞的关键因素,由S1和S2两个结构域构成,S1与宿主ACE2受体结合,S2与膜融合有关[31]。
SARS-CoV-2比SARS冠状病毒传染性更强,传播速度更快。其原因是SARS-CoV-2 中“PRRA”插入物和随后的精氨酸(R)构成一个RRAR 序列,这种基序的存在可能使S 蛋白在成熟前被Furin 样蛋白酶切割成S1和S2,从而使S1灵活改变构象,以更好地适应宿主受体[32]。SARS-CoV-2 的S 蛋白还同时具备胰蛋白酶(R815)和Furin(R685)酶切位点,分别对应SARS冠状病毒的胰蛋白酶切位点(R797和R667)[33],这些位点使SARS-CoV-2侵染细胞的效率更高。Furin切割位点的缺失会放大SARS-CoV-2在Vero细胞中的复制,但是会减弱其在呼吸细胞的复制和体内的致病性[34]。此外,对感染SARS-CoV-2的患者进行的研究结果表明,Furin与疾病发展的严重程度呈正相关,表明Furin可能导致SARS-CoV-2感染加重和炎症加剧,因此可以将其作为COVID-19 患者疾病严重程度的预测指标之一[35]。由此可见,Furin 的广泛表达与SARS-CoV-2 的致病性密切相关。
为了进一步证明SARS-CoV-2 感染细胞时Furin 在S 蛋白上的作用,Shang 等[36]使用靶向于Furin的siRNA和蛋白酶抑制剂分别处理S蛋白,结果发现当Furin的活性受到抑制以后,在进入细胞的过程中明显表现出SARS-CoV-2的效率降低。研究者通过在VeroE6细胞中表达SARS-CoV-2 S蛋白上假定的Furin底物来验证其切割,并发现显著的合胞体形成,接着用Furin 抑制剂癸酰基-RVKR-氯甲基酮(decanoyl-RVKR-chloromethylketone,CMK)和萘荧光素处理可消除分裂和合胞体,表明这两种Furin抑制剂可通过减少病毒的产生和细胞病变作用,从而增强细胞对SARS-CoV-2 的抵抗能力[37]。此外,合成的Furin 抑制剂MI-1851 在Calu-3 人气道细胞中对SARS-CoV-2 的复制具有明显的抑制作用,显示其具有一定的抗病毒活性[38]。总之,对于SARSCoV-2感染细胞的整个过程,Furin发挥了重要的生物学作用,而对Furin 进行抑制可能是抗SARSCoV-2感染潜在治疗选择之一。
3.2 Furin与骨相关疾病
Furin与骨内分泌功能息息相关,骨钙素(osteocalcin,OCN)由激素原(pro-osteocalcin,pro-OCN)合成,研究表明,Furin 原蛋白转化酶负责体外和体内的pro-OCN 成熟,Furin 介导的pro-OCN 裂解独立于其γ-羧化发生,这是一种已知会阻碍OCN 内分泌作用的翻译后修饰。成骨细胞中的Furin 缺失降低了食欲,这一功能不受OCN 调节,因此表明成骨细胞可能会分泌额外的激素来调节能量代谢的不同方面,这些发现表明Furin是骨内分泌功能的重要调节剂;此外,Furin 对OCN 激素原的加工调节了OCN 的激活和内分泌功能[39]。因此,成骨细胞中的Furin 通过OCN 依赖性和非依赖性机制在骨能量代谢的调节中起重要作用。
与成骨细胞相比,Furin可能在破骨细胞谱系细胞中发挥更大的作用,尤其是在成熟的破骨细胞中,其与破骨细胞的形成和骨吸收密切相关。Pang等[40]的体内实验表明,骨靶向Furin抑制肽(RD 6)可以通过抑制破骨细胞形成和骨吸收,对OVX 诱导的骨丢失发挥骨保护作用;此外,该团队还合成了一种超顺磁性氧化铁(superparamagnetic iron oxide,SPIO)纳米颗粒,该纳米颗粒由与骨靶向和对金属蛋白酶(matrix metalloproteinase 9,MMP)裂解有反应的Furin 抑制肽缀合而成,且专门针对骨组织,实验结果表明,该纳米颗粒明显抑制了乳腺癌进展并减轻了破骨细胞介导的骨破坏。因此,Furin在多功能SPIO 纳米粒子治疗骨转移性乳腺癌的过程中起到难以代替的作用。
骨关节炎(osteoarthritis,OA)的患者常伴有软骨损失的症状,这是由生长因子和MMP 的局部产生改变引起的。Furin是一种参与MMP蛋白质成熟的酶,可能调节软骨细胞功能。研究表明,Furin 的全身给药通过维持OA 中的ALK5 受体和Smad3信号传导来负调节MMP-13,从而减少小鼠的软骨降解[41]。这体现了Furin在OA 中的保护作用,表明其可能是介导OA 发展的潜在靶点,提示Furin在治疗软骨损失方面具有潜在用途。
类风湿性关节炎(rheumatoidarthritis,RA)属于自身免疫性关节疾病,它能导致患者出现关节严重损伤的症状。炎症部分是由于分泌炎性细胞因子的免疫细胞涌入和Treg 细胞数量减少。Furin对关节炎病变的预防是通过抑制MMP-9 和MMP-2 前体转化为其活性形式来促进调节细胞(Treg cells)并恢复关节中辅助性T 淋巴细胞1(T helper 1,Th1)/辅助性T 淋巴细胞2(T helper 2,Th2)平衡来介导的;Furin 阻止了骨质流失,促进了一些可能损害软骨稳态平衡的催化酶的成熟,并且还与脾脏中Treg 细胞比例的增加有关,表现在局部血管翳增殖系统的调节中[42]。因此,Furin 在减少RA 自身免疫方面发挥重要作用,从而为自身免疫性疾病(如RA)提供了一种新的治疗剂。
3.3 Furin与肿瘤相关疾病
在肿瘤发展过程中,许多与其相关的蛋白质需要经过Furin等前体蛋白切割成熟,才能发挥生物学活性。研究表明,Furin在卵巢癌高级别浆液性癌患者中高表达,Furin 可以激活卵巢癌细胞中的IGF1R/STAT3 信号轴,从而促进卵巢癌细胞转移,同时降低Furin的表达,对肿瘤的生长、侵袭、转移能力都具有明显的抑制作用[43]。在三阴性乳腺癌(triple negative breast cancer,TNBC)细胞中,Furin裂解并激活参与肿瘤发生的几种蛋白质前体,在乳清酸性蛋白(whey acidic protein,WAP)诱导的乳腺上皮细胞特异性Furin基因敲除小鼠模型中,小鼠乳腺发育正常;然而,在癌基因诱导的TNBC 小鼠模型中,乳腺中Furin 的缺失抑制了原发性肿瘤生长和肺转移[44],揭示了Furin 作为TNBC 肿瘤治疗靶点的潜力。同时,有研究发现,在胰腺癌组织中甲基化CpG 序列结合蛋白2(methyl-CpG-binding protein 2,MeCP2)的表达上调,并且和胰腺癌细胞的迁移、侵袭和增殖密切相关。进一步的研究还发现,MeCP2 可以作为一种共激活剂增强Smad3 与Furin启动子的结合,从而提高其转录效率,MeCP2/Smads 可强化Furin 表达并激活TGF-β1,进而使Smad2/3 磷酸化,最终形成正反馈轴促进胰腺癌细胞上皮—间质转化[45]。Furin 还能通过内蛋白分解激活参与ERK-MAPK 通路的几种致癌蛋白前体,有研究表明,Furin 可以激活KRAS 相关的ERKMAPK通路中的一些肿瘤相关蛋白前体,从而促进结直肠癌的发生[46]。Farhat等[47]的研究报道显示,在乳腺细胞中硫辛酸(Lipoic acid,LA)通过下调Furin抑制胰岛素生长因子受体(insulin like growth factor-1 receptor,IGF-1R)的成熟,在体外和体外抑制各种ERα+和ERα-乳腺癌细胞株的增殖,从而发挥抗乳腺癌功能。
在癌症的治疗中,药物积累不足和耐药性仍然是两大挑战。目前已有实验证明Furin 与肿瘤细胞内药物的聚集密切相关,Xie等[48]设计了一种负载阿霉素(DOX)和羟基氯喹(HCQ)(AuNPs-D&HR&C)的Furin 反应性聚集纳米平台,AuNPs-D&HR&C 在全身给药后可通过增强通透性和滞留(EPR)效应被动靶向肿瘤,导致肿瘤内药物积聚增强;并且还通过提高肿瘤靶向能力、抑制保护性自噬、重编程m2 样TAMs 抗肿瘤M1 表型来克服耐药。此外,Chen 等[49]开发了一种基于Furin 的三萜类脂质体复合物(PEGcleavable Tf-CTM/L),该复合物以转铁蛋白修饰的载雷公藤碱的薏苡仁油微乳液(transferrin-modified tripterine-loaded coix seed oil microemulsion,Tf-CTM)为核心,包覆热敏脂质和一种用Furin 可裂解肽修饰的聚乙二醇(Polyethylene glycol,PEG)壳;与单独使用三萜烯相比,聚乙二醇可切割的Tf-CTM/L通过抗肿瘤药物在肿瘤组织内的高效积累和深度渗透,提高了抗宫颈癌的疗效,降低了全身毒性,在宫颈癌常规治疗方案基础上提供了一种新策略。总之,Furin与肿瘤的发展有一定的相关性,在一定程度上,通过下调Furin 的表达能抑制肿瘤的发展。
3.4 Furin与神经系统相关疾病
Furin的作用底物在脑内广泛分布,这些底物的激活与神经系统疾病有关,因此Furin 在痫病、阿尔茨海默病等神经系统疾病中,发挥了重要的调节作用。Furin 介导的低密度脂蛋白受体相关蛋白1(low-density lipoprotein receptor related protein 1,LRP1)切割和LRP1 的胞内结构域(intracellular domain,ICD)定位的改变与兴奋毒性神经元损伤有关,实验证明,成熟的LRP1在大鼠脑缺血后和原代培养的皮质神经元暴露于N-甲基-D-门冬氨酸(Nmethyl-D-aspartate,NMDA)后被Furin 切割,LRP1的切割和LRP1-ICD 与反式高尔基体网络(trans-Golgi network,TGN)和(或)Furin 的共定位被Furin抑制剂减弱,这可能与保护皮质神经元免受缺血性损伤有关[50]。随着年龄的增长,大脑铁代谢异常越来越可能参与阿尔茨海默病(Alzheimer’s Disease,AD)的病理过程。Furin 是一种广泛表达的前转化酶,其铁调节作用可能在AD 中发挥重要作用。Choi等[51]在实验中观察到,过量铁诱导的Furin活性破坏了淀粉样蛋白前体(amyloid protein precursor,APP)加工,从而导致了老年APP-c105 小鼠认知能力下降和淀粉样蛋白-β诱导的神经元细胞死亡,进一步的实验结果表明,通过低铁诱导的Furin活性增强,促进α分泌酶依赖的APP加工,从而减少认知能力下降和淀粉样蛋白-β诱导的神经元细胞死亡,同时,降低老年AD小鼠脂质过氧化产物水平,提高抗氧化防御酶活性。Furin 通过对脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)前体[52]、γ-氨基丁酸(γ-aminobutyric acid,GABA)受体前体[53]等营养因子和受体前体的剪切,以及对Notch1受体前体裂解[54-55]的调控来影响癫痫病的发作。另有研究发现,Furin蛋白在癫痫小鼠的海马和皮质以及癫痫患者的颞叶新皮质中增加,与野生型(Wild type,WT)小鼠相比,Furin 转基因小鼠增加了癫痫易感性,癫痫活动增强。相反,慢病毒介导的Furin基因敲除抑制了癫痫活动;此外,Furin基因调节突触后γ-氨基丁酸A 受体(γ-aminobutyric acid A receptor,GABAAR)介导的突触传递影响神经元抑制,Furin 可能通过改变癫痫中GABAARβ2/3 亚单位的转录来调节GABAAR 介导的抑制性突触传递,而影响癫痫小鼠GABAARβ2/3膜和总蛋白的表达[56]。此外,发育性尼古丁暴露(developmental nicotine exposure,DNE)引发了 Furin 介导的proBDNF 蛋白水解的多代破坏。从临床角度来看,所有相关的这些发现将弗林蛋白酶缺陷确定为proBDNF 蛋白水解正常化和相关神经发育损伤的潜在治疗靶点。鉴于Furin 的表达受microRNA-24(miR24)的负调控,未来的研究可以评估抗miR24寡核苷酸疗法作为增强Furin 表达的工具的潜在价值,从而使DNE 后代和孙后代的proBDNF 蛋白水解正常化[57]。
3.5 Furin与其他相关疾病
Furin 在许多其他疾病中也起着至关重要的作用。研究表明,急性心肌梗死(acute myocardial infarction,AMI)患者的Furin 水平升高引发心血管不良事件、全因死亡率、复发性心肌梗死(myocardial infarction,MI)和因心力衰竭(heart failure,HF)住院的风险增加,且Furin独立于常规危险因素和既定标志物[58]。有实验数据显示,循环Furin、全身脂肪量、躯干脂肪量、体脂百分比、甘油三酯、脂肪因子和促炎标志物之间存在正相关,Furin、肥胖和儿童促炎环境之间存在关联[59]。此外,有研究证明较高水平的血清Furin 可预测中国成人发生微量白蛋白尿的风险增加[60]。
4 展望
Furin在机体众多生理过程中都不可或缺,且与很多疾病有显著关联。目前有关Furin 对疾病治疗的作用及潜在机制的研究已有较大收获,但对其具体分子机制及通路仍有部分不明确,未来的研究将更全面阐述Furin 的生物学功能。此外,Furin 抑制剂对相关疾病治疗可能是今后研究的主流之一。总而言之,Furin在临床应用及理论研究都有广阔的发展前景。
