重组梅毒螺旋体蛋白Tp47通过诱导uPA增加血管内皮细胞通透性
2022-01-21于宝丹柯吴坚
于宝丹,陈 聪,柯吴坚,吕 萍*
(1.广州医科大学附属第一医院 检验科, 广东 广州 510120; 2.南方医科大学皮肤病医院 皮肤科, 广东 广州 510095)
梅毒是一种由梅毒螺旋体(Treponemapallidum,T.pallidum,Tp)感染引起的慢性传染性疾病,可合并全身多系统的损害。许多研究证实,Tp通过黏附于宿主上皮细胞,穿透组织屏障,侵入内皮细胞之间的紧密连接,从而进入循环系统,导致全身广泛播散[1]。因此,梅毒螺旋体穿透组织屏障是导致多组织器官感染的一个重要环节。既往已经发现神经梅毒患者脑脊液中的尿激酶型纤溶酶原激活物(urokinse-plasminogen activator, uPA)显著高于未累及神经系统的梅毒患者[2],这一结果提示uPA可能在Tp穿透血脑屏障播散至中枢神经系统过程中发挥作用。梅毒螺旋体的外膜蛋白是 Tp 的主要免疫反应组分,能诱导机体产生较强的免疫应答[3],其中梅毒螺旋体47 ku膜蛋白(Tp47) 含量高、免疫原性强,在梅毒的致病机制研究和临床诊断中具有重要意义[4]。本研究构建了人脐静脉血管内皮细胞(human umbilical vein/vascular endothelial cells,HUVECs)单层模型,通过观察重组Tp特异性膜蛋白Tp47(recombinant Tp protein Tp47,rTpp47)对THP-1巨噬细胞合成uPA的调控及其对血管内皮细胞通透性的影响,进一步探讨rTpp47在梅毒发病机制中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞:人脐静脉血管内皮细胞(HUVECs)和人单核-巨噬细胞系THP-1为本实验室保存。
1.1.2 主要试剂:重组蛋白 Tpp47(rTpp47)由广州洛孚生物科技有限责任公司合成,已去除内毒素,纯度>90%;RPMI-1640培养基、胎牛血清、FITC 标记的葡聚糖(Gibco公司);佛波酯(PMA)(索莱宝公司);阿米洛利(amiloride)(Merck公司);Transwell小室(Coning公司)。
1.2 方法
1.2.1 细胞培养:HUVECs、THP-1 细胞均培养于含10%胎牛血清的 DMEM 培养基(含 0.05%的青链霉素双抗),置于37 ℃、5% CO2孵箱中培养。
1.2.2 THP-1巨噬细胞的诱导:取生长良好的对数期THP-1细胞, 1 000 r/min离心5 min,弃上清,新鲜培养基重悬细胞,显微镜下计数调整细胞浓度为1×106个/mL铺于6孔板内,同时加入终浓度为100 ng/mL的佛波酯(PMA)继续培养48 h,诱导为贴壁的THP-1巨噬细胞。
1.2.3 不同浓度rTpp47与THP-1细胞共培养:取PMA刺激48 h后的THP-1细胞接种于6孔板,细胞数为3×105个/孔,然后加入不同浓度的rTpp47(分别为0.1、0.5和1 μg/mL),培养24 h后集培养上清,1 000 r/min离心5 min后取上清液,用离心沉淀的细胞提取细胞蛋白,分别用ELISA和Western blot检测uPA表达。另取一组THP-1细胞接种于6孔板,同时加入rTpp47(0.5 μg/mL)和uPA合成抑制剂阿米洛利(分别为0、50、100、200 μmol/L),培养24 h后收集细胞培养上清检测uPA含量。
1.2.4 Transwell 细胞共培养实验:取对数期生长的HUVECs铺于Transwell小室6孔板的下室,细胞浓度为3×105个/mL/孔,24 h后更换培养基,并在Transwell上室加入PMA诱导后的THP-1细胞,每孔加入THP-1细胞3×105个,每孔培养基总体积为2.5 mL。共培养的细胞分成3组,分别为uPA合成抑制剂阿米洛利组(50 μmol/L)、rTpp47(0.5 μg/mL)组以及rTpp47(0.5 μg/mL)+阿米洛利(50 μmol/L)组。共培养24 h后,收集下室的HUVECs,提取细胞蛋白。
1.2.5 用 FITC 标记的葡聚糖漏出法测定 HUVECs相对通透性:将HUVECs按照2×105个/孔接种于已铺鼠尾胶原的Transwell (24孔板,孔径为3 μm)上室,200 μL细胞悬液,Transwell下室添加700 μL完全培养基。每天在倒置显微镜下观察细胞生长情况并且全量换液,细胞生长至2 d后已达到完全汇合,弃去培养基,在每个Transwell上下室分别加入rTpp47(0.5 μg/mL)刺激24 h后的THP-1细胞条件培养基,以不加rTpp47(0.5 μg/mL)刺激的THP-1细胞条件培养基作为对照组,分别作用6、12及24 h后,无菌PBS冲洗3次,在Transwell上室加入终浓度为1 mg/mL的 FITC-葡聚糖200 μL,下室更换为无菌PBS 700 μL,从下室取样品100 μL,即为t=0 的样品,培养箱内继续孵育30 min,在每个下室取样品100 μL,即t=30min的样品。避光保存,待样品收集完全后置于96孔板中,用多功能酶标仪测定荧光强度,激发波长为490 nm,发射波长为520 nm,检测渗透到下室的FITC-葡聚糖的荧光强度,通过计算t=30 min的荧光强度与t=0时的荧光强度之比判断内皮细胞的通透性。
1.2.6 ELISA检测细胞上清中的uPA含量:实验前0.5 h,将试剂盒恢复至室温,每孔加入100 μL稀释液,然后分别加入50 μL的标准品、空白对照和待检样品,室温下摇床(500 r/min)孵育2 h。然后移弃液体,洗板4次,在吸水纸上拍干,每孔加入200 μL的uPA 偶联物,用封板膜封板后放置摇床室温孵育2 h,洗板后加入200 μL底物,室温、避光孵育30 min,每孔加入50 μL终止液,5 min内于酶标仪450 nm处,以空白对照孔调零后检测各个孔吸光度(A)值。根据标准品浓度及校准后的A值制作出标准曲线方程,再根据所测样品的校准后A值,用标准曲线方程计算出样品的蛋白浓度。
1.2.7 Western blot实验:收集培养的细胞,加入细胞裂解液,冰上裂解30 min。裂解上清行SDS-PAGE。将蛋白转移到PVDF膜上后,5%脱脂奶粉室温封闭2 h,加入一抗(1∶1 000)兔抗鼠uPA、p-PKC、PKC、GAPDH、claudin-5抗体,4 ℃缓慢振荡过夜。洗膜3次,加入辣根酶标记山羊抗兔IgG二抗(1∶5 000),37 ℃缓慢振荡1 h。ECL化学发光法试剂作用于PVDF膜5 min,曝光胶片。用 Image-J软件进行灰度值分析,以目的蛋白与GAPDH的比值表示目的蛋白的相对表达量。
1.3 统计学分析
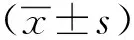
2 结果
2.1 rTpp47对THP-1巨噬细胞表达和分泌uPA的影响
随着rTpp47浓度的升高,THP-1细胞内表达的uPA也逐渐增多(图1A,B),细胞培养上清中的uPA含量也逐渐升高(图1C)。0.5 μg/mL的rTpp47刺激THP-1细胞分泌的uPA显著高于对照组(P<0.05)。1 μg/mL的rTpp47组uPA的含量高于0.5 μg/mL的rTpp47组,但两者差异无统计学意义,因此,后续实验采用0.5 μg/mL的rTpp47。
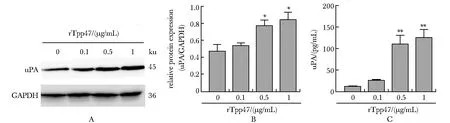
2.2 rTpp47与THP-1巨噬细胞共培养的上清液对单层血管内皮细胞(HUVECs)通透性的影响
6 h的实验组与对照组血管内皮细胞相对通透性差异无统计学意义,12和24 h对照组与实验组的血管内皮细胞相对通透性差异明显(P<0.05 和P<0.000 1)(图2)。
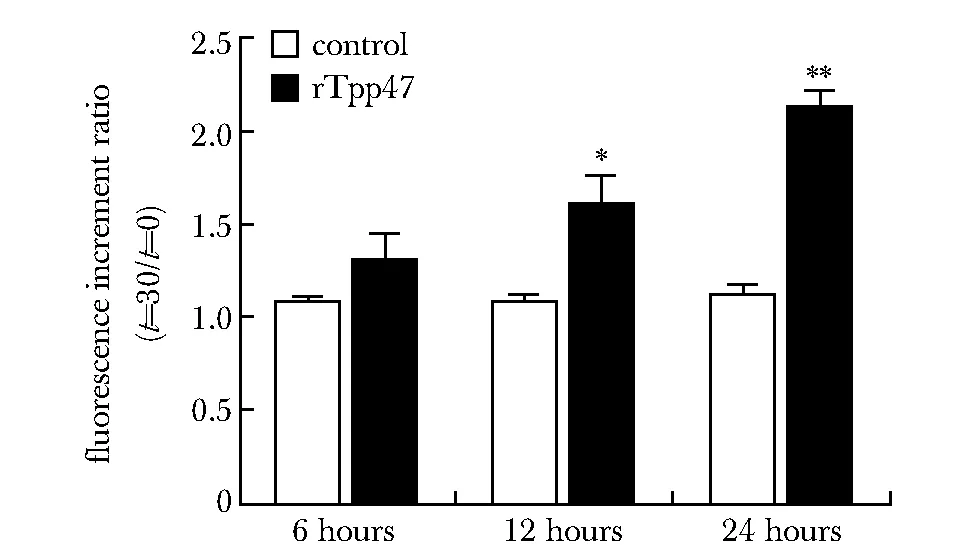
2.3 阿米洛利对THP-1细胞分泌uPA的抑制作用
50 μmol/L的阿米洛利显著抑制了rTpp47刺激THP-1细胞分泌uPA的功能(P<0.000 1),并且阿米洛利的抑制作用呈浓度依赖性(图3)。考虑到高浓度阿米洛利的细胞毒作用,后续实验采用低浓度的50 μmol/L的阿米洛利。
2.4 THP-1分泌的uPA对HUVECs紧密连接蛋白claudin-5表达的影响
0.5 μg/mL的rTpp47显著抑制了HUVECs的claudin-5蛋白表达,而50 μmol/L的阿米洛利也改善了rTpp47对HUVECs的claudin-5蛋白表达的抑制作用(P<0.05)(图4)。
A.representative pictures of Western blot; B.uPA expressed in THP-1 cells gradually increased when the concentration of rTpp47 increased,*P<0.05 compared with 0 μg/mL; C.uPA secreted by THP-1 cells gradually increased when the concentration of rTpp47 increased by ELISA; *P<0.05/0.001 compared with 0 μg/mL
*P<0.05, **P<0.000 1 compared with control group图2 rTpp47与THP-1巨噬细胞共培养的上清液促进单层血管内皮细胞(HUVECs)通透性升高Fig 2 Supernatant of the co-culture of rTpp47 and THP-1 macrophages promoted the increase of the permeability of monolayer vascular end-
*P<0.05 compared with 100 μmol/L amiloride group; #P<0.000 1 compared with 0 μmol/L amiloride group图3 uPA活性抑制剂抑制THP-1细胞分泌uPAFig 3 uPA activity inhibitor suppressed the secretion of uPA by THP-1 n=3)
2.5 PKC信号通路参与rTpp47诱导的THP-1细胞表达uPA
rTpp47诱导的THP-1细胞表达uPA的同时,THP-1细胞内磷酸化PKC显著增多(P<0.05),uPA活性抑制剂阿米洛利显著抑制了rTpp47诱导的THP-1细胞表达uPA和PKC的磷酸化(P<0.05)(图5)。
3 讨论
梅毒的发病机制尚不清楚,其与细胞免疫学密切相关。Tp膜蛋白可激活炎性反应细胞,释放炎性介质、细胞因子,造成组织损伤或诱导宿主细胞凋亡。血管内皮屏障是由内皮细胞单层和基膜组成的通透屏障,控制血管内外物质交换。炎性介质、病原微生物及其代谢成分均可损伤内皮屏障功能,引起组织、器官水肿和功能障碍[5-6]。有研究显示Tp侵入人体后出现局部的单核巨噬细胞浸润[7]。
本研究利用rTpp47刺激THP-1巨噬细胞,观察巨噬细胞表达和分泌uPA的影响,以及uPA对血管内皮细胞通透性的影响。本研究结果显示 rTpp47显著刺激THP-1细胞合成和分泌uPA,并且呈剂量依赖关系;rTpp47与THP-1巨噬细胞共培养的上清液促进单层血管内皮细胞通透性显著升高,并且THP-1细胞与HUVECs共培养情况下,HUVECs紧密连接蛋白claudin-5表达显著下调,而uPA活性抑制剂阿米洛利改善了rTpp47对HUVECs的claudin-5蛋白表达的抑制。据此推测rTpp47可能刺激THP-1细胞分泌uPA,而uPA 损伤了血管内皮细胞屏障中的紧密连接蛋白claudin-5,导致单层血管内皮细胞通透性升高。单层血管内皮的屏障功能是通过细胞间以及细胞与胞外基质的连接物质共同调节的[8]。内皮间的紧密连接和连接蛋白的特性决定细胞连接的通透性,其中紧密连接组织结构完整性起到重要作用[9]。Claudin-5 是紧密连接蛋白 claudins 家族的蛋白质成员,参与内皮紧密连接的必需膜蛋白, 是内皮细胞功能障碍的指标[10-11],其表达过少或者重新分布,与内皮细胞的高通透性有关。
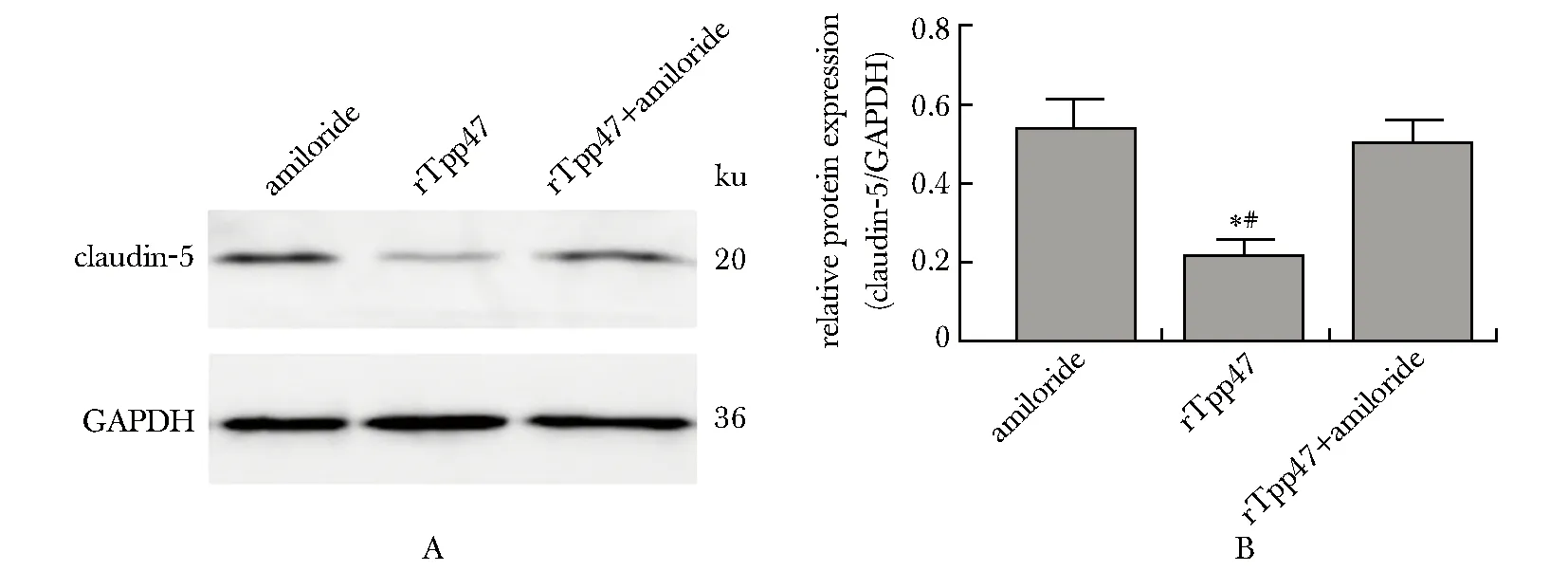
A.representative pictures of Western blot; B.relative expression of claudn-5 in HUVECs; *P<0.05 compared with amiloride; #P<0.05 compared with rTpp47+amiloride
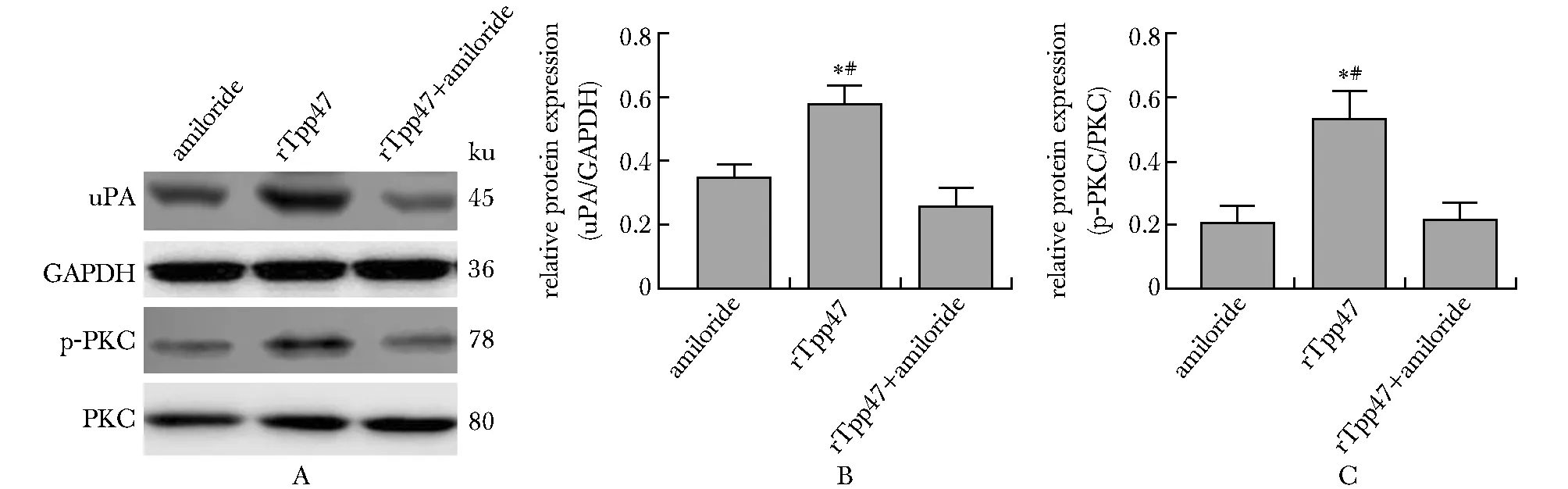
A.representative pictures of Western blot; B.relative expression of uPA in THP-1 cells; C.relative expression of p-PKC in THP-1 cells; *P<0.05 compared with amiloride; #P<0.05 compared with rTpp47+amiloride
有研究发现,PKC信号通路在脓毒血症诱导的uPA激活中发挥了重要作用[12],PKC信号通路激活介导了人结肠癌细胞表达uPA[13]。本结果显示,rTpp47诱导的THP-1细胞表达uPA的同时,THP-1细胞内磷酸化PKC显著增多,uPA活性抑制剂阿米洛利抑制了rTpp47诱导的THP-1细胞表达uPA和PKC的磷酸化,证实PKC信号通路参与THP-1细胞合成uPA相关。
本研究显示,梅毒螺旋体膜蛋白 Tp47 通过PKC信号途径,在体外激活THP-1巨噬细胞,促进其合成和分泌uPA,增强损伤血管内皮细胞通透性,这在梅毒发病的免疫学发病机制中可能起重要作用。 进一步研究膜蛋白 Tp47 在炎性细胞激活和内皮细胞损伤中的作用,将对深入研究梅毒的免疫学发病机制具有重要的意义。
