呋塞米对脑出血模型大鼠PERK/eIF2α/CHOP通路及继发性脑损伤的影响
2022-01-21高建洲
张 瑜,高建洲,韩 韶
(邯郸市第一医院 东院区 神经外科,河北 邯郸 056000)
脑出血(intracerebral hemorrhage,ICH)是因脑血管破裂而引起的一种脑血管疾病,造成的脑实质内出血可对神经系统功能造成严重损害,ICH发病急、进展快,致残率、病亡率极高,且预后不佳,给患者身心健康造成极大威胁[1]。内质网应激在ICH后继发脑损伤的病理过程中起到重要作用,可造成脑水肿和神经元凋亡,引发神经功能障碍,另外,内质网应激导致的神经炎性反应会进一步加重脑损伤,因而抑制内质网应激可提高神经元存活率,减轻脑损伤[2]。RNA 依赖的蛋白激酶样内质网激酶(protein kinase RNA-like ER kinase,PERK)/真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)/转录因子CCAAT增强子结合蛋白的同源蛋白(CCAAT enhan-cer binding protein-homologous protein,CHOP)通路是调控内质网应激的主要信号通路,在缺血/再灌注损伤、炎性反应和神经系统疾病等病理机制中起着关键的调控作用,下调该通路蛋白表达可减弱内质网应激,抑制炎性反应,降低神经细胞凋亡率,减轻脑组织损伤[3-4],因而抑制PERK/eIF2α/CHOP信号通路激活可作为ICH的潜在治疗手段。呋塞米(furosemide,FUR)是临床常用的一种高效利尿药,可抑制肾小管对钠钾离子重吸收,促进水分排泄,起到强效利尿作用,还可阻止钠离子进入脑组织,减少脑脊液生成,降低颅内压,减轻脑水肿,对ICH疗效显著,广泛用于临床[5],但其对ICH大鼠PERK/eIF2α/CHOP通路及继发性脑损伤的影响,目前还未有明确阐述,本文通过构建ICH大鼠模型,对此进行初步探讨。
1 材料与方法
1.1 材料
1.1.1 动物: SD大鼠,雄性,SPF级,体质量200~240 g,济南朋悦实验动物繁育有限公司,动物合格证号SCXK(鲁) 2019 0003,参照《中华人民共和国实验动物管理条例》饲养在本院动物房,温度为22 ℃~25 ℃,湿度为45%~55%,噪音≤50 dB,大鼠自由进食及饮水,光照昼夜循环(12 h/12 h),适应性喂养1周,用于后续实验。
1.1.2 主要试剂: Ⅳ型胶原酶(上海一研生物科技有限公司);呋塞米(furosemide,FUR)注射液(遂成药业股份有限公司);单唾液酸四己糖神经节苷脂钠注射液(齐鲁制药有限公司);Evans蓝(上海钰博生物科技有限公司);HE染色试剂盒(上海生工生物工程股份有限公司);大鼠γ干扰素(interferon-γ,IFN-γ)及白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒、兔源PERK、CHOP及p-eIF2α一抗、羊抗兔二抗(Abcam公司);兔源p-PERK及β-tubulin一抗、鼠源eIF2α一抗(Santa Cruz公司);羊抗鼠二抗(Cell Signaling Technology公司);RIPA裂解液(上海吉至生化科技有限公司);BCA试剂盒(上海碧云天生物技术有限公司)等。
1.2 方法
1.2.1 大鼠的分组及处理: 参照文献[6],将大鼠分为假手术组、模型组(脑定位注射Ⅳ型胶原酶,建立ICH模型)、FUR-L、FUR-M、FUR-H组及神经节苷脂干预组,每组18只。分别配制为1、2、4 mg/mL的FUR[8]溶液和5 mg/mL单唾液酸四己糖神经节苷脂钠[9]溶液,药物处理组大鼠均经尾静脉注射给药,剂量为1 mL/kg,假手术组与模型组大鼠均尾静脉注射1 mL/kg的0.9%氯化钠溶液,每天1次,持续14 d。
1.2.2 大鼠神经功能缺损的检测: 第14天给药后24 h,根据各组大鼠行为活动情况检测其神经功能,并参照Longa评分[7]法进行评分,从行为活动正常到死亡共分为5级,得分从0到5分。
1.2.3 大鼠血脑屏障损伤的检测:神经功能缺损检测结束后,进行Evans蓝外渗实验检测大鼠血脑屏障损伤:各组大鼠均随机选取6只,以5 mL/kg的剂量股静脉注射2% Evans蓝染料,1 h后以乙醚麻醉,切下鼠头,解剖分离大脑,称量湿质量,以60 ℃甲酰胺对其浸泡,24 h后运用分光光度计测量浸出液中Evans蓝含量。
1.2.4 标本收集及大鼠海马神经元损伤情况的检测:各组大鼠再次随机选取6只,自尾静脉取血3 mL后麻醉处死,取出大脑,称量湿质量,将其置于烤箱中烤干,称量干质量,计算大脑含水量,公式:大脑含水量=(大脑湿质量-大脑干质量)/大脑湿质量×100%。将上述血液放入4 ℃,3 000 r/min离心15 min,吸取上清储存在-80 ℃备用。各组最后剩余的6只大鼠,经麻醉后处死,解剖获得大脑,取下相同部位脑组织约0.5 g储存在液氮中备用;剩余脑组织经0.9%氯化钠溶液漂洗后,置于特制小盒中,以OCT(optimal cutting temperature compound)包埋剂浸没组织,放入液氮中速冻成块,采用冰冻切片机做常规病理切片,置于室温30 min后,以4 ℃丙酮固定10 min,参照试剂盒说明书的操作步骤进行HE染色,经75%、90%、100%乙醇依次脱水、二甲苯透明后,转移至载玻片上封片,以显微镜采集任意5个视野图像。
1.2.5 ELISA检测大鼠血清IFN-γ、IL-6水平:参照ELISA试剂盒说明书的操作步骤,检测血清其中各炎性因子IFN-γ、IL-6水平。
1.2.6 免疫印迹法检测大鼠脑组织PERK/eIF2α/CHOP通路相关蛋白表达:取出1.2.4中各组大鼠脑组织,加入1.5 mL RIPA裂解液,匀浆后4 ℃,3 000 r/min离心20 min,以BCA法测量上清中总蛋白浓度,然后将各样本浓度根据结果调至相同,加入上样缓冲液,煮沸6 min变性,各取20 L样品液上样,电泳后湿转,均于恒压110 V下进行,将所得硝酸纤维素膜根据分子质量剪下目的蛋白条带,以5%脱脂奶粉溶液于室温下孵育2 h,封闭膜上蛋白非特异性位点,然后分别加入兔源PERK、CHOP、p-eIF2α、p-PERK、β-tubulin一抗和鼠源eIF2α一抗,4 ℃孵育过夜,TBST缓冲液漂洗,加入对应的羊抗兔及羊抗鼠二抗,室温孵育2 h,TBST缓冲液漂洗,通过化学发光法对蛋白条带显影,然后放入凝胶成像仪中拍照,运用Image-J软件得到蛋白条带灰度值,并对各蛋白表达进行定量分析。
1.3 统计学分析
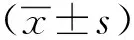
2 结果
2.1 呋塞米(FUR)对大鼠神经功能损伤的影响
模型组大鼠Longa评分相比假手术组明显升高(P<0.05)。FUR-L、FUR-M、FUR-H组及神经节苷脂组大鼠Longa评分相比模型组均降低(P<0.05)(图1)。
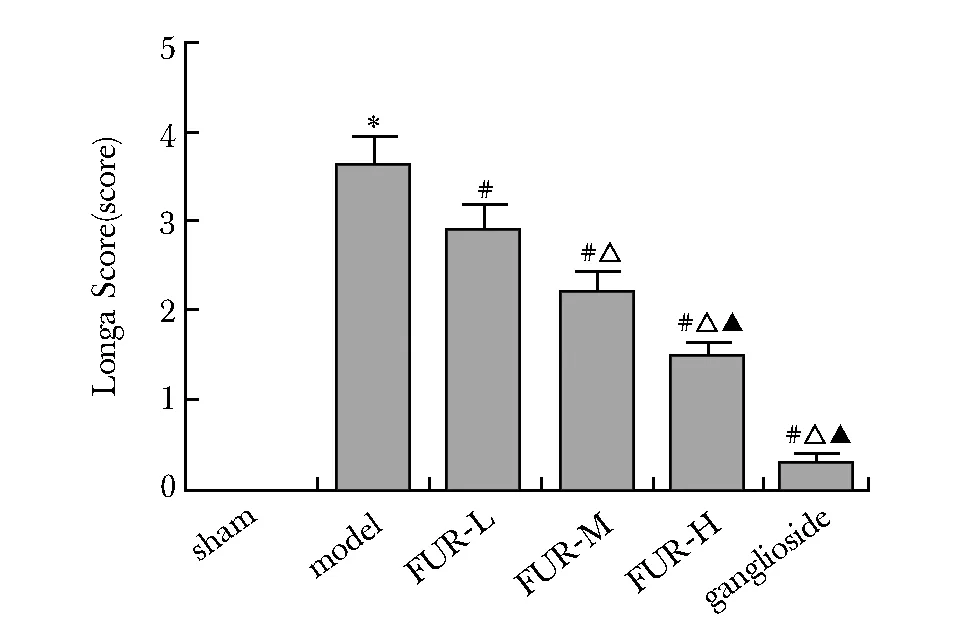
*P<0.05 compared with sham operation group; #P<0.05 compared with model group; △P<0.05 compared with FUR-L group; ▲P<0.05 compared with FUR-M group图1 大鼠Longa评分Fig 1 Neurological function Longa Score of rats
2.2 呋塞米(FUR)对大鼠脑水肿的影响
模型组大鼠大脑含水量相比假手术组明显升高(P<0.05)。FUR-L、FUR-M、FUR-H组及神经节苷脂组大鼠大脑含水量相比模型组均降低(P<0.05)(图2)。
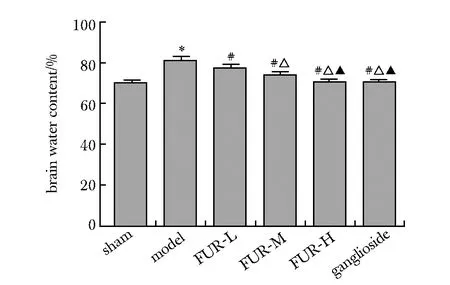
*P<0.05 compared with sham operation group; #P<0.05 compared with model group; △P<0.05 compared with FUR-L group; ▲P<0.05 compared with FUR-M group图2 大鼠大脑含水量Fig 2 Water content of rat brain
2.3 呋塞米(FUR)对大鼠血脑屏障损伤的影响
模型组大鼠Evans蓝渗出量相比假手术组明显升高(P<0.05)。FUR-L、FUR-M、FUR-H组及神经节苷脂组大鼠Evans蓝渗出量相比模型组均呈剂量依赖性降低(P<0.05)(图3)。
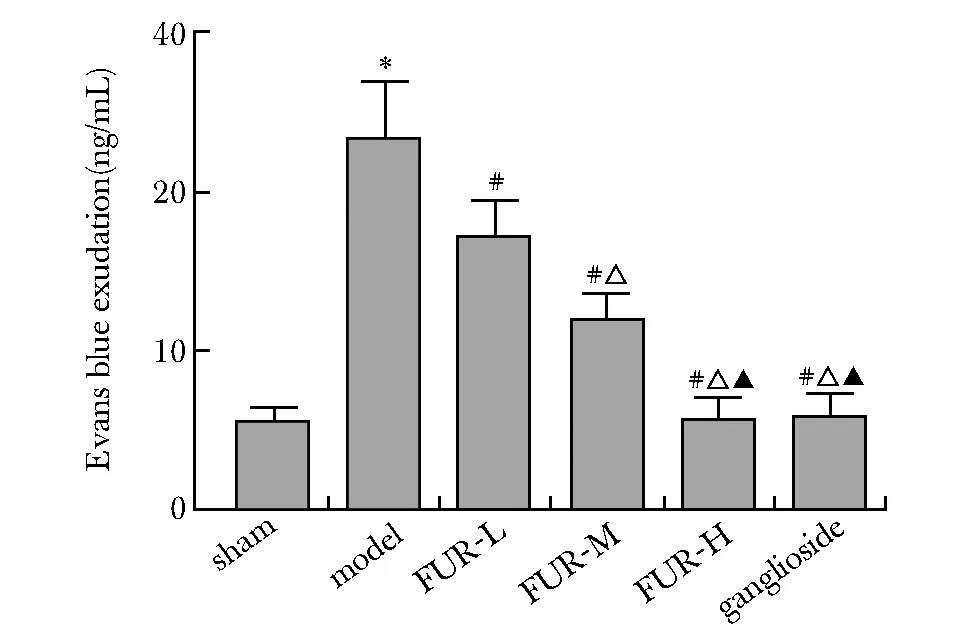
*P<0.05 compared with sham operation group; #P<0.05 compared with model group; △P<0.05 compared with FUR-L group; ▲P<0.05 compared with FUR-M group图3 大鼠Evans蓝渗出量Fig 3 Evans blue exudation in rats
2.4 呋塞米(FUR)对大鼠海马神经元损伤的影响
假手术组大鼠海马神经元无损伤;模型组大鼠海马神经元变性坏死,皱缩变小,数目明显减少,呈现严重病理损伤;相比模型组,FUR-L、FUR-M、FUR-H组及神经节苷脂组大鼠脑海马神经元病理损伤均减轻,且FUR各组随剂量升高,海马神经元病理损伤减轻程度增强,相比经节苷脂组,FUR-H组大鼠海马神经元病理损伤减轻程度差异无统计学意义(图4)。
2.5 呋塞米(FUR)对大鼠血清IL-6及IFN-γ水平的影响
模型组大鼠血清IL-6及IFN-γ水平相比假手术组明显升高(P<0.05)。FUR-L、FUR-M、FUR-H组及神经节苷脂组大鼠血清IL-6及IFN-γ水平相比模型组均降低(P<0.05)(图5)。
2.6 呋塞米(FUR)对大鼠脑组织PERK/eIF2α/CHOP通路相关蛋白表达的影响
模型组大鼠脑组织PERK/eIF2α/CHOP通路相关蛋白p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平相比假手术组明显升高(P<0.05)。FUR-L、FUR-M、FUR-H组及神经节苷脂组大鼠脑组织PERK/eIF2α/CHOP通路相关蛋白p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平相比模型组均降低(P<0.05)(图6)。
3 讨论
ICH易发于中老年群体,发病迅速,病情危重,易引发偏瘫、神经功能缺损等后遗症,如今仍是一个尚未解决的医学难题[10]。内质网是一种膜性细胞器,脑实质出血后,形成的血肿可刺激神经细胞产生内质网应激反应,引发严重的神经炎性反应,造成神经功能缺损及脑水肿,最终引发继发性脑损伤[11]。本文采用脑定位注射Ⅳ型胶原酶的方法建立ICH大鼠模型,结果表明Ⅳ型胶原酶可造成脑实质出血,诱发神经炎性反应,引起脑水肿,神经元凋亡,血脑屏障受损,最终导致神经功能障碍。
研究显示,减轻脑水肿,对减轻ICH脑损伤具有重要意义,因而利尿脱水是ICH的有效治疗方法,FUR作为一种强效利尿剂,可对肾小管髓袢升支粗段发挥作用, 在ICH的临床治疗中得到了广泛应用[12],但其药理机制目前还未有详细的阐释。PERK/eIF2α/CHOP通路是主要的内质网应激通路,当内质网受到氧化应激、缺血/再灌注、钙离子代谢紊乱及糖基化反应异常等病理因素刺激时,会发生应激反应, 此时PERK/eIF2α/CHOP信号通路激活,引发细胞凋亡和组织损伤,下调PERK及eIF2α磷酸化水平,可抑制CHOP蛋白表达,降低内质网应激,减少细胞凋亡,改善脑血管及肾组织损伤[13-14],因而推测,FUR可能下调PERK/eIF2α/CHOP通路,抑制ICH后内质网应激,进而缓解其继发性脑损伤。本文结果显示,ICH大鼠经FUR处理后,其海马神经元病理损伤有不同程度减轻,另外大鼠Longa评分、Evans蓝渗出量、大脑含水量、血清IFN-γ及IL-6水平、p-PERK/PERK、p-eIF2α/eIF2α、CHOP表达水平均降低,且呈剂量依赖性,表明FUR可下调PERK/eIF2α/CHOP通路蛋白表达,抑制内质网应激及炎性反应,减少海马神经元凋亡,缓解脑水肿,改善ICH大鼠神经功能障碍。

A.sham operation group;B.model group;C.FUR-L group;D.FUR-M group;E.FUR-H group;F.ganglioside group图4 HE染色检测大鼠海马神经元损伤情况Fig 4 HE staining was used to detect the damage of hippocampal neurons (scale bar=50 μm)

*P<0.05 compared with sham operation group; #P<0.05 compared with model group; △P<0.05 compared with FUR-L group; ▲P<0.05 compared with FUR-M group图5 ELISA检测大鼠血清IL-6及IFN-γ水平Fig 5 ELISA was used to detect the serum levels of IFN-γ and IL-6 in rats(pg/mL)
综上所述,FUR可降低PERK、eIF2α磷酸化水平,下调CHOP蛋白表达,减弱内质网应激及炎性反应,缓解脑水肿和神经元损伤,减轻ICH引发的继发性脑损伤,促使神经功能修复,抑制PERK/eIF2α/CHOP信号通路激活可能是其药理机制之一,但本文只做了初步探究,还存在一定不足,后续还应使用该信号通路激活剂及抑制剂进行对照验证。

A.sham operation group;B.model group;C.FUR-L group;D.FUR-M group;E.FUR-H group;F.ganglioside group; *P<0.05 compared with sham operation group; #P<0.05 compared with model group; △P<0.05 compared with FUR-L group; ▲P<0.05 compared with FUR-M group
