化学诱导对2株海洋真菌次级代谢产物及其生物活性的影响
2022-01-19刘亚月薛欣怡黎卓怡马小翔梁金月胡雪琼
刘亚月,薛欣怡,黎卓怡,马小翔,梁金月,胡雪琼,张 翼,2,3
化学诱导对2株海洋真菌次级代谢产物及其生物活性的影响
刘亚月1,3,薛欣怡1,黎卓怡1,马小翔1,梁金月1,胡雪琼1,3,张 翼1,2,3
(1. 广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东省海洋生物制品工程实验室//广东省海洋食品工程技术研究中心//水产品深加工广东普通高等学校重点实验室//湛江市脑健康海洋药物与营养品重点实验室//广东海洋大学海洋药物研究所,广东 湛江 524088;2. 广东海洋大学深圳研究院海洋医药研发中心, 广东 深圳 518120;3. 海洋食品精深加工关键技术省部共建协同创新中心, 大连工业大学, 辽宁 大连 116034)
【目的】以2株海洋真菌为研究对象,探究不同种类及浓度的化学表观遗传修饰剂对其次级代谢产物化学多样性和生物活性的影响。【方法】基于化学表观遗传修饰策略,采用两种不同的化学表观遗传修饰剂5-氮杂胞嘧啶核苷(5-azaC)和丁酸钠,分别对sp. 019和ZN4-5-4两株海洋来源真菌进行表观遗传修饰。通过观察真菌在培养基中的生长状态变化,并根据薄层层析(TLC)指纹图谱、高效液相色谱(HPLC)图谱、乙酰胆碱酯酶(AChE)抑制、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picryl-hydrazyl, DPPH)自由基清除和卤虫致死活性筛选模型等技术手段,从中筛选出代谢产物丰富、AChE抑制活性与抗氧化活性产物丰富且毒性小的发酵培养条件。【结果】添加1 mmol/mL的丁酸钠诱导剂可使菌株019和ZN4-5-4的次生代谢产物的种类增加,且同时能提高该菌株次级代谢产物的AChE的抑制活性和DPPH自由基清除活性。因此,确定菌株019和ZN4-5-4的最优发酵条件均是添加浓度为1 mmol/mL丁酸钠的PDB培养基。【结论】化学表观遗传修饰策略指导下,添加诱导剂5-azaC或者丁酸钠对2株海洋真菌次生代谢产物的产生有影响。
海洋真菌;化学诱导;乙酰胆碱酯酶抑制活性;抗氧化;卤虫致死活性
海洋真菌作为海洋生物类群的重要组成部分,其次生代谢产物具有多样的结构类型和显著的药理活性,已成为海洋天然药物研究重要生物资源和研究热点[1]。海洋真菌次级代谢产物分离得到的新化合物多具有抗病毒、抗肿瘤、抗菌活性和抗心脑血管疾病、抗氧化、酶抑制剂等显著的药理活性[2]。从中分离得到二蓖麻酚单醚化合物,其中化合物versiorcinols A显示中等强度的抑菌活性[3]。从海洋藻类内生真菌EH 399中分离获得六个化合物均对大肠杆菌、黄褐微球菌和哈维弧菌显示一定的抗菌活性,其中cladosporol H对A549、Huh7和LM3细胞系表现出明显的细胞毒性,cladosporol C则对H446细胞系表现出细胞毒性[4]。但是现有的研究只涉及海洋天然资源中的一小部分。海洋中大量的微生物,尤其是内生微生物中活性先导化合物的筛选工作尚少,具有巨大的开发潜力。化学表观遗传修饰是指通过添加一些小分子的化学表观遗传修饰剂,特异性地改变化学表观遗传修饰酶的活性,激活某些未表达次生代谢产物的沉默基因簇,诱导真菌产生不同结构骨架或生物活性更丰富的次级代谢产物[5-6]。研究发现,真菌中存在大量编码化合物的基因,目前从中分离得到的化合物数量远少于真菌拥有的这些基因所能编码的化合物数量,这证明其中很多基因都处于沉默状态。激活沉默基因,可以使微生物表达出新的次级代谢产物,增加微生物的化学多样性,从而有可能产生数量更多、结构类型更丰富的代谢产物,对进一步研究海洋微生物次级代谢产物具有重要意义[7-9]。化学表观遗传修饰是目前激活沉默基因表达的有效方法之一,具有成本低、效率高和易操作等优点。既可应用于模式真菌的研究,也可以用于修饰遗传背景不清楚的真菌,不受实验条件限制,能够在大部分实验室中完成[6]。
本研究中以2株海洋真菌为研究对象,探究不同种类及浓度的化学表观遗传修饰剂对其次级代谢产物化学多样性和生物活性的影响。分别选用丁酸钠和5-azaC作为诱导剂对两株海洋真菌进行化学诱导调控,选出各菌株次级代谢产物丰富、抗AD相关活性明显且毒性小的最优发酵条件,以期为后续深入挖掘2株真菌的活性次级代谢产物奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源 海洋真菌sp. 019采集于湛江红树林自然保护区的红树植物杨叶肖槿(),经ITS rDNA全序列分析确定为青霉菌(Genbank登录号:MN826202);海洋真菌ZN4-5-4 (简称:ZN)则是采集于琼州海峡的沉积泥,经ITS rDNA全序列分析确定为曲霉菌(Genbank登录号:MN826203)。目前两株真菌菌株均保存于广东海洋大学海洋药物研究所。
1.1.2 培养基 PDB培养基:葡萄糖20 g,蛋白胨5 g,海盐3 g,加入纯水至1 L,于1×105Pa灭菌30 min。
1.1.3 主要试剂与仪器 主要试剂:诱导剂5-azaC和丁酸钠分别配成5个浓度梯度的贮液(250 mmol/L、25 mmol/L、250 μmol/L、25 μmol/L、2.5 μmol/L)。其中5-azaC用DMSO溶解,丁酸钠用无菌水溶解,经0.22 μm滤膜除菌后待用。AChE (C3389)、碘代硫代乙酰胆碱 (Acetylthiocholine iodide, ATCI,DA0048)、牛血清蛋白 (Bovine serum albumin, BSA,A1933)、1, 1-二苯基-2-三硝基苯肼 (DPPH,D9132),均购自Sigma-Aldrich;5, 5′-二硫代二硝基苯甲酸 (Dithiobisnitrobenzoic acid, DTNB,D8130),购自Ruibio公司。其余试剂均为国产分析纯试剂。
主要仪器:GF254硅胶高效薄层层析板购自德国默克公司。盐水虾幼虫卵购自中国爱家水族馆。1260 Infinity Ⅱ高效液相色谱仪,美国Agilent公司;Epoch2酶标仪,美国BioTek公司;R-300旋转蒸发仪,瑞士BüChi公司;多功能紫外透射仪WFH-201B,上海精科实业有限公司。
1.2 方法
1.2.1 菌株诱导前种子的制备 将待诱导的两株海洋真菌放进28 ℃、湿度为80%的霉菌培养箱中活化过夜;在无菌条件下,将菌种接种到预先装有15 mL灭菌马铃薯葡萄糖固体培养基的平板中;于28 ℃恒温培养箱中培养3~4 d,待菌落孢子生长茂盛备用。
1.2.2 菌株的化学诱导 将上述培养好的菌株用0.85%的无菌生理盐水洗涤、摇匀,形成孢子悬液。采用12孔板,每孔加入2 mL PDB培养基和200 μL孢子悬液,28 ℃培养3 d后,分别加入化学诱导剂,并设置5个诱导剂终浓度梯度 (10 mmol/L、1 mmol/L、100 μmol/L、10 μmol/L和1 μmol/L),每组设置2个平行;将12孔板置于28 ℃、湿度为80%的霉菌培养箱中静置培养14 d,观察菌株生长状态的变化并拍照记录。
1.2.3 菌株次生代谢产物的提取 从12孔板中取出菌丝体和发酵液,3 000 r/min离心、浓缩干燥4 h,加入200 μL甲醇,功率500 W超声提取30 min,10 000 r/min离心30 min,取出上清液备用。减压浓缩、干燥、称量,得到粗提取物的质量(mg)。
1.2.4 菌株次生代谢产物的TLC和HPLC图像分析 将上述获得的各粗提物用甲醇统一配制成10 mg/mL的浓缩液,分别采用GF254TLC硅胶薄层层析板和HPLC对各粗提物的化学多样性进行分析。选择氯仿(CHCl3):甲醇(MO)= 7∶1 (∶)二元溶剂体系作为TLC分析的展开剂,分别记录254和365 nm波长下代谢产物的紫外图像。HPLC分析中,进样量为10 μL,洗脱条件为:0 ~ 15 min,50% ~ 100% 的甲醇-水;15 ~ 25 min,100%甲醇; 25 ~ 27 min,100% ~ 50% 的甲醇-水;27 ~ 30 min,50%的甲醇-水,流速0.6 mL/min。DAD检测器信号采集波长为190 ~ 400 nm,检测波长为254 nm。
1.2.5 菌株次生代谢产物的AChE抑制活性测定
通过优化的Ellman’s比色法[10]测定粗提物对AChE的体外抑制活性。
初筛:往96孔板中每孔加100 μL用甲醇溶解的质量浓度为5 mg/mL的样品,等待样品中有机溶剂挥干。再依次往96孔板中每孔加入1 μL的DMSO,49 μL PBS、10 μL 0.2 U/mL AChE和20 μL DTNB,将96孔板置于37 ℃培养箱保温10 min。然后往每个孔加入20 μL ATCh,继续于37 ℃培养箱孵育。20 min后,通过酶标仪测定405nm 处的光密度值405nm,盐酸化多奈哌齐作为阳性对照[11]。通过下述公式计算化合物对AChE的抑制率。
抑制率=[(control−blank)−(sample−sample blank)]/(control−blank)。 (1)
其中sample blank为加入样品和BSA,但不加入AChE的光密度,sample为加入样品和AChE的光密度,control为加入AChE但不加入样品的光密度,blank为加入BSA但不加入样品和AChE的光密度。
复筛:经上述初筛后,选择AChE抑制率大于50%的样品进行活性复筛实验。采用倍半梯度稀释法对样品进行稀释后,按照上述方法测定各粗提物的IC50值,IC50值是化合物对AChE抑制为50%所对应的浓度。将抑制率和浓度对数 (lnC)导入Origin 9.1软件。通过三次多项式回归方程拟合得到浓度对数曲线,并计算得到ln(IC50)。最后使用Microsoft Excel计算得到IC50。
1.2.6 菌株次生代谢产物的DPPH自由基清除活性测定 使用Sharma和Bhat[12]描述的DPPH自由基清除法,在96孔板中测定粗提物的抗氧化能力。
初筛:总反应体系为100 μL,sample为含有50 μL的0.16 mmol/L DPPH和50 μL溶解浓度为5 mg/mL粗提物的DMSO。与此同时,50 μL 0.16 mmol/L DPPH和50 μL DMSO用作对照(control),50 μL MeOH和50 μL溶解不同浓度化合物的DMSO作为样品本底(sample blank),50 μL MeOH和50L DMSO 作为对照(blank),将96孔板放置在暗处30 min。通过酶标仪测定λ517nm处的光密度517nm。维生素C作为阳性对照[13]。通过下述公式计算化合物的清除率。
清除率= [(control−blank)−(sample−sample blank)]/(control−blank)。 (2)
复筛:经上述初筛后,选择DPPH自由基清除率大于50%的样品进行活性复筛实验。采用倍半梯度稀释法对样品进行稀释后,按照上述方法测定各粗提物的EC50值,EC50值是化合物对DPPH自由基清除率为50%所对应的浓度。将清除率和浓度对数 (lnC)导入Origin 9.1软件。通过三次多项式回归方程拟合得到浓度对数曲线,并计算得到ln (EC50)。最后使用Microsoft Excel计算得到EC50。
1.2.7 菌株次生代谢产物的卤虫致死活性测定[14]采用96孔板法,使用盐水虾幼虫测试化合物的致死能力。每孔加199 μL含卤虫幼体的溶液(每孔约含20只卤虫),制成测试培养板。将粗提物用DMSO配制成10 mg/mL的溶液,加入1 μL到每个培养板孔中,每个粗提物样品设置成50 μg/mL终浓度,设3个平行样。在28 ℃的培养箱中保持光照培养24 h后,记录每个孔中死亡幼虫的数量和总数。同时,用DMSO和秋水仙碱[15]分别作为阴性和阳性对照。卤虫致死活性采用卤虫致死率表示:
卤虫致死率= [(加药组致死率-对照组致死率)/对照组存活率]。 (3)
2 结果与分析
2.1 菌株诱导前后表观形态对比
采用12孔板对2株海洋真菌进行微量培养,结果如图1所示。添加诱导剂5-azaC进行诱导前后,菌株019和ZN的表观生长形态相比空白组均发生了显著变化。如图1(B1)所示,添加诱导剂5-azaC进行诱导前后,菌株019的菌丝体由黑褐色变成棕色,菌液变为黄色。并且随着诱导剂浓度增加,菌液颜色逐步加深。菌株ZN的菌丝体则由棕色变成白色,菌液变为亮黄色(图1(C1))。由此可以推断,诱导剂5-azaC的加入对菌株019和ZN的次生代谢产物可能产生了影响。而添加丁酸钠进行诱导前后,2株菌株的菌丝体颜色虽未表现出明显变化,但菌丝体厚度和菌液颜色深浅随着加入诱导剂浓度不同也表现出一定变化。

B1、B2、C1和C2分别代表菌株019和ZN在添加化学诱导剂5-azaC和丁酸钠的PDB培养基中培养14 d生长形态;依次是B1为019添加5-azaC,B2为019添加丁酸钠,C1为ZN添加 5-azaC,C2为ZN添加丁酸钠;12孔板中每个孔添加的诱导剂浓度如图A所示
2.2 菌株诱导前后次生代谢产物的产量分析对比
微量培养14 d后,用甲醇对2株菌株的次生代谢产物进行提取结果如图2所示。结果表明,添加诱导剂诱导前后,2株菌株的次生代谢产物产量均发生了相应变化。以菌株019为例,在添加诱导剂进行诱导后,菌株次生代谢产物产量明显增加;尤其是在添加诱导剂5-azaC浓度为10 µmol/L和1 µmol/L的PDB培养基条件下的产量增加显著 (0.000 1),大于同等浓度下添加诱导剂丁酸钠诱导后的产量。菌株ZN则是随诱导剂加入,代谢产物质量逐渐增加,当添加浓度为10 µmol/L 5-azaC的PDB培养基条件下的产量增加最明显。但是随着添加诱导剂5-azaC浓度进一步增大,次级代谢产物的产量却明显下降。可推测高浓度的诱导剂5-azaC的加入对菌株ZN的代谢产生了抑制作用。
2.3 菌株诱导前后次级代谢产物的TLC和HPLC图像分析对比
利用TLC和HPLC对化学诱导前后不同菌株的次生代谢产物进行分析可以发现:对菌株019而言,观察其TLC图像可知,5-azaC诱导组 (1 µmol/L除外)相比对照组的代谢产物在波长254 nm和365 nm下吸收斑点明显不同(图3(B1));丁酸钠诱导组相比对照组的代谢产物没有明显区别,但是在添加诱导剂浓度为100 µmol/L时,其主产物吸收斑点的强度明显增强,这意味着在该培养条件下,菌株019代谢某些化合物的能力增强(图3(B2))。进一步观察其HPLC图像可知,在254 nm波长下添加不同浓度的5-azaC诱导组相比对照组的吸收峰明显增多(图4(B1));而低浓度丁酸钠诱导组相比对照组的代谢产物主吸收峰没有明显区别,但是随着添加诱导剂浓度增大,在浓度为10 mmol/L和1 mmol/L时,其吸收峰的个数明显增多,这意味着诱导剂的加入明显改变了菌株019的次生代谢产物,菌株的代谢产物更丰富(图4(B2))。而对菌株ZN而言,观察其TLC图像可知,高浓度的5-azaC诱导组和丁酸钠诱导组相比对照组的代谢产物在波长254 nm和365 nm下吸收斑点都有所增加(图3(C1、C2))。进一步分析其HPLC图像可得出相同结论,在添加诱导剂浓度为1 µmol/L和10 µmol/L时,不管是添加5-azaC还是丁酸钠,菌株代谢产物均没有明显变化。但随着添加诱导剂浓度进一步增大,菌株的吸收峰明显增多,部分代谢产物的峰吸收强度也有一定增强(图4(C1、C2))。这表明对菌株ZN而言,高浓度诱导剂的加入更能刺激菌株次生代谢产物的变化。由此推测,在以上特定诱导条件下,菌株可能产生了新的代谢产物。

样品的编号为xxx-y-z,xxx代表菌株编号简称;y代表添加诱导剂的类型,1代表添加诱导剂5-azaC,2代表添加诱导剂丁酸钠,z代表添加诱导剂浓度,1-6分别表示10 mmol/L、1 mmol/L、100 µmol/L、10 µmol/L、1 µmol/L、空白; “****”表示与空白组比较,P < 0.0001
2.4 菌株诱导前后次级代谢产物生物活性分析对比
各菌株粗提物的AChE抑制活性、DPPH自由基清除活性和卤虫致死活性如图5。对菌株019而言,无论是添加诱导剂5-azaC或丁酸钠诱导后,菌株次生代谢产物的AChE抑制活性、DPPH自由基清除活性和卤虫致死活性均明显增强。尤其是添加诱导剂5-azaC诱导后,其代谢产物的AChE抑制活性均大于40%,其中添加浓度为1 mmol/L的5-azaC诱导组菌株次生代谢产物的AChE抑制率高达 96.4%,而空白组不显示抑制活性。添加诱导剂丁酸钠(1 mmol/L)诱导后,其菌株次生代谢产物的AChE抑制率为95.6%,但其卤虫致死率也高达63.6%。对菌株ZN而言,添加诱导剂5-azaC诱导后,菌株次生代谢产物的AChE抑制活性相比对照组明显减弱甚至消失;同时菌株次级代谢产物的卤虫致死活性有所增强(浓度为10 µmol/L时,抑制率为60.0%);而添加诱导剂丁酸钠(10 mmol/L、1 mmol/L和100 µmol/L)诱导后,菌株次级代谢产物的AChE抑制活性明显增强。
经初筛后,抑制率或者清除率大于50%的样品活性复筛结果如表1所示。菌株019添加5-azaC (1 mmol/L)的诱导组其次生代谢产物显示较强的AChE抑制活性(IC50为31.9 μg/mL)。但在添加诱导剂丁酸钠(1 mmol/L)进行诱导后其次生代谢产物同时显示较强的AChE抑制活性(IC50值为32.2 μg/mL)和清除活性(EC50为80.6 μg/mL)。因此,选择具有双重活性的丁酸钠诱导组(1 mmol/L)作为最优发酵条件。菌株ZN4-5-4在添加诱导剂丁酸钠(1 mmol/L和100 µmol/L)的PDB培养基条件下的次级代谢产物也具有显著的AChE抑制活性,IC50值均为24.9 μg/mL。结合两个条件下菌株次级代谢产物的产量因素,选择产量更多的丁酸钠诱导组(1 mmol/L)作为最优发酵条件。

254 nm和365 nm表示测定时选用的紫外波长条件;10 mmol/L、1 mmol/L、100 µmol/L、10 µmol/L、1 µmol/L表示添加诱导剂的浓度;B1、B2、C1和C2分别代表菌株019和ZN添加化学诱导剂5-azaC和丁酸钠的次级代谢产物在254 nm波长下的TLC指纹图谱;B3、B4、C3和C4分别代表菌株019和ZN添加化学诱导剂5-azaC和丁酸钠的次级代谢产物在365 nm波长下的TLC指纹图谱;依次是B1、B3为019添加5-azaC,B2、B4为019添加丁酸钠,C1、C3为ZN添加 5-azaC,C2、C4为ZN添加丁酸钠。

图4 诱导前后菌株019和ZN发酵产物的HPLC图谱

图5 诱导前后菌株粗提物的AChE抑制活性、DPPH自由基清除活性和卤虫致死活性生物活性
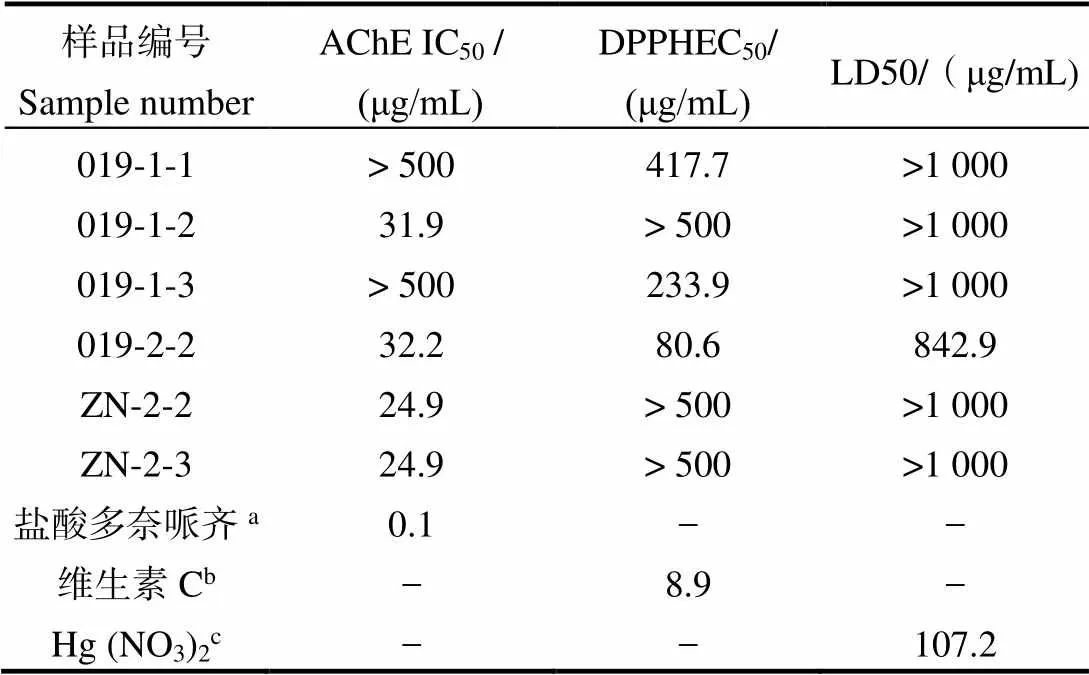
表1 部分样品的IC50、EC50和LD50活性值
注:a, b, c表示阳性对照。“-”表示没有测试。
Note: a/b/c means positive control,“-”means not test.
3 讨论
大多数微生物在传统单一的条件下培养只能表现出有限的生物活性。而将实验室条件下生长的微生物的代谢产物种类与自然环境下生长微生物的代谢产物种类进行对照,发现许多代谢产物的表达被抑制了[16]。因此,如何采用科学合理的方法来削弱环境对于微生物内部表达基因的抑制作用是获得新型次生代谢产物表达的核心问题。大量科学研究表明,化学表观遗传修饰策略能够很好达到发掘菌株潜能、获得新型代谢产物的目的[17-19]。如王晓茹等[20]在真菌的培养基中加入浓度为 50 μmol/L的DNA甲基化酶抑制剂 5-azaC,结果发现实验组与对照组的菌株在生长过程中各自的菌丝体形貌上出现了很大差别,最后通过对其次生代谢产物采用高效液相色谱分析,发现在激活后该菌与对照组相比产生了 10 个新色谱峰。通过对实验组真菌代谢产物进行进一步分离纯化,得到了 2 个新的萜类化合物atlantinone A和 atlantinone B。杨静明等报道[21]采用组蛋白去乙酰化酶抑制剂丁酸钠处理一株珊瑚来源的土曲霉C23-3,可以显著提高其丁内酯类代谢产物的差异性。在本研究中,同时选用去甲基化酶抑制剂5-azaC和组蛋白乙酰化酶抑制剂丁酸钠两种诱导剂进行研究,并设立5个浓度梯度(10 mmol/L、1 mmol/L、100 μmol/L、10 μmol/L和1 μmol/L)对sp. 019和ZN4-5-4两株海洋来源真菌进行表观遗传修饰,发现不同种类及浓度的化学表观遗传修饰剂对不同海洋来源真菌次生代谢产物的产生和生物活性影响不同。
在菌株次级代谢产物产量和化学多样性方面,添加诱导剂能在一定程度上增加菌株次生代谢产物的产量。如本研究中,添加浓度为10 μmol/L和1 μmol/L的诱导剂5-azaC对菌株019和ZN次生代谢产物的产量具有显著的增加作用(增长率> 46.7%)。同时结合菌株的TLC和HPLC图像可知,菌株的次级代谢产物的种类和个数也随着诱导剂的加入逐渐增多。如在添加浓度为10 mmol/L、1 mmol/L和100 μmol/L的诱导剂的情况下,菌株019和ZN的次生代谢产物种类明显增多。通过这些现象推测,诱导剂5-azaC和丁酸钠的加入可在一定程度上激活或者增强菌株的某些沉默基因,使得菌株的次生代谢产物的种类增加或者产量增加。
在菌株次级代谢产物生物活性方面,添加不同诱导剂对菌株次级代谢产物的生物活性影响不一。如本研究中,添加5-azaC对菌株019中抗AChE抑制和卤虫致死活性成分的产生具有显著激活作用,但是对菌株ZN中抗AChE活性成分的产生具有显著抑制作用。而添加丁酸钠可明显提高菌株019和ZN次生代谢产物的AChE抑制活性。同时发现,这种诱导激活作用并不具备浓度依赖性,如在用5-azaC激活的菌株019次生代谢产物实验中,在低于浓度为1 mmol/L时,菌株的抗AChE活性随着丁酸钠浓度增大而增强,当浓度超过1 mmol/L时,菌株019次生代谢产物的抗AChE活性随着5-azaC浓度升高而减小。可能的原因有:一是随着诱导剂5-azaC的加入,菌株019细胞内编码AChE抑制活性组分的沉默基因被激活,并且随着浓度增加,这种激活作用越明显,从而导致大量抗AChE活性的代谢产物被合成了出来,使得粗提物的AChE抑制活性增强。但当浓度增大到一定的时候,由于对主产物的基因激活作用达到饱和,且可能有其他新的基因被激活,导致新的代谢产物被合成,最终导致次生代谢产物的抗AChE活性降低。二有可能是由于DNA甲基化酶抑制剂被过多加入,从而导致DNA甲基化酶被过多抑制,导致生物体内代谢平衡紊乱,从而影响了真菌正常生长代谢过程,最终导致菌株019代谢产物的抗AChE活性的降低。由此可以得出,不同表观遗传修饰剂对于不同真菌的抗AChE活性代谢产物的激活是有浓度限制的,这个浓度可认为是表观遗传修饰剂作用的最佳浓度。
4 结论
本研究表明,不同种类及浓度的化学表观遗传修饰剂对不同海洋来源真菌次生代谢产物的产生和生物活性影响不同。综合菌株次级代谢产物的产量、种类、AChE抑制活性、DPPH自由基清除活性和卤虫致死活性结果分析可知:添加1 mmol/mL的5-azaC和丁酸钠诱导剂均可使菌株019的次生代谢产物的种类增加;且同时能提高该菌株次级代谢产物的AChE的抑制活性和DPPH自由基清除活性。但添加1 mmol/mL的5-azaC会增大次级代谢产物的卤虫致死率。而对菌株ZN4-5-4而言,添加1 mmol/mL和100 μmol/L的丁酸钠诱导剂均可使该菌株次生代谢产物的种类增加,且同时能提高次级代谢产物的AChE抑制活性和DPPH自由基清除活性。但添加1 mmol/mL的丁酸钠可使菌株次级代谢产物产量增大程度更多。综上所述,由此确定了菌株019和ZN4-5-4的最优发酵条件均为添加了浓度为1 mmol/mL丁酸钠的PDB培养基。
[1] RATEB M E, EBEL R. Secondary metabolites of fungifrommarine habitats[J]. Natural Product Reports, 2011, 28(2): 290-344.
[2] CARROLL A R, COPP B R, DAVIS R A, et al. Marine natural products[J]. Natural Product Reports, 2020, 37(2): 175-223.
[3] GU B B, TANG J, WANG S P, et al. Structure, absolute configuration, and variable-temperature 1H-NMR study of (±)-versiorcinols A-C, three racemates of diorcinol monoethers from the sponge-associated fungus16F-11[J]. RSC Advances, 2017, 7(79): 50254-50263.
[4] LI H, LI X, MANDI A, et al. Characterization of cladosporols from the marine algal-derived endophytic fungusEN-399 and configurational revision of the previously reported cladosporol derivatives [J]. Journal of Organic Chemistry, 2017, 82(19): 9946-9954.
[5] TAKAHASHI J A, TELES A P C, ALMEIDA PINTO BRACARENSE A, et al. Classical and epigenetic approaches to metabolite diversification in filamentous fungi[J]. Phytochemistry Reviews, 2013, 12(4): 773-789.
[6] 张伟, 陈敏, 邵长伦, 等. 化学表观遗传修饰方法在真菌次级代谢产物研究中的应用[J]. 中国海洋药物, 2014, 33(5): 83-91.
[7] 孙坤来. 表观遗传修饰增加两株浒苔真菌的化学多样性研究[D]. 青岛: 中国海洋大学, 2014.
[8] 李德宝, 张雪晴, 张秀丽, 等. 1株花柳珊瑚来源真菌产cytochalasin B发酵优化及其化学表观遗传修饰研究[J]. 中国海洋药物, 2016, 35(5): 14-20.
[9] 丁佩. 化学表观遗传修饰剂激活海洋真菌sp.AA007次级代谢产物的研究[D]. 杭州: 浙江工商大学, 2017.
[10] ELLMAN G L, COURTNEY K D, ANDRES V jr, et al. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology, 1961, 7(2): 88-95.
[11] PALEACU D, MAZEH D, MIRECKI I, et al. Donepezil for the treatment of behavioral symptoms in patients with Alzheimer's disease[J]. Clinical Neuropharmacology, 2002, 25(6): 313-317.
[12] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205.
[13] PADAYATTY S J, KATZ A, WANG Y H, et al. Vitamin C as an antioxidant: evaluation of its role in disease prevention[J]. Journal of the American College of Nutrition, 2003, 22(1): 18-35.
[14] SOLIS P N, WRIGHT C W, ANDERSON M M, et al. A microwell cytotoxicity assay using(brine shrimp)[J]. Planta Medica, 1993, 59(3): 250-252.
[15] AN C Y, LI X M, LI C S, et al. Prenylated indolediketopiperazine peroxides and related homologues from the marine sediment-derived fungusSD-273[J]. Mar Drugs, 2014, 12(2): 746-756.
[16] 杨康敏, 高向东, 顾觉奋. 激活沉默基因簇发掘微生物次级代谢产物的研究进展[J]. 中国医药生物技术, 2015, 10(1): 77-80.
[17] HENRIKSON J C, HOOVER A R, JOYNER P M, et al. A chemical epigenetics approach for engineering thebiosynthesis of a cryptic natural product from[J]. Organic & Biomolecular Chemistry, 2009, 7(3): 435-438.
[18] 张伟. 化学表观遗传修饰法研究海葵来源月状旋孢腔菌代谢产物多样性初探[D]. 青岛: 中国海洋大学, 2014.
[19] 孙鉴昕. 表观遗传修饰剂对三株刺松藻内生真菌次级代谢产物生物活性的影响[D]. 青岛: 青岛科技大学, 2016.
[20] WANG X R, SENA FILHO J G, HOOVER A R, et al. Chemical epigenetics alters the secondary metabolite composition of guttate excreted by an Atlantic-forest-soil-derived[J]. Journal of Natural Products, 2010, 73(5): 942-948.
[21] 杨静明, 杨文聪, 刘亚月, 等. 化学诱导对一株海洋来源土曲霉C23-3次生代谢产物及其生物活性的影响[J]. 微生物学通报, 2019, 46(3): 441-452.
Influence of Chemical Induction on the Secondary Metabolites and Biological Activities of Two Marine Fungi
LIU Ya-yue1,3, XUE Xin-yi1, LI Zhuo-yi1, MA Xiao-xiang1, LIANG Jin-yue1, HU Xue-qiong1,3, ZHANG Yi1,2,3
(1.,////////////,,524088,; 2.,,518120,; 3.,,116034,)
【Objective】Based on two marine-derived fungi, this study explore the effects of different types and concentrations of chemical epigenetic modifiers on the secondary metabolites and biological activities.【Method】Based on the chemical epigenetic modification strategy, two strains of marine-derived fungi, i.e.sp. 019 andZN4-5-4, were epigenetically modified by two different chemical epigenetic modifiers, i.e. 5-azacytidine (5-azaC) and sodium butyrate. The morphological variations of the mycelia were observed. Then, based on the thin layer chromatography (TLC) fingerprints, high performance liquid chromatography, acetylcholinesterase (AChE) inhibitory, 1,1-Diphenyl-2-picryl-hydrazyl (DPPH) free radical scavenging, and artemia lethality activities screening models, the fermentation conditions with rich metabolites, low toxicity and rich anti-acetylcholinesterase and antioxidant products were initially screened out.【Result】The results showed that different concentrations (i.e. 10 mmol/L, 1 mmol/L, 100 µmol/L, 10 µmol/L, 1 µmol/L) of 5-azaC and sodium butyrate had significant improvementeffects on the production and biological activity of marine fungal secondary metabolites.【Conclusion】The optimal fermentation conditions for strain 019 and ZN4-5-4 were PDB medium plus 1 mmol/mL sodium butyrate. Under the chemical epigenetic modification strategy, the addition of inducer 5-azaC or sodium butyrate exerts some effects on the production of secondary metabolites of three marine fungi.
marine fungi; chemical induction; acetylcholinesterase inhibitory activity; antioxidant; artemia lethal activity
Q936
A
1673-9159(2022)01-0050-09
10.3969/j.issn.1673-9159.2022.01.008
刘亚月,薛欣怡,黎卓怡,等. 化学诱导对2株海洋真菌次级代谢产物及其生物活性的影响[J]. 广东海洋大学学报,2022,42(1):50-58.
2021-09-09
国家自然科学基金(21807015);广东海洋大学博士科研启动项目(R18008);广东省扬帆计划引进紧缺拔尖人才项目(201433009);广东省自然科学基金(2018A030307046);深圳市科创委基础研究自由探索项目(JCYJ20170306165013264);深圳市科创委基础研究面上项目(JCYJ20190813105005619);深圳市大鹏新区产业发展资金(KY20180203 和PT201901-05);深圳市大鹏新区科技研发项目(KJYF202001-07)
刘亚月(1989-),女,博士,讲师,主要研究方向为海洋微生物活性物质。E-mail: yayue_liu@163.com
张翼,男,教授,博士,研究方向为海洋生物化学。E-mail: hubeizhangyi@163.com
(责任编辑:刘岭)
