急冷与空气暴露联合胁迫对凡纳滨对虾生理代谢影响
2022-01-19徐德峰吴嘉鑫孙力军秦小明范秀萍
徐德峰,吴嘉鑫,孙力军,秦小明,范秀萍
急冷与空气暴露联合胁迫对凡纳滨对虾生理代谢影响
徐德峰,吴嘉鑫,孙力军,秦小明,范秀萍
(广东海洋大学食品科技学院 // 广东省水产品加工与安全重点实验室 // 广东省海洋食品工程技术研究中心,广东 湛江 524088; 大连工业大学海洋食品精深加工协同创新中心,辽宁 大连 116034)
【目的】探明无水保活流通过程中凡纳滨对虾()响应急冷(acute cold,AC)与空气暴露(waterless duration,WD)联合胁迫的生理代谢调节规律。【方法】研究模拟产业运输实际,分析联合胁迫(AC+WD)进程中凡纳滨对虾血液和肝胰腺典型生化指标,以及肝胰腺组织病理变化。【结果】AC胁迫后,凡纳滨对虾生理应激指标血清皮质醇含量由正常组(normal control,NC)的(326.90±4.61)pg/mL显著增加到AC组的(427.16±7.92)pg/mL(< 0.05),AC+WD组则随时间延长而逐渐降低。血清葡萄糖含量在联合胁迫6 h后达到最大值(26.31±1.05)mg/dL,乳酸在9 h达到峰值(7.90±0.11)mmol/L。AC及AC+WD组中血蓝蛋白、尿素氮和肌酐含量较NC组均发生不同程度的增加,而总蛋白含量先升后降,总胆固醇和甘油三酯含量呈胁迫时间依赖性下降。血清谷草转氨酶、谷丙转氨酶、酸性和碱性磷酸酶活力呈上升趋势,并在9 h达到峰值。以上生化指标在胁迫复苏组有所恢复,表明AC+WD双重胁迫引起凡纳滨对虾物质代谢紊乱,复苏后机体生理应激和代谢系统发生一系列代偿性调节,且胁迫进程中肝胰腺组织病理损伤特征进一步解释了凡纳滨对虾响应环境联合胁迫的结构基础。【结论】无水保活流通过程中双重胁迫时间依赖性改变凡纳滨对虾生理应激水平和物质代谢,在9 h时可明显造成肝胰腺组织结构损伤,进而影响机体存活。
凡纳滨对虾;无水保活流通;生理应激;代谢响应;肝胰腺
水产品无水保活流通运载量大,结合航空运输可实现快速长途运输,综合成本较低,近年来得到了快速发展[1,2]。凡纳滨对虾()是世界养殖产量最高的三大优良虾种之一,对外界环境刺激极其敏感,保活流通过程中环境胁迫对其造成的应激性伤残时常发生,综合运输成本偏高。通常机体应激水平与血液生理生化指标密切相关,动物的生理病理变化可引起血液成分发生改变,因此检测凡纳滨对虾无水保活流通过程中血液生化指标可间接反映机体响应环境胁迫的生理调节规律,为改善保活流通条件提供理论依据。
受环境胁迫时,机体血液生理生化指标波动是反映体内代谢失衡的重要特征,与动物存活质量密切相关。Selye[3]研究表明,当动物受到不良环境胁迫时,其生理变化会在血液指标中体现出来。虽然虾类有水保活过程中血液生化指标的变化特征目前已有相关报道[4],且徐子涵[5]模拟凡纳滨对虾无水保活运输,探究了虾在无水低温胁迫环境中发生的氧化应激和抗氧化反应、免疫反应、糖代谢及相关神经内分泌反应,并设计了无水保活运输技术装置,但其过程中蛋白质、脂质代谢规律尚不清楚,且反应脏器损伤程度的相关生化指标也有待进一步阐明。胁迫环境下,为维持正常生理状态,水产动物会从神经内分泌、生理生化、免疫调节等层面进行协同调节以维持内环境的稳定[6],其中生理应激与代谢调节是经典途径。目前从物质和能量代谢途径解析长时间低温无水保活流通对大口黑鲈()[7]、虾夷扇贝()[8]、缢蛏()[9]等水产动物影响的研究已有相关报道,广温性鱼类在低温环境中可调节生理应激和代谢途径相关酶活力,从而使代谢和生理功能逐渐适应环境变化[10, 11]。整体而言,凡纳滨对虾无水保活流通过程中急冷(acute cold exposure,AC)及空气暴露(waterless duration,WD)联合胁迫(AC+WD)诱导的生理应激及代谢相关途径变化研究报道鲜见,机体响应双重环境胁迫的生理应激和代谢调节规律亟待揭示。因此,本研究通过模拟无水保活流通运输环境,评价AC+WD对凡纳滨对虾血液生化指标的影响,分析肝胰腺组织响应联合胁迫的特征性病理变化,探明生理应激、代谢响应和组织损伤相关参数变化的内在联系,揭示无水保活流通过程中凡纳滨对虾响应急冷联合无水暴露双重胁迫的生理应激与代谢调节规律,以期为后续存活质量预测和改善保活流通条件提供理论依据。
1 材料与方法
1.1 材料与试剂
约300尾体质量(16.23±1.12)g、体长(7.36±0.42)cm的凡纳滨对虾购自广东省湛江市霞山水产品批发市场。用空气压缩泵充分打入压缩空气后将对虾于2 h内运送至广东海洋大学食品科技学院保活流通实验室,新鲜海水适应性暂养6 h(温度25 ℃,盐度35),暂养期间不投放饵料,氧泵连续供氧,挑选无明显伤残、大小基本一致、活动正常、状态良好的180尾对虾进行分组实验。
氯化钠、葡萄糖、柠檬酸三钠、柠檬酸、乙二胺四乙酸二钠等均为分析纯,购于国药集团化学试剂有限公司;皮质醇测定试剂盒(货号MM-9000501)购于江苏酶免实业有限公司;葡萄糖测定试剂盒(货号F006-1-1)购于上海荣盛生物药业有限公司;总蛋白测定试剂盒(货号BC3185)购于上海索莱宝生物科技有限公司;乳酸测定试剂盒(货号A084-2-1)、甘油三酯测定试剂盒(货号A110-1-1)、总胆固醇测定试剂盒(货号A111-1-1)、尿素氮测定试剂盒(货号C013-1-1)、肌酐测定试剂盒(货号C011-1-1)、酸性磷酸酶测定试剂盒(批号A060-2-1)、碱性磷酸酶测定试剂盒(批号A059-2-2)、谷草转氨酶测定试剂盒(货号C010-2-1)、谷丙转氨酶测定试剂盒(货号C009-2-1)均购于南京建成生物工程研究所。
1.2 仪器与设备
HX-1508低温冷却循环泵,江苏天翔仪器有限公司;S-20氧泵,中国浙江宁波塞尔电气公司;25 cm ×20 cm塑料自封袋,天津永业塑料制品有限公司;PYX-CXG250电脑恒温层析柜,四川科力仪器技术有限公司;5810R台式高速冷冻离心机,德国艾本德有限公司;Varioskan全自动酶标仪,塞默飞世尔科技中国有限公司;
1.3 方法
1.3.1 凡纳滨对虾分组与实验设计 本实验以正常对照组(Normal control,NC)和急冷休眠组(Acute cold,AC)为对照,考察AC+WD对血液主要生化指标的影响。根据目前凡纳滨对虾保活流通实际,参照本团队前期实验方法[12],取暂养后的30尾凡纳滨对虾放于装有30 L自然海水中的塑料周转筐中(490 mm ×345 mm ×285 mm),室温25 ℃下放置,设为NC组。胁迫组采用低温冷却循环泵将海水温度降至12 ℃,然后将暂养后的凡纳滨对虾转移到该冷水进行急性低温诱导休眠,观察其活动状态,待对虾对外界刺激反应微弱时,随机选取其中30尾放于装有30 L自然海水并冷却至12 ℃的塑料周转筐(490 mm × 345 mm × 285 mm)中,实验期间一直存放于此环境,设为AC组。其余急冷胁迫休眠后的凡纳滨对虾随机放入塑料自封袋中并充氧密封(氧气体积分数95%),每袋10尾,每组3袋,共4组,然后参照Xu等[13]方法将对虾储存在12 ℃的层析柜中,模拟水产品无水保活运输环境作为AC+WD组,取双重胁迫开始3、6、9 h,以及9 h后放入自然水(水温25 ℃)复苏2 h的对虾样品,分别记为AC+WD(3 h)、AC+WD(6 h)、AC+WD(9 h)、AC+WD(9 h)+R组。笔者前期预实验发现,NC组在12 h的实验期间内其行为正常,且生化指标基本无变化;而AC组在12 ℃的海水中30 min即可进入完全休眠状态,之后可能是代谢速率显著下降,各生化指标也保持基本一致。因而在满足代表性的前提下为减少实验数量,NC和AC组仅在30 min时取样,而AC+WD组结合表观和皮质醇含量变化则分别在3、6、9 h,以及复苏2 h后取血淋巴和肝胰腺组织,检测相关生化指标,并行肝胰腺常规组织化学分析,综合阐明凡纳滨对虾响应AC+WD的生理应激与代谢调节。
1.3.2 样品采集 参照文献[14]预先配制无菌抗凝剂(140 mmol/L氯化钠,100 mmol/L葡萄糖,30 mmol/L柠檬酸三钠,26 mmol/L柠檬酸,10 mmol/L 乙二胺四乙酸二钠,pH 4.6),用1 mL一次性无菌注射器预先吸取0.2 mL上述抗凝剂,再按照血液与抗凝剂体积比1∶1从凡纳滨对虾围心腔内抽取血淋巴,将同一处理组对虾血液进行合并(约0.2 mL),放入1.5 mL离心管,4 ℃冰箱中低温静置2 h,迅速经3 000 r/min、4 ℃离心10 min,得上清液,液氮速冻后分装保存于-80 ℃用于各生化指标测定。通常血淋巴只在存活对虾体内才能抽取,如实验期间对虾个体死亡则血淋巴因凝血而无法抽取,因此本实验血清各指标测定均取自存活个体。
1.3.3 生化指标测定 皮质醇、葡萄糖、总蛋白、乳酸、甘油三酯、总胆固醇、尿素氮、肌酐含量,酸性磷酸酶、碱性磷酸酶、谷草转氨酶、谷丙转氨酶活力的测定均严格按照相关试剂盒说明书进行。血蓝蛋白含量测定参照潘鲁青等[15]方法稍作修改。取血液样品10 μL与990 μL磷酸盐缓冲液(PBS,pH = 7.0)混匀,充分震荡,避免产生气泡,在波长334 nm处测量光密度值,以PBS为对照。血蓝蛋白质量浓度(mg/mL)= 2.30 ×(334 nm) × 100。
1.3.4 肝胰腺组织结构分析 按照本团队前期实验方法[16],对各组对虾肝胰腺组织进行石蜡组织切片化学制样和结构观察。
1.4 统计分析
实验设计3个平行组,结果用平均值±标准差表示,采用SPSS 19.0软件进行差异分析,显著性水平= 0.05。采用Origin Pro 8.5软件进行绘图。
2 结果与分析
2.1 AC+WD对凡纳滨对虾行为及生理应激影响
由图1(A)可以明显看出,NC组对虾呼吸正常,自由游动;AC组对虾侧倒,游泳足摆动无规律,而后进入休眠状态,机械刺激无反应;而AC+WD组表现出更弱的行为反应;AC+WD(9 h)+R组对虾身体重新正立,恢复平衡性。
由图1(B)可以看出,AC组对虾血液中皮质醇质量浓度为(427.16±7.92)pg/mL,相比NC组的(326.90±4.61)pg/mL显著升高(< 0.05),提示AC胁迫对凡纳滨对虾产生了强烈的环境应激。在AC+WD组随胁迫时间的延长,皮质醇质量浓度呈下降趋势,复苏后进一步下降至(356.45±3.56)pg/mL,表明生理应激在复苏后有明显降低。

凡含一个相同字母,表示差异不具统计学意义(P > 0.05)
2.2 AC+WD对凡纳滨对虾糖、脂类底物代谢水平的影响
葡萄糖和乳酸是反映机体糖代谢速率的重要指标。本研究中,凡纳滨对虾血清葡萄糖的质量浓度在AC和AC+WD胁迫后逐渐升高,至AC+WD(6 h)组达到峰值(26.31±1.05)mg/dL,与NC组的(20.38±0.95)mg/dL相比差异显著(< 0.05);AC+WD9 h组有所下降,AC+WD(9 h)+R组进一步下降至(23.92±0.60)mg/dL,但未能恢复至NC组水平(图2(A))。此外,AC组与AC+WD(3 h)组之间血清乳酸水平变化不大(图2(B)),而AC+WD(3 h)组乳酸浓度较NC组显著增加,且在AC+WD(9 h)组达到最大值(7.90±0.11)mmol/L,复苏后虽有所下降但仍显著高于NC组(< 0.05),提示在保活后期细胞以无氧呼吸为主。
除了糖代谢有显著改变外,血液中脂类物质代谢也经历了明显改变。由图2(C-D)可以看出,AC胁迫处理后总胆固醇和甘油三酯均较NC组略微下降,且随AC+WD胁迫时间的延长而进一步下降。总胆固醇浓度在AC+WD(6 h)组较NC组显著降低(< 0.05),而甘油三酯浓度在AC+WD(3 h)组就显著下降(< 0.05)。之后两者均小幅下降,且在AC+WD(9 h)组达到最小值,分别为(8.51±0.30)mmol/L和(1.78±0.08)mmol/L,复苏后有所上升,但无法恢复至NC组水平。

凡含一个相同字母,表示差异不具统计学意义(P > 0.05)
2.3 AC+WD对凡纳滨对虾蛋白质代谢和氧运输能力的影响
无水保活过程中凡纳滨对虾血液总蛋白含量变化由图3(A)所示,与NC组相比,血液总蛋白质量浓度在经历单独AC或AC+WD胁迫时均显著增加(< 0.05),且AC+WD(3 h)组达到最大值(11.96±0.21)g/dL,随后在AC+WD(6 h)和AC+WD(9 h)组进一步下降,但在AC+WD(9 h)+R复苏又略微上升。血蓝蛋白质量浓度在AC组变化不大,联合胁迫后随时间的延长逐渐升高,AC+WD(9 h)组达到最大值(30.59±1.16)mg/mL,与NC组(19.59±0.84)mg/mL相比差异显著(< 0.05)(图3(B))。血蓝蛋白是氧运输主要蛋白,结合上述血液乳酸含量的变化规律,可以推测,凡纳滨对虾在应对双重环境胁迫后期供能方式发生显著改变。
另外,血液中尿素氮和肌酐浓度是反映肾脏功能的重要标志物。由图3(C)可以看出,AC组尿素氮浓度达到(19.61±0.22)mmol/L,相比NC组的(9.45±0.62)mmol/L显著增加(< 0.05),在随后的AC+WD胁迫过程中呈时间依赖性增加,AC+WD(9 h)组达到最大值(19.61±0.22)mmol/L,复苏后(AC+WD(9 h)+R组)虽有所恢复但仍旧显著高于NC组水平(< 0.05),上述改变可能是因为急冷胁迫刺激皮质醇的大量释放,进而带动尿素氮的释放,复苏后随着皮质醇浓度降低而逐渐恢复到正常水平。同时,与NC组相比,血液中肌酐含量在经历AC和AC+WD胁迫后均显著增加(图3(D),< 0.05),复苏后虽有所下降,但无法恢复至对照组水平,这可能与肾脏滤过功能受损有关。
2.4 AC+WD对凡纳滨对虾肝胰腺代谢功能酶活力的影响
由图4(A、B)可知,AC+WD胁迫过程中,凡纳滨对虾肝胰腺谷草转氨酶和谷丙转氨酶活力整体呈现上升趋势。AC胁迫后谷草转氨酶和谷丙转氨酶活力开始上升,AC+WD(3 h)组活力显著高于NC组(< 0.05),AC+WD(9 h)组谷草转氨酶和谷丙转氨酶活力达到峰值,分别为(6.11±0.32)和(6.19±0.24)U/L,提示凡纳滨对虾在AC+WD胁迫下肝脏损伤逐渐加重;复苏后二者分别显著下降至(4.05±0.19)和(3.84±0.21)U/L,但仍显著高于NC组(1.61±0.19)和(1.48±0.27)U/L(< 0.05),说明水产动物在应答强烈环境胁迫时会伴随重要脏器的不同程度结构损伤。另外,酸性磷酸酶和碱性磷酸酶均是通过肝脏向外表达的酶类,直接参与磷酸基团的代谢,同时与蛋白质、脂质、DNA等代谢相关[17]。由图4(C、D)可知,与NC组相比,AC组凡纳滨对虾酸性磷酸酶活力有所下降,而碱性磷酸酶活力略微上升;AC+WD胁迫后酸性磷酸酶和碱性磷酸酶活力均基本呈时间依赖性增加,且AC+WD(9 h)组二者达到最大值,分别为(9.14±1.24)和(17.07±0.21)U/100 mL;复苏后两者基本恢复至NC组水平,可能是因为胁迫环境下凡纳滨对虾提高代谢速率,调节自身免疫能力以抵抗不良环境胁迫,维持生命活动正常进行。

凡含一个相同字母,表示差异不具统计学意义(P > 0.05)
2.5 AC+WD对凡纳滨对虾肝胰腺组织结构的影响
甲壳动物肝胰腺中通常含分泌细胞(B细胞)、吸收细胞(F细胞)、储存细胞(R细胞)和胚细胞(E细胞),环境变化会对B、R细胞的比例造成影响。从图5可知,NC组细胞结构正常且分布均匀;AC胁迫时转运泡体积减小,基膜收缩;AC+WD联合胁迫3 h时转运泡体积变小,空泡数量相较NC组明显增加,B细胞数量减少,肝小管变形;AC+WD联合胁迫6 h时管腔变形严重,空泡数量明显减少,体积变大,R细胞数量减少;AC+WD联合胁迫9 h时管腔中可看到破碎的细胞组织,转运泡体积变大导致管腔被明显挤压变形;AC+WD联合胁迫9 h后复苏组中肝小管破裂,空泡数量明显减少,管腔和肝小管组织间隙的细胞破碎得到明显改善。说明凡纳滨对虾在应答AC+WD联合胁迫时,肝胰腺组织结构受到一定程度的损伤,与上述酶活力变化一致,指明了物质代谢变化的结构基础。

凡含一个相同字母,表示差异不具统计学意义(P > 0.05)

B,B细胞B-cells;L,管腔Lumen;R,储存细胞Restore-cells;TV,转运泡Transport vesicle;BM,基膜Basement membrane
3 讨论
动物受不良环境胁迫时,首先进行由神经内分泌系统介导的初级反应,促使皮质醇的合成与释放,实现机体的自我保护[18]。本研究中,凡纳滨对虾在单独AC胁迫后血清皮质醇含量迅速增加,在随后的AC+WD胁迫过程中逐渐下降,但均高于NC组(图1(B)),推测是在急性低温胁迫时,生存温度的骤变对机体产生强烈应激,使得皮质醇含量迅速升高。另外,皮质醇作为一种应激激素,同时具有调节糖、脂肪生物合成的作用[19,20]。本研究发现,AC+WD胁迫下机体血糖含量有所增加,很可能是因为皮质醇的释放调节了体内糖代谢速率所致,且皮质醇具有对抗胰岛素的作用,可抑制外周组织对葡萄糖的利用,从而使血糖升高,出现高血糖症。另外,葡萄糖含量在AC+WD(6 h)组内增加,后期略微下降,而乳酸含量在双重胁迫前期变化不大,6 h后显著增加(图2(A、B)),提示凡纳滨对虾在无水保活后期有氧代谢减弱,而无氧代谢相对增强。梁敏等[21]发现将凡纳滨对虾用CO2麻醉后进行低温无水运输,血清乳酸含量随运输时间延长而随之积累,其结果与本研究相符,证实乳酸含量是机体应答环境胁迫的敏感指标。胆固醇是类固醇激素合成的重要原料,甘油三酯是机体储存及氧化供能的重要形式[22],本研究中凡纳滨对虾在AC+WD双重胁迫下,总胆固醇和甘油三酯含量均有不同程度的下降(图2(C、D))。常玉梅等[23]发现,低温会使鲤()肝脏受损,总胆固醇和甘油三酯无法通过肠肝循环途径进入肝脏被重吸收,致使血液总胆固醇和甘油三酯含量升高,这与本研究结果基本一致,推测是在低温环境下,为维持内稳态的相对恒定,水产动物通过启动代谢补偿途径以加强自身产能来适应不良环境胁迫。
本研究发现,AC+WD胁迫进程中凡纳滨对虾血液总蛋白含量呈先升后降(图3(A)),与冀德伟等[24]对大黄鱼()响应8.5 ℃低温胁迫血液生化变化规律一致。同时,尿素氮和肌酐含量在AC及AC+WD胁迫组中均高于NC组,且呈时间依赖性上升(图3(C、D)),提示双重胁迫对肝肾功能损伤较大。黄建盛等[25]发现急性低氧胁迫下,军曹鱼()幼鱼血液总蛋白含量比胁迫前略有降低,而肌酐含量上升,这些研究结果均说明,环境胁迫影响水产动物物质代谢,并对肾组织造成一定的损伤,使其机能出现紊乱。同时,本研究中AC+WD胁迫过程中血浆谷草转氨酶和谷丙转氨酶活力有所上升而复苏后则明显下降(图4(A、B)),可能是因为急冷胁迫使得凡纳滨对虾肝胰腺组织受损,细胞膜通透性增加,使肝胰腺中的谷草转氨酶和谷丙转氨酶外流至血液中,这与CO2麻醉低温保活运输罗氏沼虾()血液生化指标变化结果一致[26]。酸性和碱性磷酸酶活力同样随着胁迫时间的延长而上升(图4(C、D)),史文竟等[27]研究环境水温对克氏原螯虾()血液相关酶活力的影响也发现类似结果。因此,鉴于酸性和碱性磷酸酶在免疫防御系统中起重要作用,双重胁迫下血浆ACP和AKP规律性变化有利于对虾适应环境胁迫。同时,肝胰腺组织结构变化进一步在组织化学层面证明,AC+WD双重胁迫对机体脏器结构造成了一定的损伤(图5)。综合上述血液生化指标中生理应激、物质代谢、肝胰腺相关酶活力水平和结构损伤情况,可以初步阐明无水保活流通过程中凡纳滨对虾响应AC+WD双重环境胁迫的生理应激和代谢调节规律(图6)。
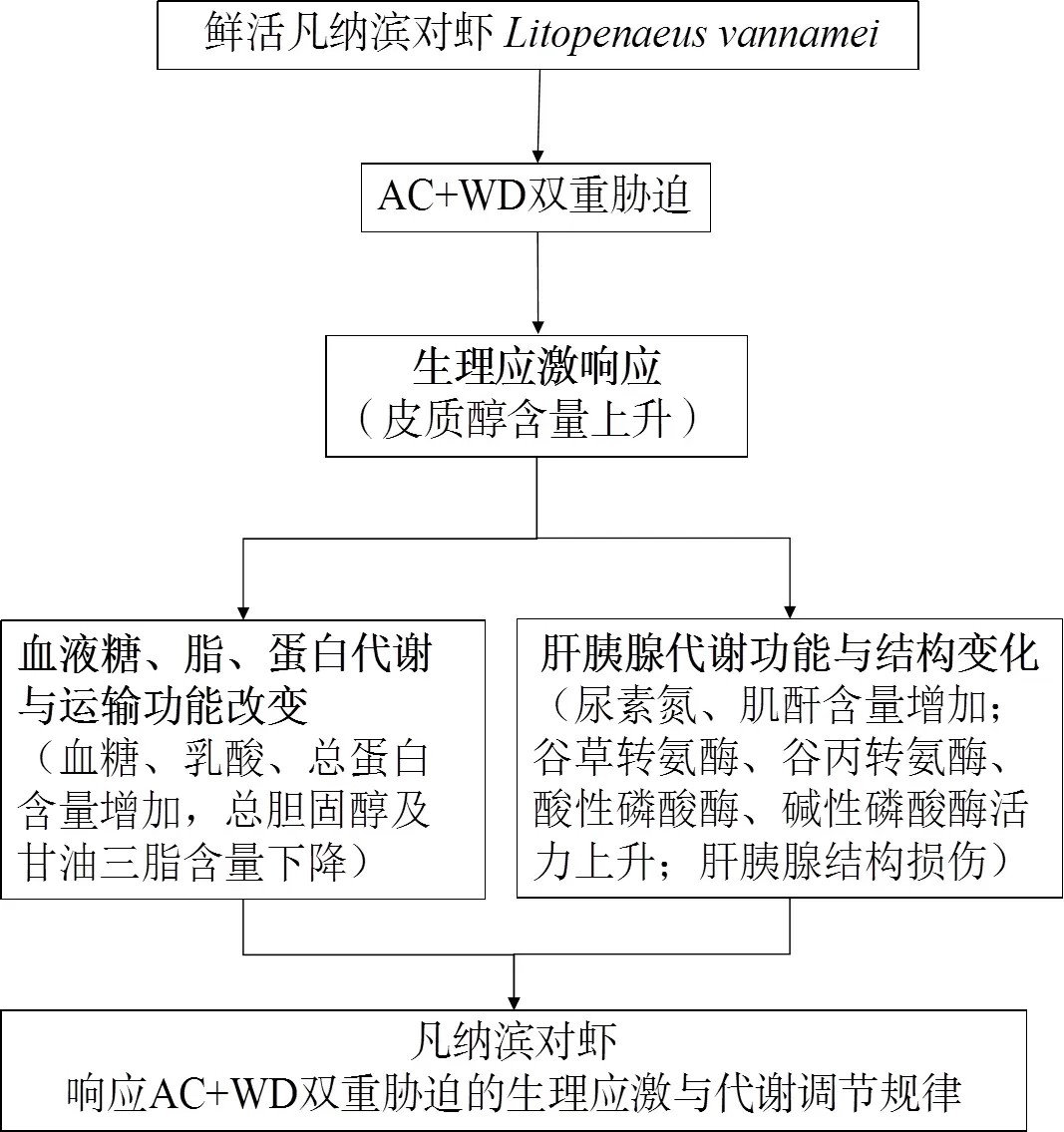
图6 AC+WD双重胁迫下凡纳滨对虾生理应激与代谢调节规律
4 结论
无水保活过程中AC+WD双重胁迫会对凡纳滨对虾造成明显的行为和生理应激,使糖、脂和蛋白质代谢加强,同时血液尿素氮和肌酐含量,以及谷草转氨酶和谷丙转氨酶活力显著上升,且肝胰腺组织出现规律性损伤。本研究整体揭示了无水保活流通环境下机体响应AC+WD胁迫的生理应激和代谢调节规律,为后续保活过程中的存活质量监控和保活流通参数调整提供了理论参考和实验依据。
[1] 何蓉, 谢晶. 水产品保活技术研究现状和进展[J]. 食品与机械, 2012, 28(5): 243-246.
[2] 孙宁. 罗氏沼虾活虾无水运输研究[J]. 海洋科学, 2009, 33(5): 41-46.
[3] SELYE H. Stress and the general adaptation syndrome[J]. British Medical Journal, 1950, 17(1): 1383 -1392.
[4] 杨丰, 吴涵, 王逸鑫, 等. 罗氏沼虾低温有水保活试验[J]. 湖南农业大学学报, 2020, 46(5): 601-607.
[5] 徐子涵. 凡纳滨对虾无水保活运输技术开发和关键装备研制[D]. 杭州: 浙江大学, 2018: 67-75.
[6] BAL A, PANDA F, PATIA S G, et al. Modulation of physiological oxidative stress and antioxidant status by abiotic factors especially salinity in aquatic organisms[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2021, 241, 108971.
[7] 王彩霞, 白婵, 李宁, 等. 不同降温速率休眠的加州鲈无水保活品质比较[J]. 现代食品科技, 2020, 36(5): 129-138.
[8] 陈文秀. 虾夷扇贝保活品质变化与贮藏条件调控技术研究[D]. 上海: 上海海洋大学, 2020: 40-45.
[9] 郝爽, 张敏. 不同冷胁迫方式对缢蛏无水保活期抗氧化酶活性及脂质过氧化的影响[J]. 大连海洋大学学报, 2020, 35(4): 584-590.
[10] 谢晶, 王琪. 水产动物保活运输中环境胁迫应激及生理调控机制的研究进展[J]. 食品科学, 2021, 42(1): 319-325.
[11] VERBERK C E P W, BUCHWALTER B D, KEFFORD J B. Energetics as a lens to understanding aquatic insect's responses to changing temperature, dissolved oxygen and salinity regimes[J]. Current Opinion in Insect Science, 2020, 41: 46-53.
[12] 徐德峰, 王雅玲, 孙力军, 等. 降温及生态冰温条件对凡纳滨对虾无水存活时间的影响[J]. 广东海洋大学学报, 2019, 39(6): 101-107.
[13] XU Z H, REGENSTEIN J M, XIE D, et al. The oxidative stress and antioxidant responses ofto low temperature and air exposure[J]. Fish & shellfish immunology, 2018, 72: 564-571.
[14] XU Z, GUAN W, XIE D, et al. Evaluation of immunological response in shrimpsubmitted to low temperature and air exposure[J]. Developmental & Comparative Immunology, 2019, 100: 103413.
[15] 潘鲁青, 李彦飞. 注射病原菌对凡纳滨对虾血蓝蛋白合成、酚氧化酶活力的影响[J]. 中国海洋大学学报(自然科学版), 2009, 39(5): 889-896.
[16] XU D F, YANG X Q, WANG Y L, et al. Cascading mechanism triggering the activation of polyphenol oxidase zymogen in shrimpafter postmortem and the correlation with melanosis development[J]. Food and Bioprocess Technology, 2020, 13(7): 1131-1145.
[17] 王梦洁, 储天琪, 刘峰, 等. 盐度胁迫对小黄鱼 () 抗氧化酶、非特异性免疫酶和Na+/K+-ATP酶活力的影响[J]. 海洋学报, 2021, 43(2): 59-66.
[18] ANUSHAA K D, JORGE M F., VISWANATH K. Acclimation of Zebrafish to transport stress[J]. Zebrafish, 2013, 10(1): 87-98.
[19] PICKERING A D, POTTINGER T G. Stress responses and disease resistance in salmonid fish: Effects of chronic elevation of plasma cortisol [J]. Fish Physiology and Biochemistry, 1989, 7(1-6): 253-258.
[20] 李亚娟, 王佳佳, 张才, 等. 海参酶解液对斑马鱼糖尿病并发抑郁样行为的改善作用[J]. 广东海洋大学学报, 2019, 39(1): 84-89.
[21] 梁敏, 吉宏武, 郝记明, 等. 凡纳滨对虾在二氧化碳麻醉无水保活过程中呼吸代谢及免疫的变化[J]. 食品工业科技, 2018, 39(4): 280-284.
[22] 张洪渊, 万海清. 生物化学[M]. 北京: 化学工业出版社, 2006: 35.
[23] 常玉梅, 曹鼎臣, 孙效文, 等. 低温胁迫对鲤血清生化指标的影响[J]. 水产学报, 2006, 19(2): 71-75.
[24] 冀德伟, 李明云, 王天柱, 等. 不同低温胁迫时间对大黄鱼血清生化指标的影响[J]. 水产科学, 2009, 28(1): 1-4.
[25] 黄建盛, 陆枝, 陈刚, 等. 急性低氧胁迫对军曹鱼大规格幼鱼血液生化指标的影响[J]. 海洋学报, 2019, 41(6): 76-84.
[26] 杨丰, 王逸鑫, 沈思远, 等. CO2麻醉处理对罗氏沼虾保活的影响[J]. 大连海洋大学学报, 2020, 35(6): 874-882.
[27] 史文竞. 温度影响下氨氮对克氏原螯虾血淋巴和鳃组织中免疫指标的影响[D]. 上海: 上海海洋大学, 2020: 35-38
Physiological Response and Metabolic Regulation ofExposed to Combination Stress of Acute Cold Exposure and Chronic Waterless Duration
XU De-feng, WU Jia-xin, SUN Li-jun, QIN Xiao-ming, FAN Xiu-ping
(////,524088,;,,116034,)
【Objective】To elucidate the physiological modulation mechanism ofin responseto a combination stress of acute cold exposure and chronic waterless duration during water-free transportation. 【Methods】Based on the simulation of transport practice, the changing profiles of typical biochemical indicators in hemolymph and hepatopancreas tissues were determined, and the histopathology injury was characterized. 【Results】The serum cortisol concentration significantly increased from the value of (326.90±4.61) pg/mL at AC group to (427.16±7.92) pg/mL at NC group (< 0.05), and the gradual decrease was observed at AC+WD groups. With the prolongation of combined stress of AC+WD, the glucose concentration reached the maximum of (26.31±1.05) mg/dL at 6 h in AC+WD group, while the maximum of lactic acid concentration (7.90±0.11) mmol/L was detected at 9 h (< 0.05). The concentrations of hemocyanin, urea nitrogen and creatinine in serum increased to some different degrees at AC and AC+WD groups. Although the concentration of total cholesterol and triglyceride decreased in a duration-dependent manner, the total protein concentration in serum elevated before 3 h and descend afterwards. The activities of aspartate aminotransferase, alanine aminotransferase, acid phosphatase and alkaline phosphatase in serum of shrimps elevated with the prolongation of combined stress and reached the maximum at 9 h. The above-detected at revived group exhibited regression towards the values at NC group. In addition, histopathological result suggested the impairment of hepatopancreas tissue during combined stress. Overall, these variations of biochemical indicators and histopathological impairment indicated that combined stress caused the disorder of substrate metabolism and induced the cytostructural degradation. 【Conclusion】Combined stress altered the physiology and substrate metabolism ofin a time dependent manner during waterless live transport and the obvious pathology injures in hepatopancreas tissue was observed, which consequently induced the mortality.
; waterless live transport; physiological stress; metabolic response; hepatopancreas
TS254.1
A
1673-9159(2022)01-0020-09
10.3969/j.issn.1673-9159.2022.01.004
徐德峰,吴嘉鑫,孙力军,等. 急冷与空气暴露联合胁迫对凡纳滨对虾生理代谢影响[J]. 广东海洋大学学报,2022,42(1):20-28.
2021-10-05
“十三五”国家重点研发计划重点专项(2019YFD0901601);国家自然科学基金面上项目(31772048);广东海洋大学自然科学基金项目(C16396)
徐德峰(1978―),男,教授,博士,研究方向为水产品保鲜保活与高值化利用。E-mail: 13827198525@163.com;
吴嘉鑫(1996―),女,硕士研究生,研究方向为对虾保活流通冷应激生理响应机制。E-mail:3336138343@qq.com
(责任编辑:刘朏)
