远志黄曲霉毒素检测及其贮藏过程中黄曲霉菌变化研究△
2021-12-26常晓茜姜丹王钧楠李婷任广喜米久金敏华国栋刘春生
常晓茜,姜丹,王钧楠,李婷,任广喜,米久,金敏,华国栋,刘春生*
1.北京中医药大学 中药学院,北京 102488;
2.西藏藏医药大学,西藏 拉萨 850000;
3.北京市中西医结合医院,北京 100039;
4.北京中医药大学 东直门医院,北京 100700
远志是远志科植物远志Polygala tenuifoliaWilld.或卵叶远志P.sibiriaL.的干燥根,性温,味辛、苦,归心、肾、脾经,具有安神益智、祛痰、消肿的功效[1]。在临床使用中,远志的需求量很大,是大宗中药材之一,始载于《神农本草经》[2],列为上品。然而,近年来远志的黄曲霉毒素(aflatoxins)超标问题直接影响了其临床使用的安全性。黄曲霉毒素是由黄曲霉(Aspergillus flavus)和寄生曲霉(A.parasiticus)等曲霉属真菌产生的次生代谢产物,具有致畸、致癌、致突变等作用,严重危害人体和动物的健康[3]。因此《中华人民共和国药典》(以下简称《中国药典》)2020 年版规定了黄曲霉毒素作为远志的检查项目[1],限度要求为黄曲霉毒素B1不得超过5 μg·kg-1;黄曲霉毒素总量[黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)]不得超过10 μg·kg-1。远志属于黄曲霉毒素检出率较高的药材,污染主要产生于远志的种植、采收、加工和贮藏等过程中[4]。
在远志的产地采收加工及运输贮藏过程中,极易由于操作不当使远志筒不能及时干燥,导致黄曲霉菌在筒内部繁殖,若储存过程中环境潮湿阴暗,则会加剧黄曲霉菌的繁殖,易造成黄曲霉毒素超标[5]。田洪岭等[6]发现,药农在采收远志后,为了防止其水分蒸发,常用封闭的塑料袋保存新鲜远志条,高温密闭易使远志药材表面滋生黄曲霉菌,进而导致黄曲霉毒素超标。本课题组通过调研得知,远志在北京临床应用比较广泛。本研究对12 批不同产地的远志进行黄曲霉毒素含量的测定,同时观察在北京贮藏过程中不同时间远志表面黄曲霉菌的变化,探究贮藏过程对远志表面黄曲霉菌的影响,以期为科学防控远志黄曲霉毒素污染提供参考。
1 材料
1.1 试药
12批远志药材,7批来自山西,其余5批分别来自河北、陕西、河南、内蒙古、贵州,经北京中医药大学刘春生教授鉴定为远志科植物远志Polygala tenuifoliaWilld.的干燥根,具体信息见表1。

表1 远志样品信息
真菌基因组DNA 快速提取试剂盒(批号:3621755)、2×TaqPCR MasterMix(批号:MT201-02)均购于北京博迈德科技发展有限公司;引物由生工生物工程(上海)有限公司合成;黄曲霉毒素混合对照品溶液(批号:610001-201703,中国食品药品检定研究院);甲醇、甲酸均为质谱级(美国Fisher 公司);色谱级甲醇(北京市通广精细化工公司);氯化钠(上海源叶生物科技有限公司)。
1.2 仪器
Xevo TQS Micro型超高效液相色谱串联四极杆质谱联用仪、ACQUITYUPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)均购自美国Waters 公司;YXQ-70A 型立式压力蒸汽灭菌器(上海博讯医疗有限公司);GL-88B 型涡旋振荡器(海门市斯林贝尔仪器制造有限公司);XSP-44X.9型显微镜(上海光学仪器一厂);3K15 型低温高速离心机(德国Sigma 公司);TProfessional Standard Gradient 96 型梯度聚合酶链式反应(PCR)热循环仪(德国耶拿分析仪器股份公司);FMB40 型雪花制冰机(上海比朗仪器有限公司);BG-gds AUTO520 型凝胶成像系统(南京华奥仪器有限公司);MM400 型混合球磨仪(上海弗尔德莱驰有限公司);JY-SP3型电泳槽(北京君意东方电泳设备有限公司);P2161E25 型免疫亲和柱(天津博纳艾杰尔科技有限公司)。
2 方法
2.1 远志表面黄曲霉菌的鉴定
2.1.1 黄曲霉菌株培养 马铃薯葡萄糖琼脂(PDA)培养基:取马铃薯200 g 洗净削皮,切成小块,加入去离子水1000 mL煎煮30 min,8层纱布滤过,加入无水葡萄糖20 g,琼脂18 g,搅拌溶解,115 ℃灭菌20 min后分装,备用。
将远志药材去除杂质后混匀,随机称取1 g放入无菌离心管中,加入无菌水10 mL,涡旋混匀15 min,超声15 min,充分混匀后取500 μL 均匀涂布在PDA培养基上,28 ℃避光培养7 d,采用菌丝顶端纯化法,挑取培养基中形态上与黄曲霉菌相似的菌落接种至新的PDA 培养基,28 ℃避光培养7 d,对获得的黄曲霉菌菌株进行形态、显微及DNA分子鉴定。
2.1.2 形态鉴定 根据《真菌鉴定手册》[7]进行真菌的形态特征鉴定。
2.1.3 显微鉴定 无菌接种环挑取少量真菌置于载玻片上,用适量乳酸酚棉蓝染色液滴至载玻片上,染色30 s后盖上盖玻片,置于显微镜下观察。
2.1.4 DNA 分子鉴定 用无菌接种环刮取培养基表面的真菌置于1.5 mL 离心管,加入液氮,使用球磨仪磨碎。参照真菌基因组DNA 快速提取试剂盒说明书提取菌落DNA。PCR 反应体系为DNA 模板1 μL、引物各1 μL、2×TaqPCR Master聚合酶15 μL、双蒸水12 μL,体系总体积30 μL。引物序列为ITS1:5′-AGAAGTCGTAAGGTTTCCGT-3′,ITS4:5′ -TCCTCCGCTTATTGATATGC-3′。反应程序为94 ℃预变性90 s,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,共30个循环,72 ℃延伸5 min。扩增产物经1.0%琼脂糖凝胶电泳分析,阳性结果送生工生物工程(上海)股份有限公司进行测序。采用ContigExpress 软件对测序得到的正反向序列进行拼接及人工校对。根据美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库进行BLAST 同源性搜索,选取同源性较高的模式菌株的内转录间隔区(ITS)序列,用DNAMAN进行相似度分析,采用MEGA 6.0软件构建临接(neighbor joining,NJ)树进行鉴定。
2.2 远志黄曲霉毒素测定
2.2.1 色谱条件 以十八烷基硅烷键合硅胶为填充剂;流动相为0.1%甲酸(A)-甲醇(B),梯度洗脱(0~0.5 min,90%A;0.5~6.0 min,90%~10%A;6~7 min,10%A;7~9 min,10%~90%A;9~10 min,90%A);柱温为40 ℃;流速为0.3 mL·min-1;进样量为2 μL。
2.2.2 质谱条件 以三重四级杆串联质谱仪检测;电喷雾离子源(ESI),采集模式为正离子模式;脱溶剂气温度为500 ℃;脱溶剂气流速为1000 L·min-1;毛细管电压为0.50 kV[8]。各化合物检测离子对和碰撞电压见表2。

表2 远志中黄曲霉毒素质谱分析参数
2.2.3 混合对照品溶液制备 精密量取黄曲霉毒素混合对照品溶液(AFB1、AFB2、AFG1和AFG2标示质量浓度分别为1.09、0.39、0.99、0.64 μg·mL-1)适量,用70%甲醇稀释成AFB2、AFG2质量浓度为0.38~160.00 ng·mL-1,AFB1、AFG1质量浓度为0.13~68.13 ng·mL-1的系列对照品溶液,即得。
2.2.4 供试品溶液的制备 远志供试品溶液的制备参照《中国药典》2020 年版黄曲霉毒素测定法(通则2351)进行。
2.2.5 样品测定 样品测定方法参考廖权丰等[7]的研究,分别精密吸取2.2.3 项下系列混合对照品溶液各2 μL,注入超高效液相色谱三重四级杆串联质谱仪,测定峰面积,以待测黄曲霉毒素定量离子色谱峰面积为纵坐标(Y),黄曲霉毒素质量浓度为横坐标(X),绘制标准曲线。精密吸取供试品溶液2 μL注入液相色谱仪,测定峰面积,计算AFB1、AFB2、AFG1、AFG2的含量。
2.3 不同时段远志表面黄曲霉菌的培养
将12 批不同产地的远志药材用牛皮纸袋包装,贮藏于北京市房山区良乡镇北京中医药大学中药学院,每个月按2.1项下的稀释平板法培养其表面的黄曲霉菌,每个实验组设置3个重复,分别记录北京2019年不同时间段(6―12月)远志表面的黄曲霉菌数量。
3 结果与分析
3.1 远志表面黄曲霉菌的鉴定
将远志表面的黄曲霉菌进行培养,其在PDA 平板上生长迅速,颜色由黄绿色变为黄色,可见黄色粉末,见图1。显微镜下可见分生孢子头呈疏松放射状,分生孢子梗由一根直立的菌丝形成,末端有近球状或球状膨大的顶囊,视野中可见大量球形或近球形的孢子,与文献报道一致[9]。该菌的PCR 产物在凝胶成像系统观察到条带清晰明亮,构建NJ树,见图2。综上结果表明,该菌与黄曲霉菌聚为一支,鉴定为黄曲霉菌(Aspergillus flavus)。

图1 远志表面真菌、黄曲霉菌的培养平板及显微观察

图2 远志中黄曲霉菌的NJ树
3.2 远志黄曲霉毒素污染情况
3.2.1 黄曲霉毒素的MRM 色谱图 AFB1、AFB2、AFG1、AFG2的多反应监测(MRM)色谱图见图3。

图3 远志中4个黄曲霉毒素的MRM色谱图
3.2.2 线性关系及检出限 黄曲霉毒素质量浓度与定量离子峰面积之间存在良好的线性关系,见表3。
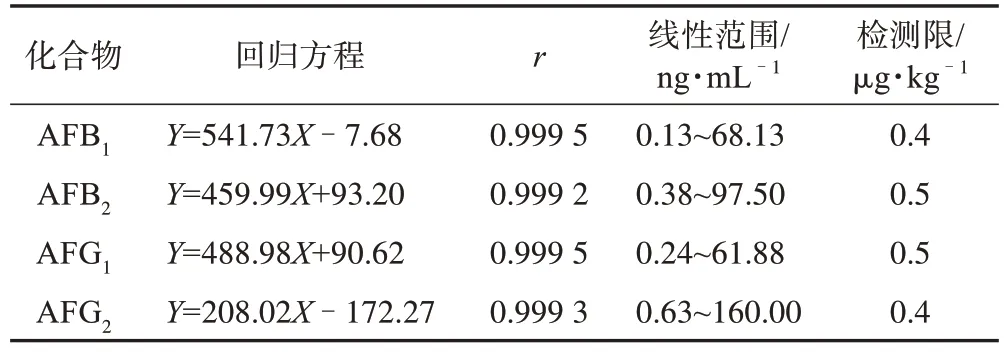
表3 远志中4个黄曲霉毒素的回归方程、相关系数
3.2.3 精密度试验 取黄曲霉毒素的混合对照品溶液,连续进样6 次,每次2 μL,分别计算AFB1、AFB2、AFG1、AFG2峰面积RSD 为0.97%、1.03%、0.88%、1.25%,表明仪器精密度好。
3.2.4 重复性试验 精密称取同一批次已知含量药材粉末6 份,按上述供试品制备方法制得供试品溶液,按色谱质谱条件检测,进样量为2 μL,依据回归方程计算黄曲霉毒素的含量,AFB1质量分数均值为3.29 μg·kg-1,RSD为1.02%。
3.2.5 加样回收率试验 取已知含量的药材粉末6份,精密称定,分别加入黄曲霉毒素混合对照品溶液,按上述供试品制备方法制得供试品溶液,按色谱质谱条件进样,进样量为2 μL,测得AFB1的加样回收率为89.3%,RSD 为2.78%、AFB2的加样回收率为84.9%,RSD 为1.98%;AFG1的加样回收率为83.1%,RSD 为2.43%;AFG2的加样回收率为85.3%,RSD为2.83%。
3.2.6 远志黄曲霉毒素污染情况 在12 批不同产地的远志中均检出AFB1,检出质量分数为0.75~7.77 μg·kg-1,其中1 批样品(河北邢台)还检测出AFG1,检出质量分数为10.60 μg·kg-1,AFB2和AFG2均未检出。4 批(山西运城2 批,河北邢台、河南洛阳各1 批)远志的AFB1含量超过《中国药典》2020年版限量标准,其中1批样品(河北邢台)的AFB1和黄曲霉毒素总量均超过《中国药典》2020年版限量标准,具体结果见表4。

表4 不同产地远志表面黄曲霉毒素质量分数 μg·kg-1
3.3 远志表面的黄曲霉菌随贮藏时间变化情况
12 批不同产地的远志表面均分离到黄曲霉菌,黄曲霉菌污染率为100%,见图4。其中7―9 月远志表面的黄曲霉菌数量最多,6 月与10 月远志表面的黄曲霉菌数量最少,见表5。

表5 不同贮藏时间远志表面的黄曲霉菌数量 CFU·g-1

图4 不同贮藏时间远志表面的真菌
北京2019 年6―12 月的温湿度与远志表面黄曲霉菌数量的变化情况如图5 所示,远志药材储存地点的温湿度条件与外界环境一致。

图5 北京2019年6—12月温、湿度与远志表面黄曲霉菌数量变化
4 讨论
2017—2018 年全国药品质量专项抽检公告[10]的共计21 批远志样品中,黄曲霉毒素含量不合格率高达90.5%,严重影响了远志的临床使用。本研究采用UPLC-MS/MS 检测了12 批不同产地的远志中AFB1、AFB2、AFG1、AFG2的含量,结果发现,12批远志的黄曲霉毒素污染率为100%,按照《中国药典》2020 年版远志项下的规定,33.3%的样品超过了AFB1和黄曲霉毒素总量限量标准。其中,山西省运城市闻喜县作为远志的道地产区,在测定的7 批药材中有2 批AFB1含量超标,以上结果更进一步说明了远志黄曲霉毒素污染问题的严重性。
远志的采收及加工过程中容易因干燥不及时而滋生黄曲霉菌[11]。张西梅等[12]研究发现,田间生产和采收加工都有可能造成远志黄曲霉毒素污染,而贮藏过程对其变化的影响尚不明确。因此本实验研究了北京不同时间的贮藏过程对远志表面黄曲霉菌的影响。分析发现,6—9 月北京的温度、湿度都处于较高的状态,远志表面的黄曲霉菌数量最多;11、12 月温、湿度最低,远志表面黄曲霉菌的数量处于较低的水平。徐圆程等[13]利用高通量测序技术分析贮藏稻谷中的群落结构,指出不同贮藏条件下稻谷真菌群落多样性存在差异,优势菌属发生变化。本研究中,10 月远志表面的黄曲霉菌数量最少,之后有所回升。推测可能是由于季节变换,气温骤降,优势菌群快速生长,不利于黄曲霉菌的生长所致,后期需进一步扩大样本量,探究不同贮藏条件下远志表面菌群的群落结构与优势菌属。调查结果为制定合理的远志贮藏条件提供了一定的参考。特别是在炎热闷热的夏季,远志贮藏应保持通风的条件。本实验采用UPLC-MS/MS测定了12批不同产地远志黄曲霉菌的污染情况,并对北京不同时间下远志表面的黄曲霉菌生长情况进行研究,后续将进一步考察具体的贮藏条件对远志黄曲霉毒素含量的影响,深入研究远志黄曲霉毒素污染问题。
