PEG介导黄曲霉菌的遗传转化体系*
2019-12-26江银辉杨碧吴昌学周建奖
江银辉,杨碧,吴昌学,周建奖
(贵州医科大学 地方病与少数民族疾病教育部重点实验室,贵州省医学分子生物学重点实验室,贵州医科大学 分子生物学重点实验室,贵州 贵阳 550004)
黄曲霉菌(aspergillusflavus,A.flavus)是人类的条件致病菌。对于免疫力低下的人群,黄曲霉菌感染会引起侵袭性曲霉病,造成皮肤、角膜、呼吸系统、循环系统和神经系统的疾病[1]。黄曲霉菌也可引起哺乳动物和鸟类的曲霉病,同时黄曲霉菌侵染多种重要的经济作物、引起田间病害,又可以严重危害储藏过程中的粮食,造成重大的经济损失[2-3]。此外,黄曲霉菌在生长过程中产生大量的次级代谢产物黄曲霉毒素(aflatoxin),该毒素是一种具有强烈致癌、致畸作用的微生物毒素,它对粮食、饲料等农产品的污染会严重危害人类和动物的健康[4-5]。自从 1961 年发现黄曲霉毒素以来,已确定的黄曲霉毒素有12种以上,均为二呋喃香豆素(difuranocoum)的衍生物[6]。目前临床上对黄曲霉菌感染的治疗主要依赖抗真菌药物,如两性霉素B、伊曲康唑、伏立康唑及米卡芬净等[7-8],但化学药物容易引起A.flavus的耐药性;且由于真菌和人体细胞都为真核细胞,所以真菌抗生素类药物毒性大、副作用强[9]。对黄曲霉菌的功能基因进行研究,能够更好的阐明其致病和产毒的分子机理,为控制黄曲霉菌的危害具有重要意义[10]。黄曲霉菌遗传转化体系的构建是从分子水平研究黄曲霉菌功能基因的重要工具[11],本实验主要目的是采用聚乙二醇(polyethylene glycol,PEG)介导的方法对黄曲霉菌进行遗传转化,为研究黄曲霉菌的分子水平研究提供了技术基础。
1 材料与方法
1.1 材料
1.1.1菌株和质粒 黄曲霉菌株LD-F由贵州医科大学附院呼吸科病房空气中分离得到,pPTRI质粒购自Takara(大连)有限公司。
1.1.2试剂 蜗牛酶和纤维素酶为索莱宝(Solarbio)产品,溶壁酶为、潮霉素B(hygromycin B,Hyg)、新霉素(G418)和嘧啶磺胺素(pyrithiamine,PT)3种抗生素均为西格玛(sigma)产品。其他试剂均为国产分析纯。溶液1 ∶0.6 mmol/L 氯化钾(KCl),50 mmol/L氯化钙(CaCl2),10 mmol/L三(羟甲基)氨基甲烷(Tris-HCl)(pH 8.0);溶液2 ∶40% (W/V) 聚二乙醇4000(PEG4000),0.6 mmol/L KCl,50 mmol/LCaC12,10 mmol/L Tris-HC1(pH 8.0)。
1.1.3培养基 马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA):马铃薯200 g,葡萄糖20 g,琼脂粉13 g,蒸馏水加至体积1 000 mL,121 ℃灭菌20 min。察氏培养基(Czapek Agar, CZ):硝酸钠3 g,磷酸氢二钾1 g,七水硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,琼脂13 g,蒸馏水加至体积1 000 mL,121 ℃灭菌20 min。原生体质再生培养基:含1 mol/L氯化钠的CZ培养基。
1.2 方法
1.2.1黄曲霉菌对抗生素的敏感实验 将活化的黄曲霉菌分别接种到含有0、50、100、200和400 mg/L Hyg抗生素的CD培养基上,30 ℃培养3 d后观察菌落生长情况,确定Hyg对黄曲霉菌生长的最小抑制浓度;将活化的黄曲霉菌分别接种到含有0、100、200、400和800 mg/L G418抗生素的CD培养基上,30 ℃培养3 d后观察菌落生长情况,确定Hyg对黄曲霉菌生长的最小抑制浓度;将活化的黄曲霉菌分别接种到含有0、0.05、0.1和0.2 mg/L PT抗生素的CD培养基上,30 ℃培养3 d后观察菌落生长情况,确定Hyg对黄曲霉菌生长的最小抑制浓度。
1.2.2黄曲霉菌原生质体制备及转化 接种黄曲霉菌孢子悬浮液于100 mL的CD液体培养基中,用三角培养瓶,30 ℃振荡培养12 h。用灭菌的擦镜纸过滤收集菌丝,无菌水清洗菌丝1次,用灭菌的0.8 mmol 氯化钠清洗1~2次,收集菌丝。用20 mL 0.8 mmol 氯化钠,10 mmol磷酸钠(pH6.0)配制酶解液(1%溶壁酶+1%纤维素酶+1%蜗牛酶),酶液充分溶解后,于10 000 r/min,4 ℃离心10 min,取上清用细菌过滤器抽提2次除菌。将收集的菌丝与酶液混合均匀,置于30 ℃,30 r/min振荡培养。每30 min用显微镜确认状态,2 h内完成反应。待原生质体释放达到足够的量时,于6 000 r/min,4 ℃,离心10 min。冰上收集沉淀,用0.8 mmol 氯化钠清洗原生质体2次,最后用溶液1悬浮原生质体。制得的原生质体中加入10%二甲基亚砜,混匀后分装到灭菌的EP管中,并于-80 ℃保存备用。取制备好的原生质体160 μL置于冰上,然后加入40 μL溶液2,充分悬浮混匀,然后加入20 μg质粒(体积不超过20 μL),冰中静置30 min,加入1 mL溶液2,轻轻悬浮,室温静置20 min,原生质体悬浮液与5 mL选择性再生培养基(0.2 mg/L PT)混合。快速将原生质体/软琼脂平铺到选择性再生培养基平板上30 ℃培养5~7 d。将得到的转化子在选择性CD培养基(0.2 mg/L PT)上连续转代5次得到稳定转化子。
1.2.3转化子的鉴定 采用CTAB法提取转化子的基因组DNA,根据ptrA的序列设计特异引物,上游引物(ptr-k)为5′-GGTACCCAGACGGGCAATTGATTACG-3′,下游引物(ptr-s)为5′-GAGCTCAGCCGCTCTTGCATCTTTG-3′,分别以稳定转化子和出发菌株LD-F的基因组DNA为模板进行聚合酶链反应(polymerase chain reaction,PCR)扩增检测。PCR反应体系:总体积20 μL,其中10×PCR buffer(含Mg2+)2 μL,2.0 mmolol/L dNTP 2 μL,上下游引物(10 μmol/L)各1 μL,50 μg/L模板基因组DNA 1 μL,Taq酶(5 mol/L)0.2 μL,无菌双蒸水12.8 μL。扩增反应条件:94 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 5 min。PCR产物于1%的琼脂糖凝胶电泳检测。
2 结果
2.1 黄曲霉菌对Hyg、G418和PT抗生素的敏感性
在含有不同浓度Hyg和G418的培养基上,黄曲霉菌均能正常生长,黄曲霉菌株LD-F对Hyg和G418不敏感。PT的敏感性实验表明,当PT的浓度达到0.2 mg/L时,可以完全抑制黄曲霉菌的菌丝生长,因此PT抗生素可以作为黄曲霉菌遗传转化的抗性筛选标记,最小抑制浓度为0.2 mg/L。见图1。
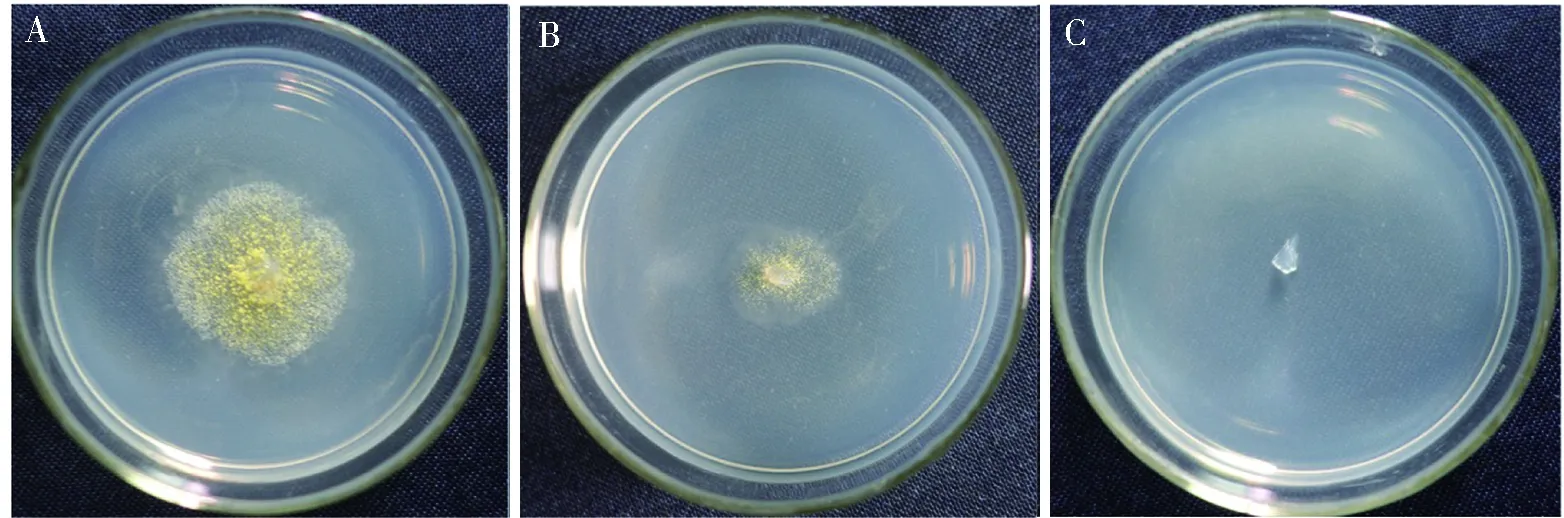
注:A、B、C PT浓度分别为0.05、0.1及0.2 mg/L。图1 不同浓度PT培养基对黄曲霉菌株LD-F的抑制情况Fig.1 Inhibition of LD-F of Aspergillus flavus by PT medium with different concentration
2.2 黄曲霉菌原生质体形态
酶解反应完成后,大部分菌丝已经酶解形成断片原生质体、从破碎的菌丝中流出呈圆球状,在显微镜下能够清晰观察到黄曲霉菌丝体酶解后形成椭圆型的原生质和一些未酶解的菌丝体。见图2A。
2.3 黄曲霉菌稳定转化子的筛选及鉴定
将质粒pPTRI(图2B)通过PEG介导的方法转入黄曲霉菌株LD-F的原生质体后,选择性再生培养基(含0.2 mg/L PT)平板上成功长出转化子,转化效率为13个/μg左右(图2C)。经过选择性CD培养基(含0.2 mg/L PT)的5次筛选,实验得到稳定的黄曲霉菌转化子。PCR检测结果表明,黄曲霉菌转化子的基因组中能够扩增得到ptrA基因片段,片段大小为2.0 kbp(图3),表明PT抗性基因ptrA已经成功插入黄曲霉菌株的基因组中。
3 讨论
转化子的抗性筛选是遗传转体系构建的前提条件,而目前真核生物常见的遗传转化筛选标记为Hyg和G418[12-13]。本研究发现黄曲霉菌对Hyg和G418不敏感,但是0.2 mg/L的嘧啶磺胺素能够完全抑制黄曲霉菌的菌丝生长,因此本研究选取嘧啶磺胺素作为黄曲霉菌转化子的筛选标记。PT的抗性基因ptrA是从具有PT抗性的米曲霉突变株基因组DNA文库中克隆获得,目前已经应用在米曲霉的遗传转化的抗性标记[14-15]。
随着分子生物学技术的快速发展,其核心重组DNA技术已经广泛用于分离和解析真菌的功能基因,并为研究真菌的分子水平调控提供了一个强有力的工具。目前主要应用于丝状真菌的遗传转化方法有PEG介导原生质体遗传转化法、电穿孔法、限制性内切酶介导转化法及根癌农杆菌介导真菌转化法等[16-18]。其中,PEG介导原生质体遗传转化方法的前提是要制备丝状真菌的原生质体,因此高效的制备原生质体是成功进行丝状真菌转化的关键和前提[19-20]。本研究显示,以鲜嫩的黄曲霉菌丝为材料,酶浓度组合为1%溶壁酶+1%纤维素酶+1%蜗牛酶,30 ℃酶解2 h可获得大量原生质体。通过PEG介导质粒pPTRI转化黄曲霉菌原生质体,转化效率达到13个/μg左右。转代筛选和PCR检测也表明,抗性基因ptrA已经整合黄曲霉菌基因组DNA,并稳定表达。

注:A黄曲霉菌原生质体,B携带ptrA的质粒pPTRI,C吡啶硫胺抗性的黄曲霉菌转化子。图2 原生质体介导黄曲霉菌的遗传转化体系Fig.2 Genetic Transformation system of Aspergillus flavus mediated by protoplasts

注:M为DL2000 DNAmarker,1~5为黄曲霉菌转化子,6为质粒pPTRI,7为菌株LD-F。图3 黄曲霉菌转化子PCR分析Fig.3 PCR Analysis of Transformants of Aspergillus flavus
综上所述,本研究用PEG介导原生质体遗传转化方法具有操作简单,阳性转化率高,获得的遗传转化子性状稳定等特点,为研究黄曲霉菌的功能基因提供技术基础。
