白及纯化物/氧化魔芋葡甘聚糖胃漂浮片的制备优化与评价
2021-12-15李光英龙晓燕张普香唐志康
李光英 龙晓燕 许 德 严 全 张普香 唐志康
(西南科技大学生命科学与工程学院 四川绵阳 621010)
胃滞留制剂给药后滞留在胃中,能更有效地治疗幽门螺杆菌和溃疡[1]。盐酸环丙沙星主要在上消化道吸收,口服后从胃滞留制剂中释放,增加药物在胃中的滞留时间可以增加药物的吸收窗,降低患者的用药剂量及抗生素耐药性[2]。
胃滞留给药系统很大程度取决于凝胶载体材料的结构与性能。魔芋葡甘聚糖(KGM)是魔芋块茎中提取的高分子水溶性多糖,作为药物载体材料已有报道[3]。KGM由于分子量大直接运用在载体材料上有限制,因此将KGM进行改性可拓宽其应用范围。课题组前期研究发现,通过H2O2改性得到的氧化魔芋葡甘聚糖(OKGM)胃漂浮骨架片,其浓度低于10% 时,漂浮时间<12 h;浓度超过10% 时,漂浮时间长达24 h,但24 h累积释药率小于90% 不能完全释药 ,释药性能在漂浮时间内有待提高[4]。白及葡甘聚糖(BSP,BletillaStriatapolysaccharide)为中药白及糊化淀粉的主要成分,结构和KGM相似,是由葡萄糖和甘露糖形成的杂多糖,具有治疗口腔溃疡和胃溃疡等消化系统疾病[5]的功效。Kurt等[6]用不同浓度乙醇纯化兰科植物Salep中的葡甘聚糖,从而改善了Salep的纯度和流变性能。多糖物理共混的协同作用已有很多报道,李斌[7]综述了KGM与黄原胶、卡拉胶等物理共混用于弥补单一材料的不足。
在本文中,将两种结构相似的多糖物理共混,得到新三维空间结构的药用材料,即白及纯化物/氧化魔芋葡甘聚糖复合凝胶载体材料,这种新材料运用于胃滞留给药缓释系统鲜见报道。其优势有:第一,新三维空间的存在可能会产生一个扩展的扩散路径,这可能会改变释放特性;第二,提高了BSP在胃内的稳定性;第三,利用BSP具有伤口愈合、止血和抗菌的生物活性,实现BSP 的“药辅合一”性。
1 实验部分
1.1 试剂与仪器
白及中药饮片,批号:190523,绵阳正和祥药业有限公司;氧化魔芋葡甘聚糖(OKGM,实验室自制,批号:20191108,制备方法见课题组前期发表文献[3]);无水乙醇、浓盐酸、氢氧化钠,成都市科龙化工试剂厂;盐酸环丙沙星一水合物(纯度>99%),郑州阿尔法化工有限公司;3,5-二硝基水杨酸,国药集团化学试剂有限公司。
HAAKE MARS II型旋转流变仪,德国Thermo公司;UV-8000S型紫外可见分光光度计,上海元析仪器有限公司;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司;RR22GIII 高速冷冻离心机,日立公司;HX-200 型高速中药粉碎机,浙江永康市溪岸五金药具厂;ZRS-8G溶出度测试仪,天津市新天光分析仪器技术有限公司;Nicolet-6700红外光谱仪,美国尼高力仪器公司;TM-300扫描电子显微镜(SEM),德国蔡司仪器公司;SBC7620型溅金仪,英国Emitech;HELEOSII 型多角度激光光散射-凝胶渗透色谱系统,美国Wyatt技术公司。
1.2 方法
1.2.1 白及纯化物的制备及其葡甘聚糖含量测定
将白及饮片粉碎,过80目筛,取筛下白及粉(BSF)5 g,按料液比(m/V,g·mL-1)1∶10分别加入到体积分数为30%,40%,50%,60%,70%,80%的乙醇溶液中,在室温下用磁力搅拌器以350 r/min的搅拌速度搅拌洗涤4 h后,离心,取沉淀于45 ℃ 干燥24 h后,得不同白及纯化物(BSF)。分别编号为BSF30,BSF40,BSF50,BSF60,BSF70,BSF80。BSF的葡甘聚糖含量测定采用3,5-二硝基水杨酸法[6]。
1.2.2 白及纯化物/氧化魔芋葡甘聚糖-盐酸环丙沙星胃漂浮片(BGCTs)的制备
分别称取BSF70粉末、OKGM粉末和OKGM/BSF70混合物粉末2.5 g,加入20 mg/mL的盐酸环丙沙星水溶液,形成质量分数为10% 的BSF70, OKGM以及OKGM/BSF70盐酸环丙沙星分散体,搅拌混匀,分别置于模具中,静置2 h。-70 ℃ 温度预冻4 h后,真空冷冻干燥24 h,即得BGCTs(注:此药片与药剂学上严格意义的药片不同,前者通过冷冻干燥法获得多孔网络结构制备得到胃漂浮凝胶片,而后者主要采用压片法制备),其制备流程示意图见图1。
1.3 结构表征与性能测试
1.3.1 白及纯化物流变学测试
将不同浓度乙醇纯化所得白及纯化物置于80 ℃ 的纯水中,制备成2%(m/V)浓度的水溶液,均匀搅拌2 h后,冷却到室温进行流变曲线测试。测试条件如下:锥板(Ti60, 1°,直径60 mm)测试,间距为0.052 mm,测量温度为25.0±0.05 ℃,每次测试重复3次,剪切速率为1~1 000 s-1[8]。
1.3.2 凝胶渗透色谱(GPC)分析
分别称量适量OKGM和BSF70粉末,加入10 mL流动相(0.01% NaNO3和0.02% NaN3混合液),强力搅拌45 min混匀,用0.45 μm微孔滤膜过滤,收集滤液。精密吸取滤液10 μL,注入多角度激光光散射-凝胶渗透色谱系统(λ=609 nm,T=35 ℃),测试OKGM和BSF70的绝对分子量及分子量分布。色谱条件如下:流动相:0.01% NaNO3和 0.02% NaN3混合液;流速:0.5 mL/min;色谱柱:SEC Start-up Kit, 300 mm×7.5 mm, dn/dc值为0.140 2。
1.3.3 BGCTs漂浮性能测试
采用体外漂浮法测试BGCTs的漂浮性能:取BSF70粉末、OKGM粉末和OKGM/BSF70混合物粉末制备得到的BGCTs片,置于含有50 mL 的模拟胃液的纳氏比色管中。药片浮出水面所需的时间定义为起漂时间,药片漂浮的总时间定义为续漂时间[9]。
1.3.4 BGCTs的释药性能测试
BGCTs中盐酸环丙沙星在模拟胃液中的释放测试采用紫外分光光度法结合《中国药典》溶出度测定第二法[3, 10]。以500 mL 0.1 mol/L盐酸溶液为溶出介质, 转速为100 r/min,温度为37 ℃,在1,2,3,4,6,8,10和12 h取样1 mL(同时补加1 mL等温模拟胃液),用0.45 μm微孔滤膜过滤测定吸光度,计算药物累积释放率(Accumulate rate, AC);同时采用综合评分法(F)评价BGCTs的释药性,F按公式(1)计算[11]:
F=|Q2-20%|+|Q6-50%|+|Q12-90%|
(1)
式中:Q2,Q6,Q12分别为2,6,12 h盐酸环丙沙星的累积释放率,其标准分别设为20%,50%,90%,F值越小,缓释效果越好。
1.3.5 BGCTs溶胀性和溶蚀性
取OKGM/BSF70混合物粉末制备得到BGCTs片(称定质量,记为w0),置于溶出杯中,加入500 mL 模拟胃液,在溶出度测试仪(转速100 r/min,温度37 ℃)中进行处理,间隔一定时间后,取出BGCTs,吸去多余水分,直接称定BGCTs质量,记为w1;将溶胀和溶蚀处理后的BGCTs样品干燥至恒重,再次称定BGCTs质量,记为w2[9]。 按公式(2)和公式(3)计算BGCTs溶胀率和溶蚀率。
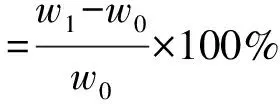
(2)
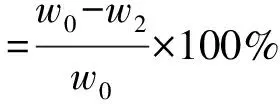
(3)
1.3.6 载药材料孔隙率测定
(4)
式中:ρ为乙醇密度(g/cm3)。
1.3.7 扫描电镜(SEM)分析
取供试样品少许分散在测试台上,用导电胶带固定,溅金180 s后,采用扫描电子显微镜观察其表面形貌,加速电压为15 kV。
2 结果与讨论
2.1 乙醇浓度对白及纯化物中多糖含量的影响
不同浓度乙醇(乙醇浓度为体积分数,下同)对白及纯化物的影响结果如表1所示。BSF30中白及葡甘聚糖的质量分数从原料中的39.50% 显著性增加到48.75%(p<0.05)。白及葡甘聚糖是白及止血、伤口愈合的主要活性成分[13-14],故其含量会成为评价白及纯化物质量的重要参数。结果表明乙醇处理白及提高了白及纯化物的质量。有学者将魔芋粉用40%乙醇在78 ℃ 洗涤4 h,葡甘聚糖质量分数从74% 提高到89%[15]。随着乙醇浓度从30%增加到80%,白及葡甘聚糖含量呈现先增加后降低的趋势。当乙醇浓度为70% 时,白及葡甘聚糖质量分数最高为84.88%。低于70%的乙醇浓度,白及葡甘聚糖向上清液相扩散,从而导致溶液黏度增加(通过白及纯化物流变学试验也可以观察到),这是由于溶液的介电常数增加,有利于白及葡甘聚糖溶解。乙醇浓度越高,溶液的介电常数越低,白及葡甘聚糖分子的溶解度也越低。另一方面,白及中杂质的溶解度与乙醇浓度成反比,在乙醇浓度70% 时达到最高水平,BSF70的白及葡甘聚糖含量比原料提高了1.15倍。故后续采用BSF70作为制备BGCTs的载体材料。
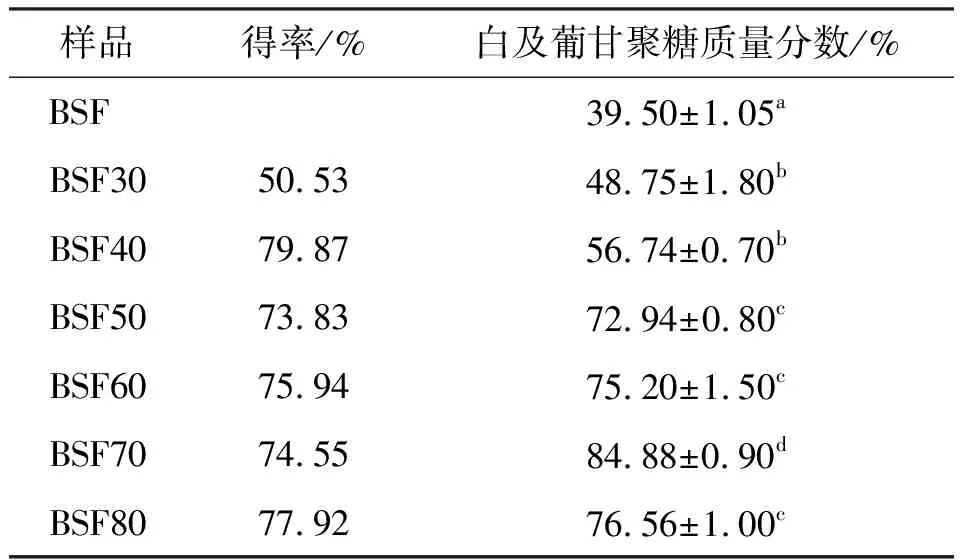
表1 乙醇浓度对白及葡甘聚糖含量的影响Table 1 Effect of ethanol concentration on Bletillae glucomannan polysaccharide content
2.2 乙醇浓度对白及纯化物流变学的影响
不同浓度乙醇纯化白及后,白及纯化物的剪切应力与剪切速率的关系如图2所示。随着剪切速率的增加,白及纯化物的剪切应力变大,呈现剪切变稀的现象,即假塑性流体的特性。在相同的剪切速率下,BSF70需要更高的应力。剪切应力的增加是白及葡甘聚糖分子间相互作用增强的结果,这和BSF70的白及葡甘聚糖含量高的结果相一致。
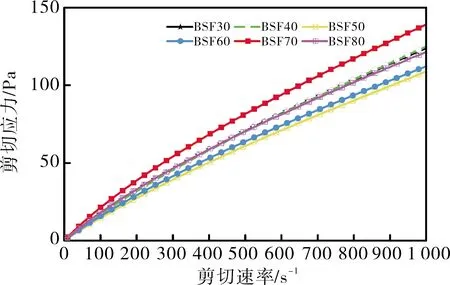
图2 不同乙醇浓度对白及纯化物溶液稳态剪切的影响Fig.2 Effects of different concentration of ethanol on rheological characteristics of purification Bletilla striata
对白及纯化物流动曲线采用幂律方程拟合[16]:
(5)
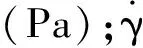
左幅7-1#、7-4#和右幅7-3#已完成桩基浇筑,孔内未发现宏观裂隙发育。左幅7-2#和右幅7-1#桩基孔尚未开挖。
黏度也是评价中药白及质量的重要参数[4]。用拟合模型得到的表观黏度(η100,此处剪切应力为100 s-1)见表2。高分子溶液黏度是分子间作用力及其相互作用的结果。白及葡甘露聚糖链间的相互作用经不同乙醇浓度纯化后有所增强。乙醇纯化处理魔芋精粉也可以提高魔芋精粉中葡甘聚糖的含量,从而提高魔芋精粉的纯度[15]。BSF溶液的κ值和n值对纯化过程有很强的依赖性。BSF70的稠度系数最大,n值偏离1最远,BSF70溶液表观黏度最高。由于BSF70多糖含量最大,白及葡甘聚糖在相对拥挤的空间内其分子链的运动变得困难,内摩擦力增大,致使表观黏度加大。
2.3 BGCTs胃漂浮性能
胃漂浮片漂浮能力会影响其在胃液中的滞留时间,从而影响胃漂浮制剂的性能。OKGM和BSF70以不同质量比共混制备BGCTs,将BGCTs静置于模拟胃液中,观察其漂浮性能。实验结果表明不同BSF70含量的BGCTs片均能立即起漂,添加质量分数20%~80% BSF70可保持BGCTs片的漂浮能力,尽管所有的BGCTs片的静置续漂时间都超过 6 h,但随着静置时间的延长,BGCTs中OKGM和BSF70逐渐溶蚀,导致BSF70含量高的BGCTs的静置续漂时间降低。当OKGM与BSF70质量比为8∶2时,续漂时间超过 12 h。当BSF70质量分数为100%时,BGCTs静置于模拟胃液中的续漂时间因BSF70的溶蚀而不能维持到12 h,从而不能持续观察到其漂浮现象。单独使用BSF70制备得到的胃漂浮制剂,均不能形成有实际应用价值的胃漂浮片,而只有OKGM的胃漂浮片在静置续漂过程中溶胀慢,从而使盐酸环丙沙星从胃漂浮片中释放不完全[3],需将OKGM和BSF70共混,从而改善OKGM的释药性能。
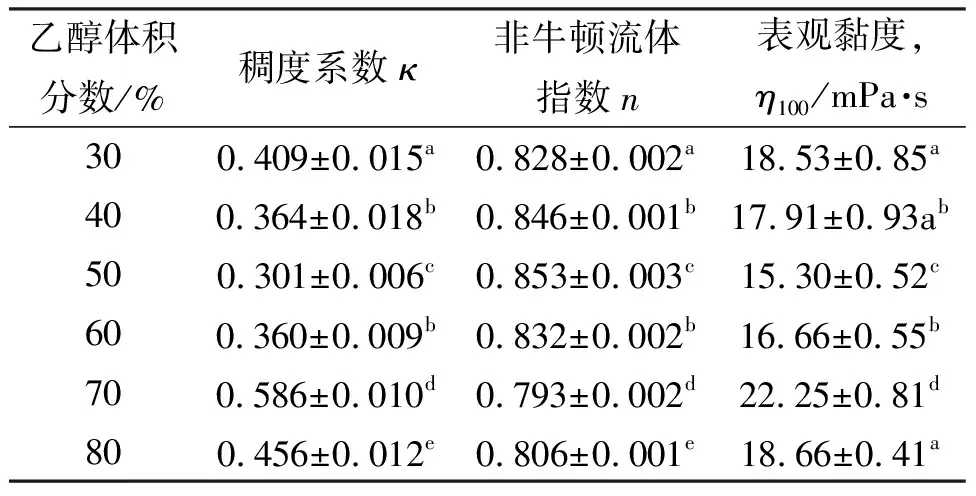
表2 白及纯化物非牛顿流体参数Table 2 Parameters of non-Newtonian fluid of purification Bletilla striata sol
2.4 BGCTs在模拟胃液中的溶蚀性能和溶胀性能
OKGM和BSF70以不同质量比共混,制备得到的胃漂浮片的溶蚀性能结果如图3所示。OKGM和BSF70按不同质量比共混制备得到的BGCTs,比仅有BSF70的配方溶蚀率有所降低,在模拟胃液中全溶蚀的时间更长,当BSF70质量分数达20% 以上时,BGCTs溶蚀过快,尤其是当BSF70质量分数达80% 时,制备得到的胃漂浮片在6 h内溶蚀率为100%,故不能形成有实际应用价值的胃漂浮片。当BSF70质量分数为20%时制备得到的胃漂浮片,4 h的溶蚀率(42.2%±2.64%)显著性高于BSF70质量分数为0%的溶蚀率(33.7%±0.06%)(p<0.05),随着溶蚀时间延长到6~8 h时,溶蚀率逐渐和不含BSF70的溶蚀率相等;8 h后,溶蚀率反而比不含BSF70的溶蚀率低。实验结果表明,OKGM与BSF70以质量比8∶2共混制备的BGCTs片剂在酸性介质中其完整性可以合适地保持,适合于胃漂浮片的制备及应用。

图3 BGCTs 的溶蚀性能Fig.3 Corrosion characteristics of BGCTs in simulated gastric solution
胃漂浮片的溶胀能力和续漂能力都会影响胃漂浮制剂的性能,因为一旦药片膨胀到无法通过胃幽门的大小,溶胀持续一段时间,就会导致胃潴留时间延长,因此溶胀能力也会受到BGCTs片剂在模拟胃液中的滞留时间的影响[7]。为了证实溶胀性与溶蚀性与BSF70的比例有关,将OKGM和BSF70以不同质量比共混制备得到胃漂浮片,测定其在模拟胃液中的溶胀性能,结果如图4所示。结果表明,当BSF70的量增加时,溶胀率随着BSF70比例的增加而下降。OKGM的加入增加了模拟胃液中的溶胀率,这是由于OKGM分子量增加所致。当OKGM质量分数小于20% 时,分子内聚力不足以抵消溶蚀,从而形成蓬松、易碎的凝胶体。因此,由OKGM和BSF70以质量比2∶8共混制备的BGCTs片剂在模拟胃液中只能维持 8 h。当BGCTs片剂在模拟胃液中进行试验时,每种含有BSF70的BGCTs片剂在模拟胃液中的溶胀率随着时间的增加而降低,这是由于BGCTs片剂在模拟胃液中的溶胀和溶蚀同时进行所致,仅含OKGM的片剂虽然在模拟胃液中也同时经历溶胀和溶蚀,但在2 h内溶胀率增加(图4曲线a),OKGM胃漂浮片的溶胀率从789%增加到889%,然后随着时间的增加而降低,可能是OKGM在片剂水合过程中片剂孔隙中的空气被截留,在凝胶基质中形成气泡。这些被捕获的气泡形成了一个松散而脆弱的结构,这解释了为什么仅含OKGM的片剂在 2 h 内尽管溶蚀率小但形成的BGCTs片剂非常蓬松,从而出现了盐酸环丙沙星 2 h的药物累积释放率(41.3%±3.2%,图5曲线a)显著高于OKGM与BSF70质量比为2∶8的胃漂浮片的药物累积释放率(22.8%±3.5%,图5曲线b)(p<0.05)。
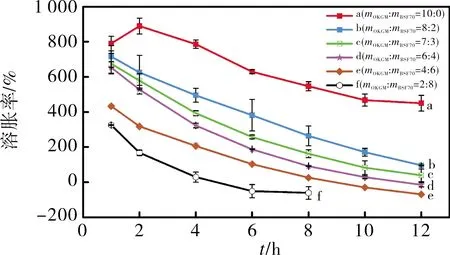
图4 BGCTs 的溶胀性能Fig.4 Swelling indexes of BGCTs in simulated gastric solution
不同OKGM/BSF70比例的溶蚀率和溶胀率结果证实:加入适当比例的OKGM可协同平衡BGCTs片的溶蚀能力和溶胀能力,OKGM与BSF70质量比为8∶2(见图3曲线b、图4曲线b)可协同提高BSF70的溶胀能力。与预期一样,随着BGCTs片基质中BSF70含量的降低,BGCTs溶蚀能力有所提升,在模拟胃液中的稳定性提高,在模拟胃液中的漂浮时间更长,缓慢释药性能更明显。因此,mOKGM∶mBSF70=8∶2共混制备得到的BGCTs片,协同平衡BGCTs片的溶蚀能力和溶胀能力,为OKGM/BSF70胃漂浮片克服BSF70在模拟胃液中的药物突释奠定了坚实基础,这也和在模拟胃液中盐酸环丙沙星的释放特性结果相一致(图5曲线b)。
2.5 BGCTs在模拟胃液中的释药性能
不同OKGM/BSF70比例制备得到的胃漂浮片在模拟胃液中的药物释放性能结果见图5。单独使用BSF70制备得到的BGCTs,由于续漂时间过短,在4~6 h内盐酸环丙沙星释放率达100%(数据未列出)。当胃漂浮片中BSF70质量分数小于80%,盐酸环丙沙星释放速率随BSF70含量的增加而增加。当mOKGM∶mBSF70=8∶2,即BSF70在体系中的质量分数为20%时,BGCTs在2,6,12 h 累积释药分别为22.80%,51.53%,89.05%,盐酸环丙沙星释放速率反而比无BSF70缓慢,这是由于BSF70 和 OKGM以 2∶8 的质量比混合,在溶液中互穿形成了更为致密的结构,降低了BGCTs的溶蚀率(图3曲线b所示)。当BSF70质量分数大于20% 时,内聚力不足以形成致密结构从而形成蓬松的凝胶,导致盐酸环丙沙星快速释放。
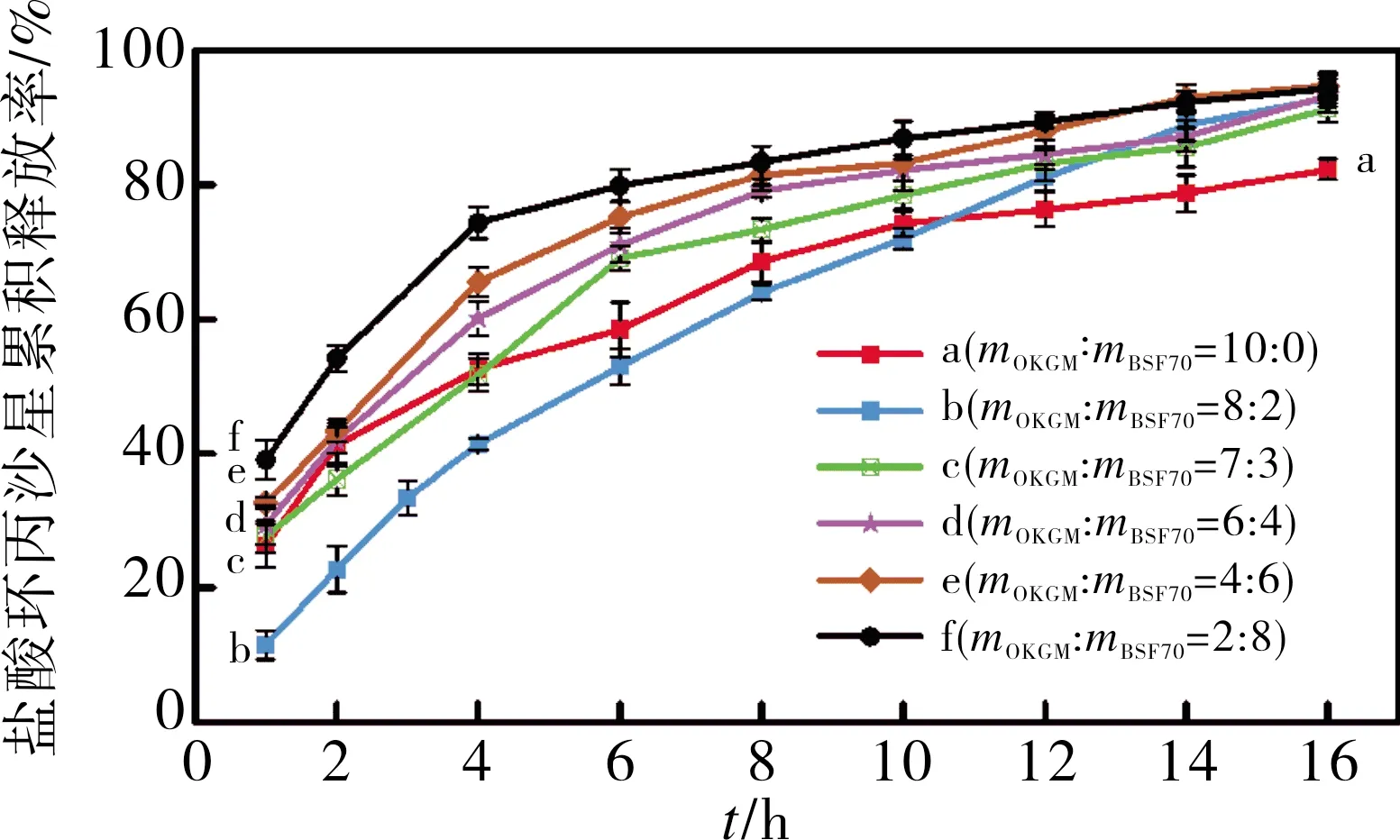
图5 BGCTs释药行为Fig.5 Drug release behavior from BGCTs
2.6 BGCTs释药机制分析
2.6.1 动力学模型拟合分析
为了进一步研究BGCTs在模拟胃液中的药物释放机制,分别用以下方程拟合药物释放曲线:
零级动力学方程[17]:
Qt=k0t
(6)
一级动力学方程[18]:
ln(1-Qt)=a-k1t
(7)
Higuchi 方程[18]:
Qt=kHt1/2
(8)
Ritger-Pappas方程[18]:
Qt=kptn
(9)
其中:Qt为t时刻药物累积释放率;k为相应方程的药物释放速率常数;n为Ritger-Pappas方程中药物释放因子。对于片剂来说,当n<0.45,药物以Fick扩散为主的方式释放;当0.45
采用以上4种方程对不同配方比例制备得到的胃漂浮片拟合,参数见表3。其相关系数与一级动力学方程和Higuchi方程拟合度高,BGCTs呈现出缓释制剂的释药特性[15],尤其以mOKGM∶mBSF70=8∶2 的相关性最高,R2分别为0.992 5和0.998 1,载药BGCTs缓释性用Higuchi方程拟合,其相关性更高,显示出亲水性凝胶骨架的缓释特性[18],提示盐酸环丙沙星从BGCTs中释放以Fick扩散为主。药物释放期间是否兼具骨架溶蚀,可用Ritger-Pappas方程拟合盐酸环丙沙星在模拟胃液中的释放数据验证。Ritger-Pappas方程中药物释放因子在不同OKGM与BSF70比例制备得到的胃漂浮片中各不相同,除OKGM/BSF70质量比为8∶2,n为0.641 7,在 0.45~0.90 之间外,其余比例的n值都小于0.45。当mOKGM∶mBSF70=8∶2时,载药BGCTs在模拟胃液中盐酸环丙沙星的释放以Fick扩散和骨架溶蚀混合作用的结果为主。不同BSF70和OKGM比例制备的载药BGCTs在模拟胃液中盐酸环丙沙星的释放速率(值)分别为0.308 4,0.162 7,0.299 0,0.346 1,0.374 5,0.462 6,这表明OKGM与BSF70质量比为 8∶2 时的释放速率缓慢。
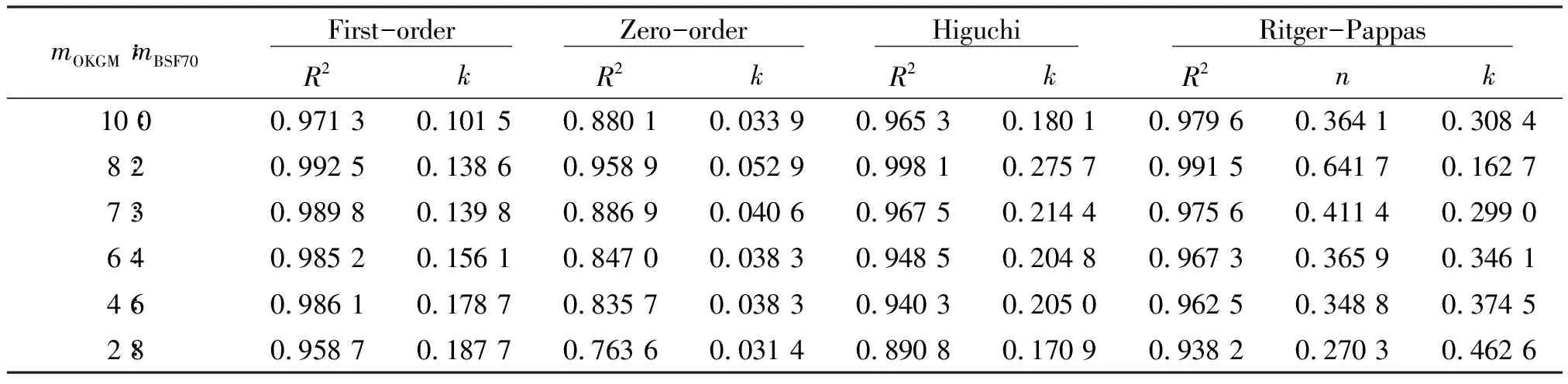
表3 BGCTs片盐酸环丙沙星动力学参数Table 3 Kinetic parameters of ciprofloxacin BGCTs formulations
2.6.2 载药材料孔隙率分析
OKGM,BSF70以及OKGM/BSF70载体材料孔隙率测定结果见表4。因在BSF70中加入了不同比例的OKGM,使载药材料的孔隙率从(85.25±0.51)%减少至(77.40±0.50)%。OKGM的添加量影响载药材料的孔隙率,OKGM的比例越高,载药材料的孔隙率越小,但当OKGM与BSF70质量比为8∶2至 6∶4 时,载药材料的孔隙率无显著性差异(p<0.05)。孔隙率的减小,可以阻挡模拟胃液进入载体材料内部,使目标药物缓慢释放。故OKGM和BSF70以一定比例混合,降低孔隙率,是影响BGCTs在胃内滞留的重要基础。

表4 BGCTs孔隙率(x±s,n=3)Table 4 Porosity of BGCTs(x±s,n=3)
2.6.3 载药材料SEM分析
OKGM,BSF70 和OKGM/BSF70质量比为8∶2的共混载药材料的SEM图都呈现出孔洞结构,如图6所示。OKGM的微观结构显示较小的孔洞和部分不连续的片状分布,孔隙率也较小,使药物释放不完全。BSF70的微观结构显示条索状孔洞结构,孔隙较大,且孔隙率也较大,导致药物释放过快。而OKGM与 BSF70 质量比为 8∶2 的共混载药材料则呈现
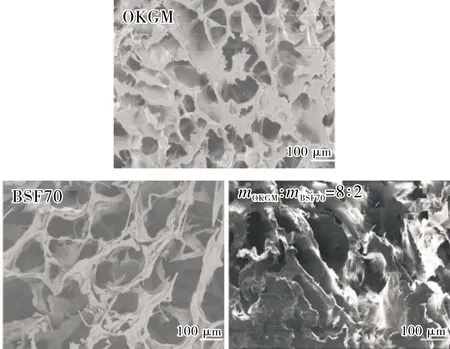
图6 BGCTs 的SEM图Fig.6 SEM images of BGCTs
膜层片状孔洞结构,片状孔洞结构的不规则性和孔隙率的改变说明共混载药材料之间表现出较强的相互作用,为目标药物的缓慢释放提供了基础。
2.6.4 GPC分析
聚合物的分子量与其性质密切相关,通常用分子量分布(D,Mw/Mn)表示聚合物的分散性能。D值越大,分子量越分散。BSF70和OKGM的重均分子量分别为2.372×105g/mol和8.240×105g/mol,D值分别为1.711和1.334。BSF70和OKGM的重均分子量都在一个数量级内,OKGM分子量较BSF70稍大,分子量分布小,这为共混后分子之间的互穿奠定了基础。OKGM和BSF70以8∶2质量比混合得到的缓释载药材料,在模拟胃液中以Fick扩散和骨架溶蚀协同作用为主,实现了目标药物在胃内的缓慢释放。
3 结论
(1) 体积分数70%的乙醇纯化得到的白及纯化物,其多糖的质量分数可达到84%,其多糖的黏度也最大,分子量为2.372×105g/mol,分子量分布为1.711,其胃漂浮片微观结构显示条索状孔洞结构,孔隙率较小。
(2) OKGM和BSF70按不同质量比混合,制备得到的胃漂浮片剂,都能在模拟胃液中立即起漂;BSF70比例越低,续漂时间越长,当OKGM与BSF70质量比为8∶2时,续漂时间超过12 h。
(3) OKGM和BSF70按质量比8∶2混合,制备得到的载药胃漂浮片剂在模拟胃液中药物缓慢释放,且以Fick扩散和骨架溶蚀协同作用释放。
