转基因甘蔗BtG-2的T-DNA侧翼序列分析及其转化事件特异性检测
2021-11-08冯翠莲万玥冯小艳王俊刚赵婷婷王文治沈林波张树珍
冯翠莲 万玥 冯小艳 王俊刚 赵婷婷 王文治 沈林波 张树珍

摘 要:转基因甘蔗BtG-2是利用农杆菌介导法把Cry1Ac-2A-gna融合抗虫基因导入‘新台糖22号的转基因甘蔗株系,具有良好的抗虫特性和农艺性状。为了明确转基因甘蔗BtG-2的分子特征及其检测方法,推进其生物安全性评价工作,以BtG-2的T2代为研究材料,利用Southern杂交检测外源基因在转基因甘蔗基因组内的拷贝数;利用染色体步移技术分离外源基因在甘蔗基因组中插入位點的侧翼序列,并建立了该转化体高效灵敏的特异性PCR检测方法。结果表明:Southern杂交检测证明外源T-DNA以单拷贝方式插入BtG-2株系;经过3次的热不对称巢式PCR扩增,获得外源基因T-DNA左边侧翼序列984 bp和右边侧翼序列705 bp;以这2个序列和相应的T-DNA的左右端序列分别设计3对检测引物对,建立了BtG-2株系的转化事件特异性PCR检测方法,扩增效率最高的引物对LS011/LA451和RS160/RA588分别扩增到440 bp和428 bp的特异片段。其中T-DNA左侧设计的LS011/LA451检测引物对扩增的灵敏度高、特异性强,能够在甘蔗BtG-2基因组DNA相对含量为0.1%的模板中检测出转基因目的成分,相当于9个单倍体基因组拷贝数。本研究完成了转基因株系BtG-2的分子特征及其转化事件特异性检测,为该转基因甘蔗及其衍生产品的检测和身份识别提供技术依据。
关键词:抗虫转基因甘蔗;T-DNA侧翼序列;转化事件特异性检测;染色体步移
中图分类号:S961.6 文献标识码:A
Analysis of the T-DNA Flanking Sequence and Event-specific Detection for Insect-resistant Transgenic Sugarcane BtG-2
FENG Cuilian1, WAN Yue2, FENG Xiaoyan1, WANG Jungang1, ZHAO Tingting1, WANG Wenzhi1, SHEN Linbo1, ZHANG Shuzhen1,2*
1. Institute of Tropical Bioscience and Biotechnology, Sugarcane Research Center, Chinese Academy of Tropical Agricultural Sciences / Key Biotechnology Laboratory for Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China; 2. College of Life Science, Nanjing Agriculture University, Nanjing, Jiangsu 210095, China
Abstract: Sugarcane BtG-2 is an insect resistance transgenic sugarcane strain, developed by introducing the Cry1Ac- 2A-gna fusion gene into ‘ROC22 with the Agrobacterium-mediated method. It has strong insect resistance and excellent agronomic traits. In order to clarify the molecular characteristics and detection of transgenic sugarcane BtG-2, and promote biological safety evaluation, the T2 generation of BtG-2 was selected, and the copy number of foreign genes in the transgenic sugarcane genome was detected by Southern hybridization. The flanking sequence of the insertion site of the foreign gene was isolated using the chromosome walking technology, and an efficient specific PCR detection method of the strain was established. The results showed that the foreign T-DNA insertion of BtG-2 strain was a single copy. After three times amplifications of thermal asymmetric interlaced PCR, 984 bp of the left flanking sequence and 705 bp of the right flanking sequence of the foreign gene T-DNA were obtained. According to the flanking sequences, three pairs of detection primers were designed respectively, then the event-specific PCR detection for transgenic sugarcane BtG-2 was established. The primer pairs with the highest amplification efficiency were LS011/LA451 and RS160/RA588, with 440 bp and 428 bp specific amplified fragments respectively. Among them, the pair of primers LS011/LA451 designed on the left side of T-DNA had high sensitivity and specificity for detection, and this method could detect the genetically modified ingredients in samples containing 0.1% genomic DNA of sugarcane BtG-2. This study completed the molecular characteristics and event-specific detection of the transgenic strain BtG-2, which provided a technical basis for the detection and identification of the transgenic sugarcane and its derivatives.
Keywords: Insect-resistant transgenic sugarcane; T-DNA flanking sequence; event-specific detection; chromosome walking
DOI: 10.3969/j.issn.1000-2561.2021.09.005
甘蔗(Saccharum spp.)是全球第五大宗农作物,是世界上最重要糖料和生物燃料作物。中国糖业协会数据显示:2020年全国种植甘蔗119.1万hm2,产糖量841.9万t,农业直接年产值约480亿人民币[1],因此甘蔗产业对国民经济具有重要的意义。然而甘蔗受各种螟虫的为害,严重影响甘蔗的产量和质量,仅以湘桂蔗区为例,2018—2019年,该区的甘蔗虫害发生极为严重,平均螟害株率高达46.54%,平均产量损失为14.87%,平均蔗糖分损失高达1.12个百分点,农业损失4.67亿元,工业损失8.56亿元,国家财政损失0.51亿元[2]。因此培育抗虫甘蔗新种质一直是甘蔗育种的一个重要目标,然而甘蔗是高度杂合的无性繁殖作物,其庞大的基因组、复杂的高多倍体以及同源异源杂交品种等复杂的遗传背景[3],给育种工作带来很大的盲目性。基因工程可定向改变作物的某些性状,通过转基因技术提高甘蔗抗虫性将是甘蔗抗虫育种的重要新途径。
在转基因作物中,T-DNA在受体植物基因组中的整合位置都是随机的,然而每个转基因事件的T-DNA左右端序列与受体基因组序列拼接而成的T-DNA插入位点侧翼序列是唯一的,是該转基因事件身份的特异性标识[4]。因此,分离转基因植物的T-DNA侧翼序列,以及依据该侧翼序列而建立的特异性检测方法,是准确识别不同转基因作物,实现转基因作物及其产品产权保护、检测和有效监督管理的一个重要依据。
目前分离外源T-DNA侧翼序列主要以PCR技术为基础,包括反向PCR、外源接头介导PCR、半随机引物PCR、全基因组重测序技术等,其中半随机引物PCR中的热不对称交错PCR(TAIL-PCR)、高效热不对称PCR(hiTAIL-PCR)或染色体步移法(Genome Walking)是当前使用最广泛的方法。利用此类技术已经成功分离了转基因水稻[4-8]、大豆[9-11]、棉花[12-13]、玉米[14-17]、小麦[18-20]、马铃薯[21-22]、油菜[23]和木瓜[24]等T-DNA侧翼序列,并建立其相应的转化事件特异性检测技术;全基因组重测序是近年发展起来的新技术,是对已知基因组序列的物种进行不同个体的基因组测序,并在此基础上对个体或群体进行差异性分析,主要用于检测单核苷酸多态性位点(SNP)、插入缺失位点(InDel)、结构变异位点(SV)位点和拷贝数变异位点(CNV)[25]。近两年该技术也成功应用到分离转基因作物大豆[26-29]、水稻[30]的T-DNA侧翼序列上,并建立其相应的转化事件特异性检测技术。转基因作物转化事件特异性检测技术是以其转基因T-DNA侧翼序列的部分序列为靶标进行扩增,扩增产物是T-DNA 5端或3端序列与受体基因组的拼接序列,因此具有高度特异性,可准确识别不同的转基因作物品系。
转基因甘蔗的研究始于20世纪90年代初,经过近30年的努力,取得了很大的成果。截至目前,据国际农业生物技术应用服务组织(ISAAA)的数据,获得安全证书的甘蔗转基因事件仅有6例,分别是巴西2017年获批的转Cry1Ab基因的抗虫转基因甘蔗CTB141175/01-A和2018年获批的转Cry1Ac基因的CTC91087-6和CTC93209-4,印度尼西亚2011年获批的转大肠杆菌的胆碱脱氢酶(EcBetA)基因耐旱转基因甘蔗的NXI-1T,以及2013年获批的转苜蓿根瘤菌的胆碱脱氢酶(RmBetA)基因耐旱转基因甘蔗的NXI-4T、NXI-6T[31]。由此可见,转基因甘蔗的研究远远落后于其他作物。目前转基因甘蔗的研究重点仍在遗传转化等前期工作上,转基因甘蔗的生物安全评价以及检测、监督等后期工作的研究极少有报道,尤其转化事件特异性检测国内外尚未有报道。
本研究组前期通过农杆菌介导把Cry1Ac- 2A-gna抗虫融合基因转入甘蔗新台糖22号,经过2个无性繁殖世代的抗虫性和遗传稳定性的评价和深入农艺性状鉴定(待发表),已获得抗虫性好、农艺性状优良的BtG-2株系,正准备进行环境释放。为了明确转基因甘蔗BtG-2的分子特征及便于其检测,推进其生物安全性评价工作,本研究以其无性繁殖T2代为植物材料,首先利用Southern杂交检测外源T-DNA在BtG-2中的插入拷贝数;然后利用染色体步移技术分离其T-DNA侧翼序列,并根据T-DNA左右端序列和左右侧翼序列设计检测引物对,建立转基因甘蔗BtG-2的转化事件特异性检测方法,同时检验该方法的特异性与灵敏度,为该转基因甘蔗及其衍生产品的检测和身份识别提供技术依据。
1 材料与方法
1.1 材料
植物材料为转Cry1c-2A-gna融合抗虫基因和bar抗除草剂基因的甘蔗BtG-2株系以及BtG-1、BtG-4、BtG-17、BtG-32、BtG-35、BtG-36和BtG-41是通过农杆菌介导转化甘蔗‘新台糖22号(‘ROC22)胚性愈伤而获得,由本实验室保存,BtG-2株系已申请在海南省的中间试验。植物表达载体以pCambia3300为骨架。PCR DIG Probe Synthesis Kit、Dig nucleic acid detection kit购于德国罗氏公司;HyboodTM-N+尼龙膜购自美国GE Amersham;试剂LA Taq酶、Genome Walking Kit、pMDTM18-T Vector Cloning Kit、T4 DNA Ligase、部分Marker购于TaKaRa公司;质粒提取、胶回收试剂盒及纯化试剂盒购于Axygen公司;氨苄青霉素、琼脂糖购于Sigma公司;2×Taq plus MasterMix购于Biosharp公司。PCR引物合成及基因测序由上海生工生物工程技术服务有限公司完成。其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 甘蔗BtG-2基因组DNA的提取 选择转基因甘蔗BtG-2的无性繁殖T2代植株的幼嫩叶片,采用改良CTAB法大量提取并纯化基因组总DNA[32],同时提取非转基因甘蔗ROC22基因组总DNA作为对照。取2 μL于Thermo Scientific Nano Drop One生物核酸定量检测仪测定DNA的浓度和纯度,另取2 μL于1.0%琼脂糖凝胶电泳检测DNA的完整性。
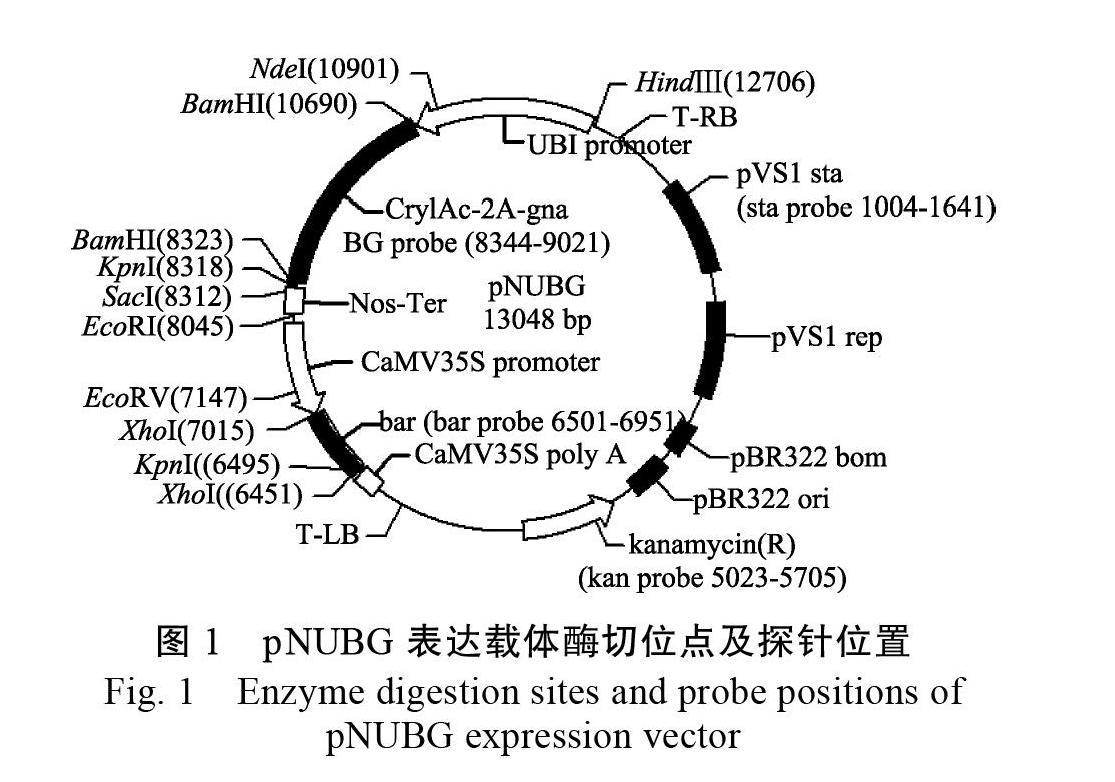
1.2.2 Southern杂交检测 以转化质粒pNUBG为模板,利用高效PCR地高辛标记法分别制备BG(包括Cry1Ac-2a-gna中Cry1Ac基因下游355 bp,2a和gna全长)、bar、sta、kan四种不同的探针,扩增引物、退火温度、产物长度等详见表1。通过分析T-DNA区的酶切位点,结合各探针在T-DNA上的位置(图1),分别选择2种限制性内切酶对30 μg基因组DNA进行酶切(表1),然后转移至HyboodTM-N+尼龙膜,再利用相应的探针进行Southern杂交检测,具体步骤参照试剂盒说明书。杂交温度为40 ℃,预杂交时间为2 h,杂交时间为16 h,室温黑暗条件下用BCIP/NBT进行化学显色,待杂交信号带清晰后终止显色,拍照并分析[33]。
1.2.3 转基因甘蔗BtG-2的T-DNA左右侧翼序列的获取 按照Genome Walking Kit中的要求,在表达载体pNUBG的T-DNA左右端序列分别设计3条退火温度约为65 ℃的嵌套特异性引物(表2),分别命名为Lsp1、Lsp2、Lsp3和Rsp1、Rsp2、Rsp 位置见图2。按照操作说明,分别选取试剂盒中提供的随机简并引物AP1、AP2、AP3、AP4其中之一,与嵌套特异性引物组合配对,进行3轮巢式PCR扩增,分离该株系的T-DNA左右侧翼序列。第1轮PCR反应体系中,BtG-2基因组DNA模板为200 ng,特异性引物为Lsp1或Rsp 简并引物为AP1-AP4其中之一。第2轮PCR反应的扩增模板为上一轮PCR产物稀释50倍,特异性引物为Lsp2或Rsp2,简并引物为第1轮所用的AP引物,第3轮同第2轮,特异引物换成Lsp3或Rsp 每一轮反应的退火温度详见表2,扩增程序参照试剂盒说明书。3轮扩增产物用1.0%琼脂糖凝胶电泳分离,第3轮特异扩增片段利用DNA胶回收试剂盒回收。连接T载体,转化大肠杆菌DH5α,选取阳性菌株送至上海生工生物工程技术服务有限公司测序。
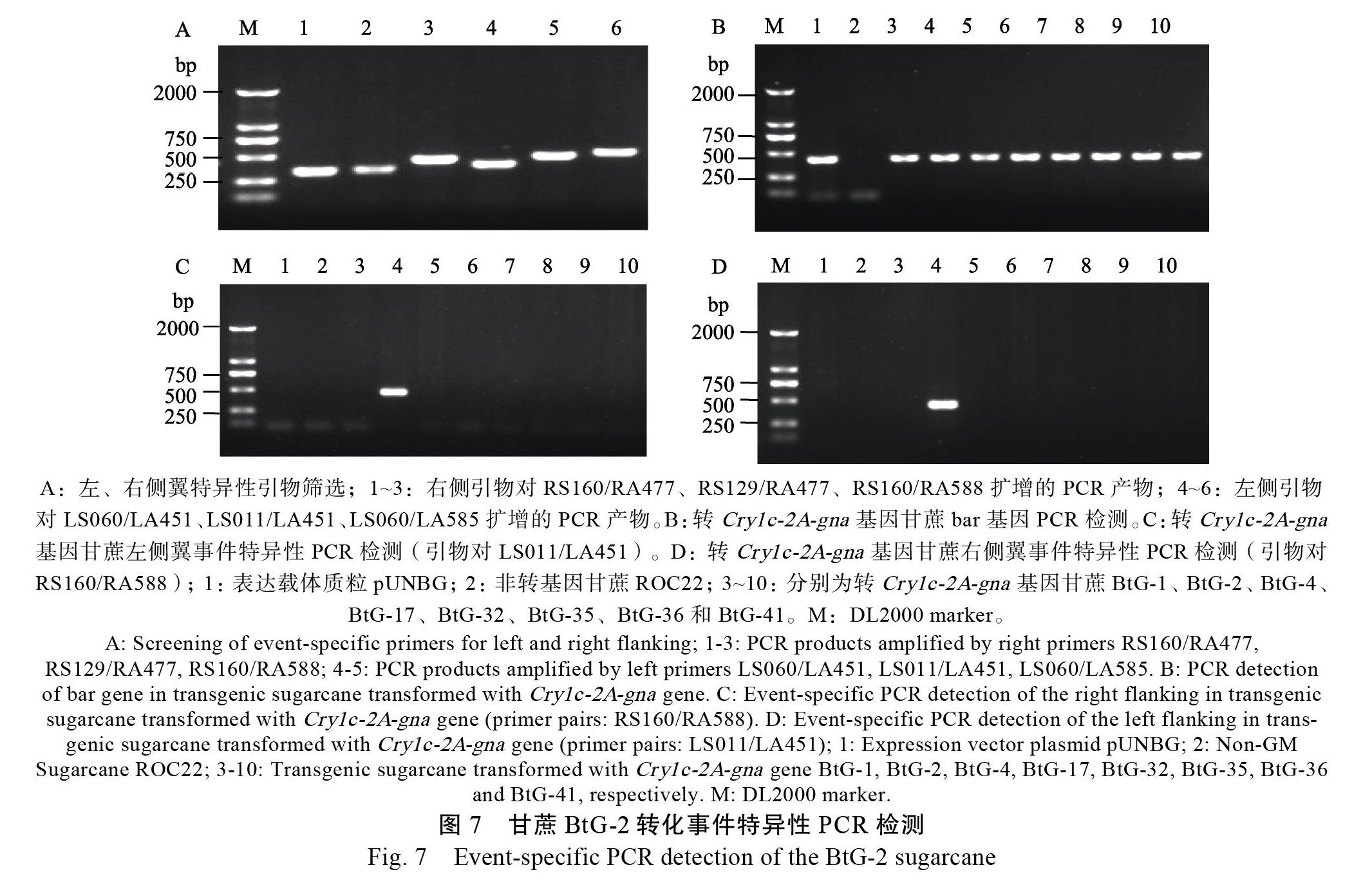
1.2.4 转基因甘蔗BtG-2事件特异性PCR检测及其灵敏度 BtG-2事件特异性PCR检测的建立:根据T-DNA左右两侧翼序列的测序结果,以及已知的T-DNA左右端载体序列分别设计3对左、右侧特异性检测引物:LS060/LA451、LS011/LA451、LS060/LA585和RS160/RA477、RS129/RA477、RS160/RA588,对转基因甘蔗BtG-2进行扩增,分别筛选一组左、右特异性检测扩增效率最好的,并回收纯化特异性片段及测序,比对是否与预期序列完全一致,最终建立事件特异性检测方法。特异性检测引物对的一条引物位于甘蔗基因组序列,另一条引物则位于T-DNA左、右端载体序列,引物序列详见表3。分别利用上述筛选的2对引物和bar基因引物,以包括BtG-2在内的转Cry1Ac-2a-gna基因的不同甘蔗株系和非转基因甘蔗DNA为模板,以表达载体pUNBG质粒为对照,进行转化事件特异性PCR检测。DNA模板量为200 ng,反应循环数35,退火温度见表3。PCR产物取5 μL于1.0%琼脂糖凝胶电泳检测扩增效率和扩增特异性。
检测转化事件特异性PCR的灵敏度:转基因甘蔗BtG-2与受体甘蔗ROC22的基因组DNA分别稀释至100 ng/μL,根据不同的比例配制BtG-2的DNA相对含量为100%、50%、10%、1%、0.5%、0.1%、0.05%和0%(V/V)的样品。混合样品各取1 μL作为PCR模板,分别利用上述已筛选出来的扩增效率最高的左、右特异性引物对,进行PCR扩增。取5 μL PCR产物,用1.0%琼脂糖凝胶电泳,检查各浓度DNA模板下的扩增效果,检测各引物对的事件特异性PCR的特异性和灵敏度。
2 结果与分析
2.1 抗虫转基因甘蔗BtG-2外源T-DNA插入拷贝数检测
转基因甘蔗BtG-2基因组DNA分别用BamHⅠ、NdeⅠ、EcoRⅤ限制性内切酶进行酶切、电泳和转膜后,利用地高辛标记的外源基因BG和bar片段的探针分别进行Southern杂交检测。
结果表明,不同限制性内切酶酶切后的甘蔗基因组DNA经BG和bar探针杂交后,均只显示一条杂交带,并且杂交带的大小与预测理论大小一致,而对照非转基因植株中无杂交信号,说明外源基因已整合到甘蔗BtG-2基因组中,并以单拷贝的方式整合(图3);用载体骨架序列制备的sta和kan探针进行Southern杂交,结果表明转基因甘蔗基因组中没有来源于转化载體的其他元件以及骨架序列。
2.2 T-DNA左、右侧翼序列的获得及分析
3条左侧巢式特异性Lsp引物分别与试剂盒中AP1-AP4四条简并引物组合,经过3轮热不对称巢式PCR反应后,电泳结果显示,特异性引物与简并引物AP3扩增出的片段更长且特异性更好(图4A)。回收3rd产物,测序获得984 bp的序列(图5A),其中838 bp属于甘蔗基因组序列,此部分GC百分含量为48.69%;剩余146 bp与T-DNA左边载体序列重合,并且最左边缺失了包括LB border在内的115 bp(图5B)。
3条右侧巢式特异性Rsp引物同样分别与试剂盒中AP1-AP4四条简并引物组合扩增右侧翼序列,结果显示,简并引物AP1扩增出的片段特异性更好(图4B)。测序获得705 bp的序列(图6A),其中566 bp为甘蔗基因组序列,GC百分含量为50.71%,余下139 bp属于T-DNA右边界载体序列,T-DNA插入BtG-2株系基因组时,右边比较完整,仅缺失了2 bp(图6B)。由此可见,T-DNA序列插入时,左右两侧均有不同程度的缺失,且左边相对容易缺失。
2.3 建立转基因甘蔗BtG-2事件特异性检测方法
使用左、右端3对特异性检测引物LS060/ LA451、LS011/LA451、LS060/LA585和RS160/ RA477、RS129/RA477、RS160/RA588,对转基因甘蔗BtG-2进行扩增,扩增效率最好的左、右特异性检测引物对分别是LS011/LA451和RS160/ RA588(图7A)。以转相同基因的转基因甘蔗株系和非转基因甘蔗为模板,分别利用上述2对扩增效率最好引物和bar基因引物进行事件特异性检测。结果显示,使用特异性检测引物对的扩增产物中,只在转基因甘蔗BtG-2可扩增到大小为440 bp(左侧翼)和428 bp(右侧翼)的特异性条带,其他转基因株系和非转基因材料扩增均为阴性(图7C、D);而使用bar基因引物的扩增产物中,表达载体质粒和转基因各株系均能扩增到约423 bp的特异性片段,只有非转基因甘蔗扩增结果为阴性(图7B)。BtG-2扩增到的440 bp和428 bp的特异性片段回收后,经测序比对证实与预期序列完全一致。证明引物对LS011/LA451和RS160/RA588可特异的识别转基因甘蔗事件BtG-2。
2.4 事件特异性PCR检测的灵敏度
利用引物对LS011/LA451和RS160/RA588检测事件特异性PCR在不同BtG-2的DNA含量混合样品中的扩增限度。结果发现,以左侧引物对LS011/LA451扩增时,当BtG-2的DNA含量降低至0.1%时,仍然可以特异地扩增到目的片段(图8A);以右侧引物对RS160/RA588扩增时,当BtG-2的DNA含量降低至1%和0.5%时,除了目的片段,还出现了非特异片段的扩增,当BtG-2的DNA含量降低至0.1%及更低时,只有非特异片段的扩增(图8B)。以上结果表明,以右侧引物对RS160/RA588的特异性PCR检测的特异性和灵敏度较差,而以左侧引物对LS011/LA451的特异性PCR检测的特异性好、灵敏度高,最低检出值达每100 ng DNA模板量的0.1%,按甘蔗基因组为10 Gb计算,相当于9个单倍体基因组拷贝数,该灵敏度可满足事件特异性检测的要求。
3 讨论
近年来,转基因作物种植及应用持续保持稳定增长,2018年,全球26个国家种植了1.917亿hm2转基因作物,比2017年增长1%。2019年,全球共有43项关于转基因作物的批准,有9个新的转基因作物品种获得批准,包括油菜、棉花、豇豆、大豆和甘蔗。而国内农业农村部公示了192个拟颁发的“农业转基因生物安全证书”植物品种,其中包括189个棉花、2个玉米和1个大豆品种[34]。然而转基因作物的快速发展,亟需对转基因作物进行有效的评估与监管。每一个转化事件中,T-DNA在受体植物的插入都是随机的,因此,T-DNA侧翼序列的克隆及定位对于转因植株的身份验证具有重要意义,并有助于对外源基因的表达和外源基因在受体植物中所能产生的影响进行研究,从而有利于对转基因植株的安全性做出充分评估[5]。
检测外源基因旁侧序列及在受体基因组中的整合位点的方法有很多种,当前应用最广泛最成功的的是热不对称交错PCR或染色体步移法,以及近几年发展起来的全基因组重测序新技术。后者是对已知基因组序列的物种进行不同个体的基因组测序,并在此基础上对个体或群体进行差异性分析,由此可见,应用该技术的前提条件是已知受体植物的基因组序列信息。截至目前,国内外并未对甘蔗ROC22开展基因组测序工作,因此本研究仍然选择操作比较繁琐的染色体步移法。染色体步移法的原理和热不对称交错PCR是一致的。本研究中,根据已知T-DNA左右序列设计3条同向Tm值约为65 ℃的特异性引物,与Genome Walking Kit中的4条简并引物分别进行热不对称PCR反应,通过3次巢式PCR反应后,电泳检测发现,4条简并引物跟相同的特异性引物组合的擴增效率差异很大,只有简并引物AP1和右侧特异性引物组合、AP3和左侧特异性引物组合经过退火温度、模板浓度等调整可扩增到特异片段,其他组合经过多次调整仍无法得到特异片段,由此推测AP1和AP3简并引物比较适用于甘蔗。
通过上述染色体步移法获得了BtG-2的T-DNA侧翼序列,上传至NCBI的核酸数据库中进行比对,结果显示没有任何的同源序列,原因是甘蔗栽培种全基因组测序尚未完成,NCBI的核酸数据库只有少量的转录组测序序列和一些EST序列,因而无法对抗虫转基因甘蔗T-DNA插入位点进行精准的定位。另一方面甘蔗割手密种AP85-441基因组测序于2018年完成并发表在《Nature Genetics》上[35],本研究团队成员把序列下载到本地,进行本地化建库获得库文件,T-DNA侧翼序列Blastn比对,发现T-DNA插入位点可能位于该基因组的Chr1B非编码区92 525 762位点、Chr3B非编码区8 557 277位点、Chr3D非编码区7 168 624位点、Chr5C非编码区38 753 724位点。从上述结果看,外源基因插入位点可能是甘蔗基因组的重复序列区,此重复序列存在于甘蔗割手密基因组多条染色体上;从Southern杂交的结果看,外源基因在甘蔗基因组中只有一个整合位点,而就目前缺少甘蔗基因组序列数据库的情况下,根据甘蔗某段核酸序列而进行准确的染色体定位是极其困难的,最好的解决方法是加快甘蔗基因组的测序工作。据了解,国内已经有甘蔗研究团队准备甘蔗ROC22的基因组测序工作,该项工作的完成,势必将甘蔗基因组功能研究等基础研究推上一个新的台阶。
通过扩增T-DNA插入片段和受体基因组的连接区域而建立起来的事件特异性检测法,是鉴定含有相同T-DNA插入片段的不同转化事件的有效方法,是目前用于转基因作物及其产品中转基因成分检测的最常用方法。本研究建立的转基因甘蔗BtG-2的事件特异性PCR检测方法特异性好、灵敏度高,转基因成分含量0.1%及以上时,利用常规定性PCR方法即可检测,此检测灵敏度远高于欧盟对转基因植物衍生的食品及饲料标识的最低限量(0.9%)[36]。
4 结论
本研究利用Southern杂交确定了转基因甘蔗BtG-2的外源基因的插入拷贝为单拷贝;利用染色体步移方法,扩增得到转基因甘蔗BtG-2外源基因插入位点的左右侧翼序列;以此序列为基础,建立了转基因甘蔗BtG-2的事件特异性检测方法。该方法特异性好、灵敏度高,为转基因甘蔗BtG-2的利用及产品检测提供关键技术基础。
参考文献
[1] 中国糖业协会. 2019/20年制糖期截至3月底食糖产销情况简报[EB/OL]. (2020-04-08)[2020-08-28]. http://www. chinasugar.org.cn/i,35,3430,0.html.
[2] 谢江江, 杨俊贤, 罗青文, 等. 广西湘桂蔗区甘蔗虫害调研及防控对策[J]. 甘蔗糖业, 2019(5): 24-28.
[3] Zhang J, Zhang X, Tang H, et al. Allele-defined genome of the autopolyploid sugarcane Saccharum pontaneum L.[J]. Nature Genetics, 2018, 50(S1): 1565-1573.
[4] 崔 帅, 王作平, 于江辉, 等. 转基因水稻BPL9K-2事件特异性检测方法的建立[J]. 中国生物工程杂志, 2018, 38(11): 32-41.
[5] 金永梅, 马 瑞, 于志晶, 等. 转基因水稻吉生粳2号的外源基因旁侧序列分离及事件特异性PCR检测方法[J]. 东北农业科学, 2016, 41(1): 14-19.
[6] Dong Y, Jin X, Tang Q, et al. Development and event-spe-cific detection of transgenic glyphosate-resistant rice expressing the G2-EPSPS gene[J]. Frontiers Plant Science, 2017, 8: 885-895.
[7] 郭 超, 何行健, 邓力华, 等. 转基因水稻 BarKasalath-01事件特异性检测[J]. 分子植物育种, 2017, 15(11): 4466-4475.
[8] 金永梅, 马 瑞, 于志晶, 等. 转cry1C基因抗虫水稻吉生粳3号外源基因整合分析与品系特异性检测[J]. 生物技术通报, 2019, 35(3): 6-12.
[9] 包婉莹, 仲晓芳, 杜 茜, 等. 抗病转基因大豆事件B4J8049外源T-DNA整合位点分析及特异性检测[J]. 东北农业科学, 2018, 43(5): 21-26.
[10] 蔡勤安, 尚丽霞, 姜志磊, 等. 转HAL1基因大豆侧翼序列分析及特异性检测方法研究[J]. 大豆科学, 2018, 37(1): 32-38.
[11] Federici S, Paraskevopoulos K. Risk assessment of new sequencing information for genetically modified soybean A2704-12[J]. EFSA Journal, 2018, 16(11): 5496-5503.
[12] 陈天子, 凌溪铁, 杨郁文, 等. 转GbVe1基因在棉花基因组中的整合与定位分析[J]. 棉花学报, 2019, 31(1): 1-11.
[13] 王 葉, 谢家建, 黄春蒙, 等. 转cry1Aa基因抗虫棉整合结构解析及转化体特异性检测方法的建立[J]. 棉花学报, 2017, 29(4): 307-315.
[14] 郭 翠, 张 维, 余桂容, 等. 转G2-EPSPS基因玉米D-3侧翼序列分析与转化体特异性检测方法[J]. 作物杂志, 2016(1): 69-75.
[15] Rao J, Yang L T, Guo J C, et al. Development of event- specific qualitative and quantitative PCR detection methods for the transgenic maize BVLA430101[J]. European Food Research and Technology, 2016, 242(8): 1277-1284.
[16] 王翠云, 刘 艳, 刘允军. 外源基因在转基因玉米中的整合位点分析[J]. 生物技术通报, 2019, 35(3): 1-5.
[17] Siddique K, Wei J, Li R, et al. Identification of T-DNA insertion site and flanking sequence of a genetically modified maize event IE09S034 using next-generation sequencing technology[J]. Molecular Biotechnology, 2019, 61(9): 694-702.
[18] Zhang M H, Yu Y B, Gao X J, et al. Event-specific quantitative detection of genetically modified wheat B72-8-11 based on the 3 flanking sequence[J]. European Food Research and Technology, 2015, 240(4): 775-782.
[19] Zhang P Q, Xu J Y, Zheng Q Y, et al. Flanking sequence determination and event specific detection of transgenic wheat B72-8-11b strain[J]. Applied Biochemistry and Biotechnology, 2013, 169(5): 1523-1530.
[20] Xu J Y, Cao J J, Cao D M, et al. Flanking sequence determination and event-specific detection of genetically modified wheat B73-6-1[J]. Acta Biochimicaet Biophysica Sinica, 2013, 45(5): 416-421.
[21] 闫建俊, 白云凤, 左静静, 等. 转基因马铃薯外源基因插入位点分析及检测方法的建立[J]. 分子植物育种, 2020, 18(16): 5361-5366.
[22] Gao H, Yu X, Deng T, et al. Event-specific detection of transgenic potato AV43-6-G7 using real-time and digital PCR methods[J]. Bmc Biotechnology, 2016, 16(1): 74-83.
[23] Chen S, Shen A J, Zhou X Y, et al. Analysis of the flanking sequence and event-specific detection of transgenic line W-4 of Brassica napus[J]. Journal of Agricultural Science and Technology, 2014, 15(7): 1089-1094.
[24] 陳红运, 黄 峰, 陈 青, 等. 应用hiTAIL-PCR扩增转基因木瓜的侧翼序列[J]. 植物检疫, 2018, 32(5): 24-27.
[25] Ley T J, Mardis E R, Ding L, et al. DNA sequencing of a cytogenetically normal acute myeloid leukaemia genome[J]. Nature, 2008, 456(7218): 66-72.
[26] Guo B F, Guo Y, Hong H L, et al. Identification of genomic insertion and flanking sequence of G2-EPSPS and GAT transgenes in soybean using whole genome sequencing method[J]. Frontiers in Plant Science, 2016, 7: 1009.
[27] 仲晓芳, 杨 静, 贺红利, 等. 基于基因组重测序分析的高含量油酸转基因大豆事件外源T-DNA旁侧序列分析及事件特异性PCR检测[J]. 农业生物技术学报, 2018, 26(12): 2017-2026.
[28] 马 阔, 仲晓芳, 牛 陆, 等. 耐盐转基因大豆事件FA8015旁侧序列分离及定性PCR检测[J]. 大豆科学, 2018, 37(6): 854-859.
[29] 刘东波, 邢国杰, 赵倩倩, 等. 抗病毒转基因大豆事件外源T-DNA序列分析及定性检测[J]. 大豆科学, 2020, 39(1): 23-29.
[30] 徐纪明, 胡 晗, 毛文轩, 等. 利用重测序技术获取转基因植物T-DNA插入位点[J]. 遗传, 2018, 40(8): 676-682.
[31] 冯翠莲, 张树珍. 抗虫转基因甘蔗的培育及其抗性丧失的防控策略[J]. 生物技术通报, 2020, 36(7): 209-219.
[32] 王关林, 方宏筠. 植物基因工程[M]. 2版. 北京: 科学出版社, 2002: 744.
[33] 崔学强, 张树珍, 沈林波, 等. 转基因甘蔗植株Southern杂交体系的优化[J]. 生物技术通报, 2015, 31(12): 105- 109.
[34] 2019年全球转基因观察[EB/OL]. (2020-01-17) [2020- 08-28]. http://cn.agropages.com/News/NewsDetail 20390.htm.
[35] Zhang J, Zhang X, Tang H, et al. Allele-defined genome of the autopolyploid sugarcane Saccharum spontaneum L.[J]. Nature Genetics, 2018, 50(S1): 1565-1573.
[36] Marmiroli N, Maestri E, Gulli M, et al. Methods for detection of GMOs in food and feed[J]. Analytical and Bioanalytical Chemistry, 2008, 392(3): 369-384.
责任编辑:黄东杰
