橡胶树前纤维蛋白(profilin)基因家族的鉴定及表达分析
2021-11-08邓治李德军
邓治 李德军


摘 要:肌动蛋白细胞骨架可能在橡胶树乳管伤口堵塞过程中发挥重要作用。前纤维蛋白(profilin)是肌动蛋白动态平衡的重要调节子,但对橡胶树profilin基因家族系统研究的报道较少。通过分析橡胶树基因组和轉录组数据,鉴定到6个橡胶树profilin基因,对其基本特性及蛋白保守基序、结构特征、进化关系和表达模式等进行分析。基因结构分析表明,橡胶树profilin基因都包含3个外显子2个内含子,编码的蛋白序列含有profilin蛋白特有的保守基序KYMVIQGE和VIRGKKG。进化分析显示,橡胶树profilin并未严格分为营养型和生殖型2种类型。profilin蛋白二级结构以无规则卷曲为主,三级结构均包含3个α螺旋和7个β折叠。表达分析结果显示,4个profilin基因在胶乳中高表达,橡胶树排胶和碘化钾处理调控这4个profilin基因表达,推测profilin基因参与橡胶树排胶过程。该研究结果为进一步阐明橡胶树profilin基因在乳管伤口堵塞和排胶中的作用奠定基础。
关键词:前纤维蛋白基因家族;橡胶树;排胶;表达分析
中图分类号:S794.1 文献标识码:A
Identification and Expression Analysis of profilin Gene Family in Hevea brasiliensis
DENG Zhi, LI Dejun*
Rubber Research Institute, Chinese Academy of Tropical Agriculture Sciences / Key Laboratory of Biology and Genetic Resources of Rubber Tree, Ministry of Agriculture and Rural Affairs / State Key Laboratory Incubation Base for Cultivation and Physiology of Tropical Crops, Haikou, Hainan 571101, China
Abstract: Actin cytoskeleton might play an important role in laticifer wound plugging of Hevea brasiliensis. Although profilin is a vital regulator in actin dynamics, there is still no systematic study on profilin gene family in Hevea brasiliensis. In this study, six profilin genes were identified from the genome and transcriptome of Hevea brasiliensis. The six genes were analyzed in details, including gene basic characteristics, conserved protein motifs, structure features, evolutionary relationships, and expression profiles. Gene structure analyses demonstrated that the six profilin genes contained three exons and two introns. Conserved domain analyses indicated that the six profilin proteins possessed unique motifs of profilin protein, KYMVIQGE and VIRGKKG motifs. Evolutionary analyses showed that Hevea profilins were not strictly divided into vegetative and reproductive subclasses. The main secondary structures of profilin proteins were random coil and tertiary structures consist of three α helices and seven β turns. Expression analyses showed that four profilin genes were highly expressed in latex, and regulated by latex flow and potassium iodide treatment, suggesting that profilin genes might be involved in latex flow. These results would lay a foundation for further elucidating profilin roles in laticifer wound plugging and latex flow of Hevea brasiliensis.
Keywords: Profilin gene family; Hevea brasiliensis; latex flow; expression analysis
DOI: 10.3969/j.issn.1000-2561.2021.09.002
微丝是细胞骨架的重要组分,肌动蛋白单体是构成微丝的基本单位。真核细胞的肌动蛋白细胞骨架可通过快速动态重组来响应胞内外信号,从而调控许多重要的细胞过程,例如胞质流动[1]、细胞器运动、细胞形态建成、细胞分裂和分化[2]、顶端生长[3]、病原菌[4]、胁迫[5]和激素[6]响应等。肌动蛋白结合蛋白(actin binding protein,ABP)通过提高或抑制肌动蛋白的聚合来调节肌动蛋白动态重组[2]。植物ABP由多个基因家族构成,其中前纤维蛋白(profilin)是表达量较高的一个ABP家族。Profilin分子量为12~16 kDa[7],是一种高度保守的肌动蛋白单体结合蛋白。动物细胞中profilin具有2种不同的功能,一方面,profilin结合G-actin,阻止肌动蛋白自发成核,抑制微丝聚合[8]。另一方面,profilin可促进ATP/ADP交换,将G-actin-ATP定位到能提高肌动蛋白装配的微丝正端,促进单体结合到微丝上使微丝生长[9]。此外,profilin还能与磷酸肌醇[10]、poly-L-脯氨酸[11]和Arp2-3复合体[12]结合。综上所述,profilin在肌动蛋白动力学中扮演着关键角色,为肌动蛋白细胞骨架重排与多种细胞过程中的信号传导途径间提供连接。
首个植物profilin蛋白在桦树花粉过敏原中发现[13],随后在拟南芥、水稻、杨树、玉米和橡胶树等植物中也发现profilin的存在。植物profilin与非植物profilin蛋白氨基酸序列一致性為25%左右,植物profilin同样具有抑制微丝聚合的作用,但目前未发现植物profilin能促进核苷酸ATP/ADP交换的功能[14]。高等植物profilin可分为营养型和生殖型2类[15-16],如营养型的拟南芥PRF1、PRF2和PRF3几乎在所有组织中都表达,生殖型的拟南芥PRF4和PRF5主要在成熟花粉中表达。profilin在植物中具有多种功能,例如在拟南芥细胞扩张过程中参与formin介导的肌动蛋白成核和纤丝装配[17],调控极性花粉管生长中顶端肌动蛋白聚合[18],参与拟南芥莲座叶和花序形态建成[19],通过负调控formin介导的肌动蛋白装配来调节PAMP触发的植物免疫[20]。棉花过表达GhPFN2基因能增强对黄萎病抗性[21]。大量研究表明profilin还是一种极具交叉反应性的植物变应原[22]。
橡胶树(Hevea brasiliensis)原产巴西亚马逊河流域,其产生的胶乳是目前天然橡胶最重要的来源。有研究表明肌动蛋白微丝骨架可能在橡胶树乳管伤口堵塞、产胶和死皮等过程中发挥重要作用[23-25]。作为肌动蛋白微丝骨架重要调节子的profilin在橡胶树中的研究报道较少。2001年Ganglbergera首次克隆了1个橡胶树profilin基因,该基因表达的蛋白是胶乳过敏原Hev b 8[26]。2011年笔者克隆了另一个橡胶树profilin基因,并对其进行生物信息学分析[27]。本研究利用橡胶树基因组和转录组数据鉴定橡胶树profilin家族基因,并对其基本特性及蛋白结构特征、进化关系和表达模式等进行分析,该研究结果为进一步阐明橡胶树profilin基因在乳管伤口堵塞和排胶中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 本研究所用材料为中国热带农业科学院试验农场种植的橡胶树品系‘热研7-33-97。将3%碘化钾(KI)溶液涂抹在7年生未开割橡胶树幼树割面上、下2 cm范围内,用黑色塑料布包裹避光,分别于处理后0、6、24、48 h采集胶乳。选取10年生橡胶树,采集割胶后0~5 min、>5~35 min、>35 min至停止排胶3个时间段的胶乳,分别记为T1、T2和T3。所有样品经液氮冷冻后置于–80 ℃保存备用。
1.1.2 试剂 通用植物总RNA提取试剂盒购自北京百泰克生物技术有限公司;反转录试剂盒RevertAidTM First Strand cDNA Synthesis购自Thermo Scientific公司;荧光定量PCR试剂TB Green? Premix Ex Taq?(Tli RNaseH Plus)为宝生物工程(大连)有限公司产品。引物合成由广州英骏生物公司完成。
1.2 方法
1.2.1 橡胶树profilin基因家族的鉴定 橡胶树profilin基因的筛选方法如下,在橡胶树数据库HeveaDB(http://hevea.catas.cn/home/index)中搜索profilin序列,筛选出注释为profilin的相关基因。在NCBI数据库(http://www.ncbi.nlm.nih.gov/)中将拟南芥profilin基因序列与橡胶树转录组数据进行BLAST比对,筛选出与拟南芥profilin基因同源的序列。将2种方法筛选得到的profilin基因序列进行比对去除冗余序列,利用pfam数据库(http://pfam.xfam.org/)分析橡胶树profilin蛋白的保守结构域,确定橡胶树profilin基因序列。利用DNAMAN软件进行序列比对。根据橡胶树profilin的基因组序列和转录组序列确定内/外含子数目和位置。
1.2.2 橡胶树profilin蛋白特性及结构分析 利用在线软件ProtParam (https://web.expasy.org/ protparam/)预测橡胶树profilin蛋白的理化性质。利用PSORT (https://psort.hgc.jp/)在线预测橡胶树profilin蛋白的亚细胞定位。通过SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线预测橡胶树profilin蛋白的二级结构。以拟南芥profilin蛋白的三维结构(PDB:6IQI)为模板,通过SWISS-MODEL(https://swissmodel.expasy.org/)对橡胶树profilin蛋白三级结构进行同源建模。利用PyMOL软件显示橡胶树profilin蛋白的三级结构。
1.2.3 橡胶树profilin蛋白进化分析 在NCBI和Phytozome网站下载拟南芥、水稻、杨树、玉米、葡萄、蓖麻和麻风树的profilin蛋白氨基酸序列,结合橡胶树profilin蛋白序列,利用MEGA软件中的邻接法构建系统进化树。
1.2.4 橡胶树profilin基因家族组织表达分析 在橡胶树数据库HeveaDB(http://hevea.catas.cn/ home/index)中下载6个橡胶树组织的RNA-Seq数据,对橡胶树profilin基因的组织表达量进行归一化/标准化处理,用R软件中的pheatmap函数绘制基因表达热图。
1.2.5 qRT-PCR分析 根据橡胶树profilin基因家族组织表达的结果,选取胶乳中高表达的4个橡胶树profilin基因,设计qRT-PCR引物。由于橡胶树profilin基因家族保守性较高,引物设计尽量避开保守结构域。以橡胶树18S rRNA基因(GenBank登录号AB268099)作为内参基因。本研究所用引物序列见表1。qRT-PCR反应体系为20 μL。反应参数为94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火20 s,72 ℃延伸20 s,共反应40个循环。每样品均为3次重复。基因相对表达量采用2-ΔΔCT计算。
2 结果与分析
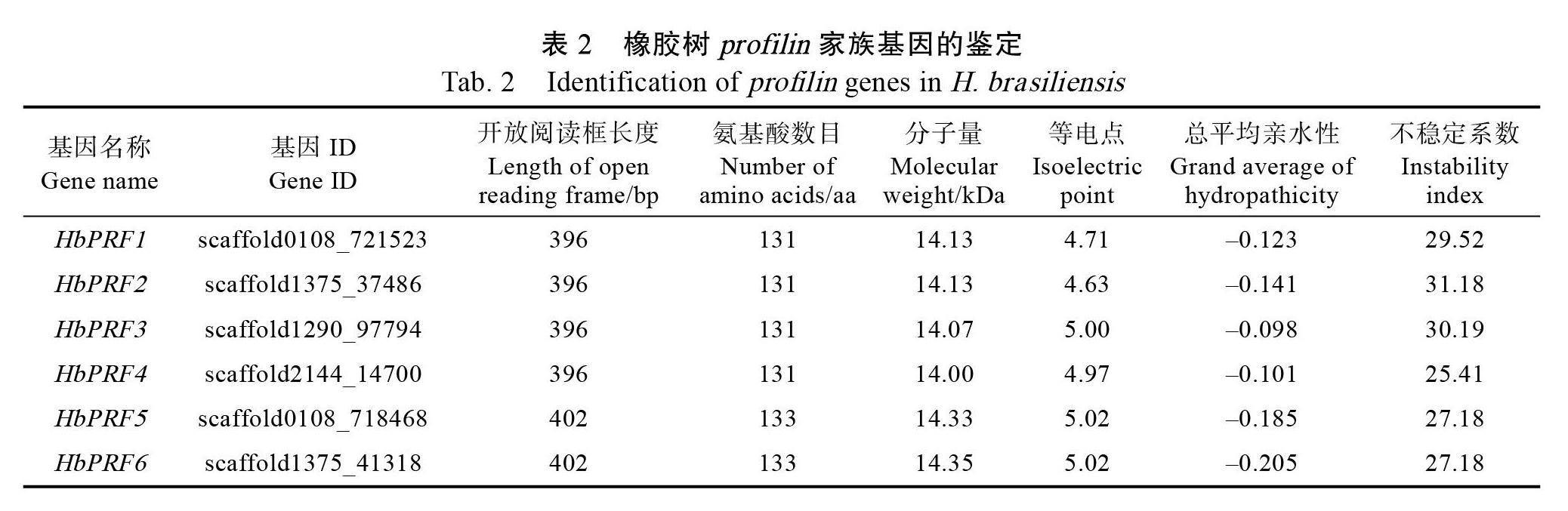
2.1 橡胶树profilin基因家族鉴定
对橡胶树基因组和转录组数据进行比对,结合profilin蛋白保守结构域分析,最后确定6个橡胶树profilin家族基因,命名为HbPRF1~HbPRF6(表2)。橡胶树profilin家族基因ORF长度为396 bp或402 bp,编码氨基酸长度为131或133个氨基酸,蛋白分子量为14.00~14.35 kDa,等电点范围为4.63~5.02。6个橡胶树profilin蛋白均为亲水蛋白和稳定蛋白。蛋白序列比对显示6个橡胶树profilin蛋白高度保守,含有profilin的保守基序KYMVIQGE、VIRGKKG、LAPTG、PGQCN、MSWQ、GDYL、YVD、KKT和AAI,其中KYMVIQGE和VIRGKKG为profilin特有基序(图1)。基因结构分析显示6个橡胶树proflin基因都包含3个外显子和2个内含子(图2)。蛋白质亚细胞定位表明6个橡胶树profilin蛋白均定位于细胞质。
横线表示profilin蛋白的保守基序。
蓝色方框表示外显子,黑色线条表示内含子。
2.2 橡胶树profilin蛋白高级结构预测分析
为进一步研究橡胶树profilin蛋白空间结构特性,对橡胶树profilin蛋白进行二级结构预测(表3)。6个橡胶树profilin蛋白都以无规则卷曲为主,其中无规则卷曲比例为35.34%~41.98%,α螺旋比例为22.14%~30.83%,延伸链比例为23.31%~25.19%,β折叠比例为6.87%~10.69%。对蛋白三级结构进行分析,6个橡胶树profilin蛋白的三级结构相似,均包含3个α螺旋和7个β折叠(图3)。上述蛋白结构预测结果说明6个橡胶树profilin蛋白结构高度保守。
2.3 植物profilin蛋白进化关系分析
为研究橡胶树profilin蛋白的进化关系,使用MEGA软件构建橡胶樹与拟南芥、水稻等植物profilin蛋白家族系统进化树。根据进化树的分支(图4),可将植物profilin蛋白家族分为2个亚AtPRF1~AtPRF5: Arabidopsis thaliana (AAB39480.1, AAB39481.1, Q9FE63.2, AAB39477.1, AAB39479.1); OsPRF1~OsPRF2: Oryza sativa (BAD69332.1, AAK92580.1); ZmPRF1~ZmPRF6: Zea mays (CAA51718.1, CAA51719.1, CAA51720.1, AAB86960.1, AAG35601.1, ONM38364.1);PtPRF1~PtPRF3: Populus trichocarpa (XP_002304225.1, XP_002299743.1, XP_011000942.1); VvPRF1~VvPRF4: Vitis vinifera (XP_002274966.3, XP_002283450.1, XP_002283490.1, XP_010656249.1); JcPRF1~JcPRF3: Jatropha curcas (NP_001295719.1, XP_012069066.1, XP_012076840.1); RcPRF1~RcPRF3: Ricinus communis (XP_002514199.1, XP_002515952.1, XP_002514198.1); CcPRF: Colletotrichum chlorophyti (OLN95629).族,拟南芥营养型的AtPRF1、AtPRF2和AtPRF3聚为一个亚族,HbPRF1~HbPRF6与拟南芥生殖型的AtPRF4和AtPRF5等植物profilin蛋白聚为另一个亚族。其中HbPRF1和HbPRF2与麻风树PRF1和蓖麻PRF1聚为一支,HbPRF3和HbPRF4与麻风树PRF3和蓖麻PRF2聚为一支,HbPRF5和HbPRF6与拟南芥生殖型的AtPRF4和AtPRF5等聚为一支。值得注意的是,单子叶植物profilin蛋白聚为一支,其中营养型和生殖型profilin分别聚为2个亚支。说明profilin蛋白进化早于单、双子叶植物分化,橡胶树profilin蛋白与同为大戟科的麻风树和蓖麻亲缘关系较近。
2.4 橡胶树profilin基因家族的表达分析
2.4.1 HbPRFs的组织表达模式 由图5可知,HbPRF1和HbPRF2在所有检测的组织中均有较高的表达,其中胶乳中表达量最高;HbPRF3在所有检测组织中几乎不表达;HbPRF4在所有检测组织中均表达,其中胶乳中表达量最高,叶片中表达量最低;HbPRF5在雄花中表达量最高,胶乳中几乎不表达;HbPRF6在叶片中表达量最低,在胶乳中表达量最高。上述结果表明,6个橡胶树profilin基因中有4个在胶乳中表达量最高,说明这4个profilin基因可能在胶乳中发挥重要作用。
2.4.2 HbPRFs在不同排胶时间的表达模式 微丝细胞骨架在橡胶树排胶过程中具有重要作用。根据HbPRFs组织表达分析结果,选择HbPRF1、HbPRF2、HbPRF4和HbPRF6等4个在胶乳中高表达的基因,进一步研究其排胶相关处理条件下的表达模式。结果显示(图6),HbPRF1随着排胶时间延长表达量逐渐上调,HbPRF2、HbPRF4和HbPRF6等3个基因在T2排胶时间段表达量下调,T3排胶时间段上调表达。其中HbPRF2在T3排胶时间段中的表达量高于T1排胶时间段。而HbPRF4和HbPRF6在T3排胶时间段中的表达量稍低于T1排胶时间段。说明HbPRF1、HbPRF2、HbPRF4和HbPRF6等4个基因的表达与橡胶树排胶有关。
2.4.3 KI处理下HbPRFs的表达模式 由图7可知,微丝解聚剂KI处理可诱导HbPRF1、HbPRF2、HbPRF4和HbPRF6基因表达,HbPRF4最高表达量出现在处理后48 h,约为0 h表达量的14倍。其余3个HbPRFs的最高表达量都出现在KI处理后24 h。上述结果提示,HbPRF1、HbPRF2、HbPRF4和HbPRF6等4个基因可能参与橡胶树胶乳中KI调控微丝解聚过程,其中HbPRF4与碘化钾引起的微丝解聚最为相关。
3 讨论
基因组测序技术的高速发展使得全面筛选和鉴定重要的基因家族成为可能。profilin基因家族是一个古老且普遍存在功能分化的家族,调节生物细胞发育的各个方面。本研究利用橡胶树基因组和转录组数据结合生物信息学系统分析,鉴定到6个橡胶树profilin基因,说明橡胶树profilin基因家族成员数量与其他植物类似,如拟南芥有5个profilin基因[15, 19],玉米有6个profilin基因[14]。Profilin蛋白序列中的KYMVIQGE和VIRGKKG为其独有的保守基序,此外还包括8個3~5位氨基酸的保守基序[28]。序列分析发现除HbPRF6中AAI基序变为ASI序列外,其余橡胶树profilin蛋白序列均含有上述保守基序。基因结构分析显示橡胶树profilin基因均由3个外显子和2个内含子组成。蛋白结构分析显示橡胶树profilin蛋白二级结构都以无规则卷曲为主,三级结构均包含3个α螺旋和7个β折叠。值得注意的是HbPRF5和HbPRF6一致性虽然很高(97.76%),但在胶乳和叶片中的表达模式出现明显差异,HbPRF5蛋白的AAI保守基序在HbPRF6中变为ASI序列,仅这1个氨基酸的差异,可能会造成这2个蛋白功能的差异。
为研究橡胶树profilin蛋白的进化关系,对橡胶树与拟南芥、水稻等植物profilin蛋白进行进化分析。结果显示双子叶植物拟南芥的profilin蛋白分为营养型和生殖型2个亚族。橡胶树profilin蛋白与拟南芥生殖型profilin蛋白聚为一个亚族,在该亚族中HbPRF1和HbPRF2聚为一支,HbPRF3和HbPRF4聚为一支,HbPRF5和HbPRF6与拟南芥生殖型的AtPRF4和AtPRF5聚为一支,单子叶植物profilin蛋白聚为一支。说明profilin作为一个古老的蛋白进化发生在双子叶和单子叶物种分化之前,这与Pandey等[28]结果一致。蛋白进化分析结果显示橡胶树profilin并未严格分为营养型和生殖型2种类型,组织表达结果与进化分析结果一致,橡胶树profilin基因没有在营养型和生殖型组织中存在特异性或显著性差异表达,表明橡胶树profilin蛋白进化过程较复杂,这可能与橡胶树次生代谢产物——胶乳中肌动蛋白发挥重要和特殊的功能有关。
根据细胞所处的不同状态,profilin具有两种相反的功能,既能调控肌动蛋白聚合过程也能调控肌动蛋白解聚过程。虽然目前对植物profilin是否具有促进ATP/ADP交换的功能仍有争议[14],但研究发现与植物profilin结合的肌动蛋白单体可以添加到肌动蛋白丝的正端,促进G-肌动蛋白聚合为微丝[9]。拟南芥profilin下调导致F-肌动蛋白数量下降,顶端分生组织中肌动蛋白丝紊乱[18]。排胶时间是决定橡胶树胶乳产量的一个重要限制因素,乳管伤口堵塞物形成的速度决定着排胶时间的长短。微丝细胞骨架在橡胶树乳管堵塞过程中具有重要作用[23-25]。割胶后5 min的橡胶树割面的乳管伤口末端出现蛋白质,随着排胶进行乳管伤口末端的蛋白质逐渐积累。当排胶终止时蛋白质大量积累在乳管伤口末端形成一个网状结构[25, 29]。该蛋白质网起到堵塞乳管和保护乳管伤口的作用[29]。随着排胶的进程肌动蛋白在割胶后的乳管伤口末端逐渐聚集。橡胶树排出的胶乳中肌动蛋白含量逐渐减少,说明胶乳中的肌动蛋白可能在排胶过程中逐渐截留在乳管伤口处[23]。本研究发现,虽然HbPRF2表达在排胶中期稍有下调,但排胶末期与排胶初期时相比HbPRF1和HbPRF2的表达明显上调。说明排胶过程中HbPRF1和HbPRF2上调可能促进微丝逐渐聚合,这与排胶过程中肌动蛋白逐渐截留在乳管伤口末端的结果相符,说明profilin在橡胶树乳管堵塞过程中可能发挥重要作用。本研究发现KI处理导致微丝解聚的同时也引起橡胶树profilin基因上调表达。KI处理导致微丝快速解聚[30],可能造成细胞内G-肌动蛋白大量积累,为维持胞内肌动蛋白动态平衡,profillin与G-肌动蛋白形成复合体,封存G-肌动蛋白,从而抑制微丝的聚合,但还需进一步的实验验证。
4 結论
本研究对橡胶树profilin基因家族成员进行了基本特性及蛋白结构特征、进化关系和表达模式等进行分析。结果表明profilin基因在橡胶树排胶过程中发挥重要作用。本研究为后续橡胶树profilin基因在乳管伤口堵塞和排胶中的作用研究奠定基础。
参考文献
[1] Nick P. Signals, motors, morphogenesis: the cytoskeleton in plant development[J]. Plant Biology, 1999, 1(2): 169-179.
[2] Lappalainen P. Actin-binding proteins: the long road to understanding the dynamic landscape of cellular actin networks[J]. Molecular Biology of the Cell, 2016, 27(16): 2519-2522.
[3] Qu X L, Jiang Y X, Chang M, et al. Organization and regulation of the actin cytoskeleton in the pollen tube[J]. Frontiers in Plant Science, 2014, 5: 786.
[4] Porter K, Day B, Biology C M, et al. From filaments to function: The role of the plant actin cytoskeleton in pathogen perception, signaling and immunity[J]. Journal of Integrative Plant Biology, 2016, 58(4): 299-311.
[5] Hafke J B, Ehlers K, F?ller J, et al. Involvement of the sieve element cytoskeleton in electrical responses to cold shocks[J]. Plant Physiology, 2013, 162(2): 707-719.
[6] Lanza M, Garcia-Ponce B, Castrillo G, et al. Role of actin cytoskeleton in brassinosteroid signaling and in its integration with the auxin response in plants[J]. Developmental Cell, 2012, 22(6): 1275-1285.
[7] Rodríguez del Río P, Díaz-Perales A, Sánchez-García S, et al. Profilin, a change in the paradigm[J]. Journal of Investigational Allergology and Clinical Immunology, 2018, 28(1): 1-12.
[8] Yarmola E G, Bubb M R. Profilin: emerging concepts and lingering misconceptions[J]. Trends in Biochemical Sciences, 2006, 31(4): 197-205.
[9] Perelroizen I, Didry D, Christensen H, et al. Role of nucleotide exchange and hydrolysis in the function of profilin in action assembly[J]. Journal of Biological Chemistry, 1996, 271(21): 12302-12309.
[10] Lassing I, Lindberg U. Specific interaction between phosphatidylinositol 4,5-bisphosphate and profilactin[J]. Nature, 1985, 314(6010): 472-474.
[11] Archer S J, Vinson V K, Pollard T D, et al. Elucidation of the poly-L-proline binding site in Acanthamoeba profilin-I by NMR spectroscopy[J]. FEBS Letters, 1994, 337(2): 145-151.
[12] Mullins R D, Heuser J A, Pollard T D. The interaction of Arp2/3 complex with actin: nucleation, high affinity pointed end capping, and formation of branching networks of filaments[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(11): 6181-6186.
[13] Valenta R, Duchêne M, Pettenburger K, et al. Identification of profilin as a novel pollen allergen; IgE autoreactivity in sensitized individuals[J]. Science, 1991, 253(5019): 557-560.
[14] Kovar D R, Dr?bak B K, Staiger C J. Maize profilin isoforms are functionally distinct[J]. The Plant Cell, 2000, 12(4): 583-598.
[15] Huang S, McDowell J M, Weise M J, et al. The Arabidopsis profilin gene family.(Evidence for an ancient split between constitutive and pollen-specific profilin genes)[J]. Plant Physiology, 1996, 111(1): 115-126.
[16] Kandasamy M K, McKinney E C, Meagher R B. Plant profilin isovariants are distinctly regulated in vegetative and reproductive tissues[J]. Cell Motillity and the Cytoskeleton, 2002, 52(1): 22-32.
[17] Zhang S, Liu C, Wang J J, et al. A processive Arabidopsis formin modulates actin filament dynamics in association with profilin[J]. Molecular Plant, 2016, 9(6): 900-910.
[18] Liu X N, Qu X L, Jiang Y X, et al. Profilin regulates apical actin polymerization to control polarized pollen tube growth[J]. Molecular Plant, 2015, 8(12): 1694-1709.
[19] Müssar K J, Kandasamy M K, McKinney E C, et al. Arabidopsis plants deficient in constitutive class profilins reveal independent and quantitative genetic effects[J]. BMC Plant Biology, 2015, 15: 177.
[20] He S, Qiao Z, Chua K P, et al. Profilin negatively regulates formin-mediated actin assembly to modulate PAMP-tri-ggered plant immunity[J]. Current Biology, 2018, 28(12): 1882-1895.
[21] Wang W Y, Sun Y D, Han L B, et al. Overexpression of GhPFN2 enhances protection against Verticillium dahliae invasion in cotton[J]. Science China Life Science, 2017, 60(8): 861-867.
[22] Valenta R, Duchene M, Ebner C, et al. Profilins constitute a novel family of functional plant pan-allergens[J]. Journal of Experimental Medicine, 1992, 175(2): 377-385.
[23] 高政權, 孟春晓, 吴继林, 等. 巴西橡胶树乳管肌动蛋白细胞骨架与采胶的关系[J]. 热带作物学报, 2003, 24(3): 22-26.
[24] 高政权, 郝秉中. 植物细胞骨架在橡胶树产胶和排胶中的可能作用[J]. 海南师范学院学报(自然科学版), 2001, 14(2): 23-25.
[25] Shi M J, Li Y, Deng S N, et al. The formation and accumulation of protein-networks by physical interactions in the rapid occlusion of laticifer cells in rubber tree undergoing successive mechanical wounding[J]. BMC Plant Biology, 2019, 19(1): 8.
[26] Ganglbergera E, Radauera C, Wagnera S, et al. Hev b 8, the Hevea brasiliensis latex profilin, is a cross-reactive allergen of latex, plant foods and pollen[J]. International Archives of Allergy and Immunology, 2001, 125(3): 216-227.
[27] 李德军, 刘向红, 邓 治. 巴西橡胶树Profilin基因克隆及生物信息学分析[J]. 中国农学通报, 2011, 27(30): 187-191.
[28] Pandey D K, Chaudhary B. Evolutionary expansion and structural functionalism of the ancient family of profilin proteins[J]. Gene, 2017, 626: 70-86.
[29] Hao B Z, Wu J L, Meng C X, et al. Laticifer wound plugging in Hevea brasiliensis: The role of a protein-network with rubber particle aggregations in stopping latex flow and protecting wounded laticifers[J]. Journal of Rubber Research, 2004, 7(4): 281-299.
[30] Nagy B, Jencks W P. Depolymerization of F-Actin by concentrated solutions of salts and denaturing agents[J]. Journal of the American Chemical Society, 1965, 87: 2480-2488.
責任编辑:黄东杰
