夏枯草对胶质瘤U87细胞凋亡与增殖的影响❋
2021-11-04郑慧军
杜 康, 曹 勇, 刘 彪, 谢 磊, 郑慧军
(1.河南中医药大学, 郑州 430052;2.河南中医药大学第二附属医院神经外科,郑州 430052)
胶质瘤是颅内发病率最高的恶性肿瘤,主要治疗方式为手术、放化疗[1],但患者5年生存率仍然较低,且副作用较大。已有报道,夏枯草对乳腺癌、甲状腺癌、食管癌等多种恶性肿瘤具有良好的治疗作用[2,3],但对胶质瘤的治疗作用尚无研究。本实验拟考察夏枯草溶液对胶质瘤U87细胞增殖与凋亡的影响。本研究已通过河南中医药大学实验动物伦理委员会审查。
1 材料与方法
1.1 药物
夏枯草配方颗粒,购自四川新绿药业有限公司(5 g/盒)
1.2 肿瘤细胞及实验动物
胶质瘤U87细胞(以下简称瘤细胞)购自上海中国科学院细胞库。雄性小鼠裸鼠,4周龄,购自南京医科大学动物中心。实验前所有裸鼠(BALB/cA-nu)在无病毒(SPF)环境中饲养,室温为26 ℃~28 ℃(78~820F),相对温度保持在40%~60%,每日约维持10 h光照,14 h无光的明暗周期,提供无菌食物和水(所有操作均在无菌条件下进行)。动物实验开始之前,将裸鼠(BALB/cA-nu)按体质量随机分为模型组、夏枯草低、中和高剂量组,在新的环境中饲养1周。
1.3 试剂
MEM培养基(博士德生物科技有限公司);Phosphate Buffered Saline(Biological Industries);胎牛血清(Biological Industries);青链霉素双抗混合液(Beijing Solarbio);CCK-8试剂盒(上海同仁化学科技有限公司);凋亡试剂盒(凯基生物);BCA蛋白测定盒(武汉博士德生物技术有限公司);Bax、Bcl-2、Cleaved-Caspase-3、Cleaved-Caspase-9、Ki-67单克隆抗体均购自武汉三鹰生物技术有限公司;PCR逆转录试剂盒(大连宝生生物工程有限公司);mRNA提取试剂盒(上海生工生物有限公司);Bcl-2、Bax、Caspase-3及Caspase-9的引物均委托上海生工生物有限公司合成。
1.4 实验仪器
CO2恒温培养箱(HERAcell160i-美国Thermo Scientific HERAcell160i CO2培养箱);流式细胞仪(美国BD FACSJazz);超微量核酸蛋白测定仪(中国One Drop 公司 Nano Drop One/One C);酶标仪(赛默飞世尔(上海)仪器有限公司 318C);基因扩增仪(美国BIO-RAD公司 T100);蛋白凝胶成像系统(BIO RAD Industries ChemiDoc XRS)。
1.5 实验方法
1.5.1 夏枯草溶液的制备 将10 g夏枯草配方颗粒溶于20 ml MEM培养基中超声波震荡15 min,4 ℃ 1200 r/min离心10 min,保留上清液,以0.22 μm孔径的无菌滤器过滤,-20 ℃层冻存,夏枯草浓度约为40 mg/ml(生药/ml)。
1.5.2 胶质瘤U87细胞培养 将胶质瘤U87细胞放入恒温培养箱(37 ℃、5%CO2)中培养12 h,以胰酶消化并离心,按1×106个细胞密度接种于25 cm2培养瓶中,加入MEM培养液(含10%胎牛血清,1%青链霉素双抗混合液)4 ml,放入恒温培养箱中培养(37 ℃、5%CO2),待胶质瘤U87细胞长满瓶底进行传代(约每48~72 h传1次),取对数生长期的胶质瘤U87细胞进行实验。
1.5.3 胶质瘤U87细胞分组 将胶质瘤U87细胞接种在96孔板中,将其分为6组,每组设6个复孔。对照组正常培养液培养;夏枯草低、中和高剂量组将夏枯草溶液采用培养液进行稀释,使得每孔的终浓度分别为0.5 mg/ml、1 mg/ml、2 mg/ml。
1.5.4 平板克隆实验检测夏枯草药物对细胞增殖的影响 将胶质瘤U87细胞按照每孔800个细胞接种于6孔板,加入夏枯草低、中和高剂量,5%CO2,37 ℃的培养箱中培养14 d,结晶紫溶液染色后于显微镜下行各组细胞集落计数。
1.5.5 CCK-8检测夏枯草药物毒性对细胞增殖的影响 将胶质瘤U87细胞按照每孔1×104个细胞接种于96孔板,5%CO2,37 ℃的培养箱中培养24 h,向96孔板中加入夏枯草低、中和高剂量溶液,每个浓度设6个复孔。24 h后每孔中加入10 μl CCK-8溶液,10 min后分别用酶标仪检测各组在450 nm处的吸光度值。
1.5.6 显微镜下对胶质瘤U87细胞生长状态观察 各组细胞培养加药干预24 h后,倒尽培养基,采用PBS洗2遍,常温干燥,采用75%乙醇固定,5%结晶紫溶液染色2 h,显微镜下观察,计数各组细胞聚集成团的个数,≥50个细胞为1个细胞集落。
1.5.7 流式细胞仪检测U87细胞凋亡率 各组细胞培养加药干预24 h后,用不含EDTA的0.25%胰酶消化,按照每管1×105~5×105个细胞,收集至2 ml离心管中,2000r/min离心5 min,加入1.5 ml PBS液洗涤细胞,2000r/min离心5 min,重复上述洗涤操作2遍。依次加入500 μl的Binding Buffer悬浮细胞、5 μl Annexin V-FITC、5 μL Propidium lodide混匀。室温下避光反应5~15 min,反应完成后在1 h内完成流式细胞仪对各组胶质瘤U87细胞凋亡率的检测。
1.5.8 RT-PCR检测胶质瘤U87细胞凋亡基因的表达 细胞加药干预24 h后,提取细胞总RNA,测定细胞总RNA浓度及纯度。对RNA进行逆转录:以1 μg RNA合成的cDNA,以GAPDH作为内参基因,分别扩增Bcl-2、Bax、Caspase-3、Caspase-9基因。当基因扩增反应结束时,从65 ℃缓慢加热至95 ℃,将PCR溶解产物的溶解曲线建立。采用2-△△CT相对定量法,计算各组基因的表达情况,同时对各组数据进行进行统计分析。
1.5.9 Western Blot检测凋亡相关蛋白 各组细胞培养加药干预24 h后,提取细胞总蛋白,蛋白定量、配置蛋白胶,蛋白上样电泳,蛋白转膜后进行封闭,抗体孵育。孵育完成后,将蛋白膜放入ECL发光液中摇动3 min,利用Image Lab系统进行曝片,以GAPDH作为内参,检测各组Bcl-2、Bax、Cleaved-Caspase-3、Cleaved-Caspase-9凋亡相关蛋白表达。
1.5.10 小鼠皮下成瘤模型建立、给药及指标检测 将4周大的雄性小鼠裸鼠(BALB/cA-nu)按体质量随机分为模型组、夏枯草低、中和高剂量组4组,分别为1.8 g/kg组、3.6 g/kg组、5.4 g/kg组每组各4只。将U87细胞(每侧1×106细胞/100μl)皮下注射到小鼠侧腹。接种后每隔1 d按组别给小鼠灌胃给药,给药容积为0.1 ml/10 g,对照组灌胃给予生理盐水。每6 d测量肿瘤大小,持续30 d(给药15 d)。使用公式(width2×length)/2计算肿瘤体积。30 d后对小鼠实行安乐死取皮下瘤,行Ki-67免疫组化染色,Ki-67染色阳性细胞百分率即为增殖指数。
1.6 统计学方法
2 结果
2.1 夏枯草对瘤细胞增殖的影响
图1示,与对照组比较,夏枯草组的瘤细胞集落数量减少、活性降低(P<0.05),且呈剂量依赖性降低,说明夏枯草可抑制瘤细胞增殖。

注:A.平板克隆实验;B.细胞集落数量;C.CCK-8检测;NC.对照组;1.夏枯草低剂量组;2.夏枯草中剂量组;3.夏枯草高剂量组;与对照组比较:*P<0.05;与夏枯草低剂量组比较:%P<0.05;与夏枯草中剂量组比较:&P<0.05
2.2 夏枯草对瘤细胞生长状态的影响
图2示,对照组瘤细胞成团约2~3个,夏枯草低剂量组成团约0~1个,夏枯草中及高剂量组均未见成团,随着夏枯草剂量增加,细胞数量有减少趋势,表明夏枯草可抑制瘤细胞增殖。
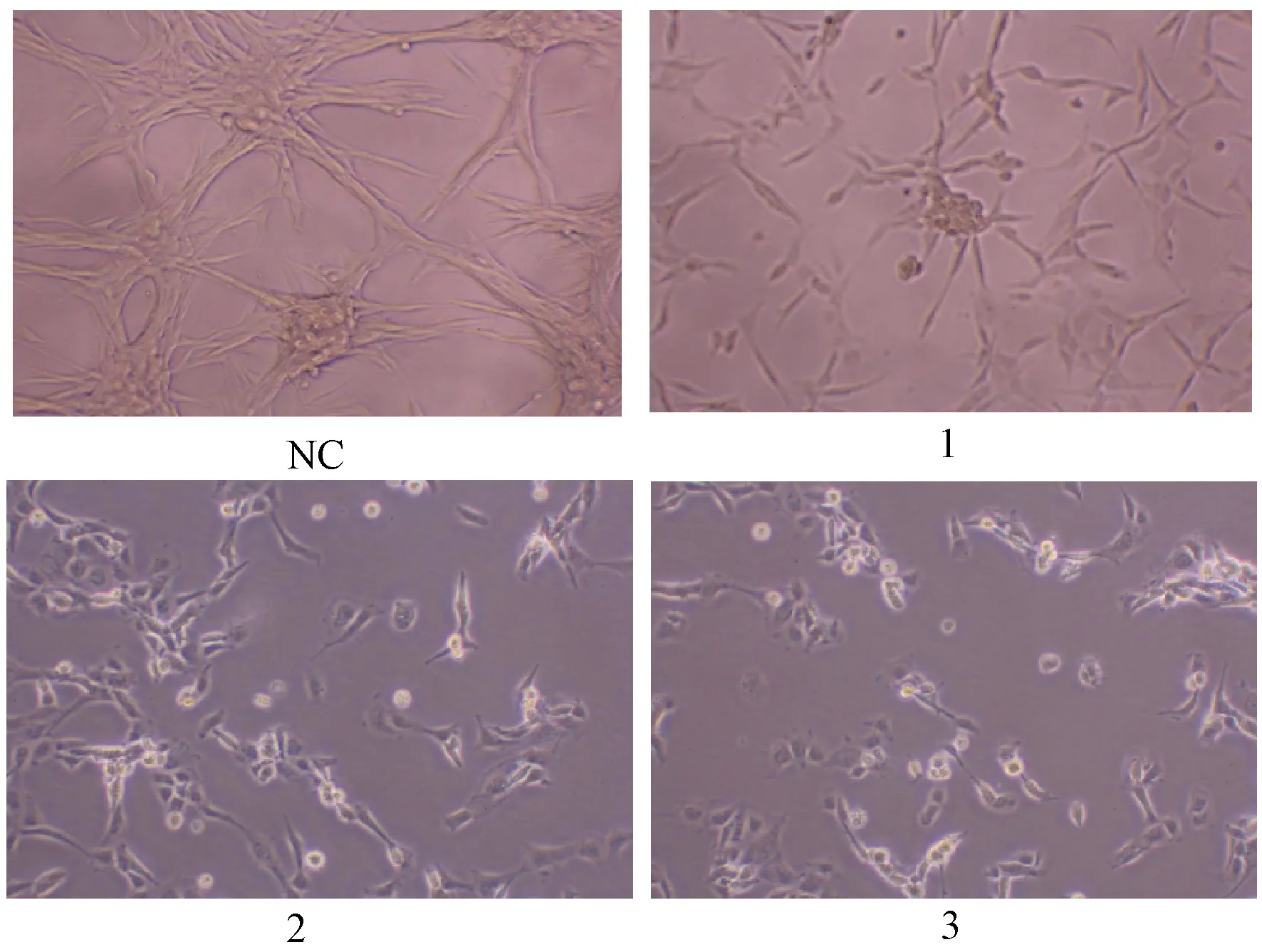
注:NC.对照组;1.夏枯草低剂量组;2.夏枯草中剂量组;3.夏枯草高剂量组
2.3 流式细胞术检测夏枯草诱导瘤细胞凋亡
图3示,与对照组比较,夏枯草组的凋亡细胞数增多(P<0.05),且剂量呈依赖性增高趋势。
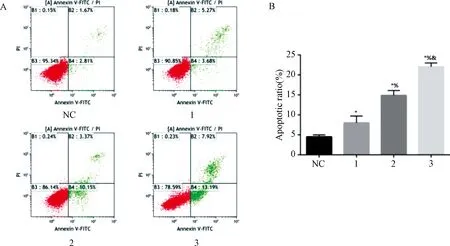
注:与对照组比较:*P<0.05;与夏枯草低剂量组比较:%P<0.05;与夏枯草中剂量组比较:&P<0.05;NC.对照组;1.夏枯草低剂量组;2.夏枯草中剂量组;3.夏枯草高剂量组
2.4 夏枯草对Bax、Bcl-2、Caspase-3(Cleaved-Caspase-3)、Caspase-9(Cleaved-Caspase-9)及Bcl-2表达的影响
图4示,与对照组比较,夏枯草组的Bax mRNA及蛋白、Caspase-3、Caspase-9 mRNA、Cleaved-Caspase-3、Cleaved-Caspase-9蛋白表达均增加,Bcl-2 mRNA及蛋白表达均降低(P<0.05),且呈剂量依赖性趋势。夏枯草溶液可调节凋亡相关因子,如Bax、Cleaved-Caspase-3、Cleaved-Caspase-9及Bcl-2表达促进瘤细胞凋亡。
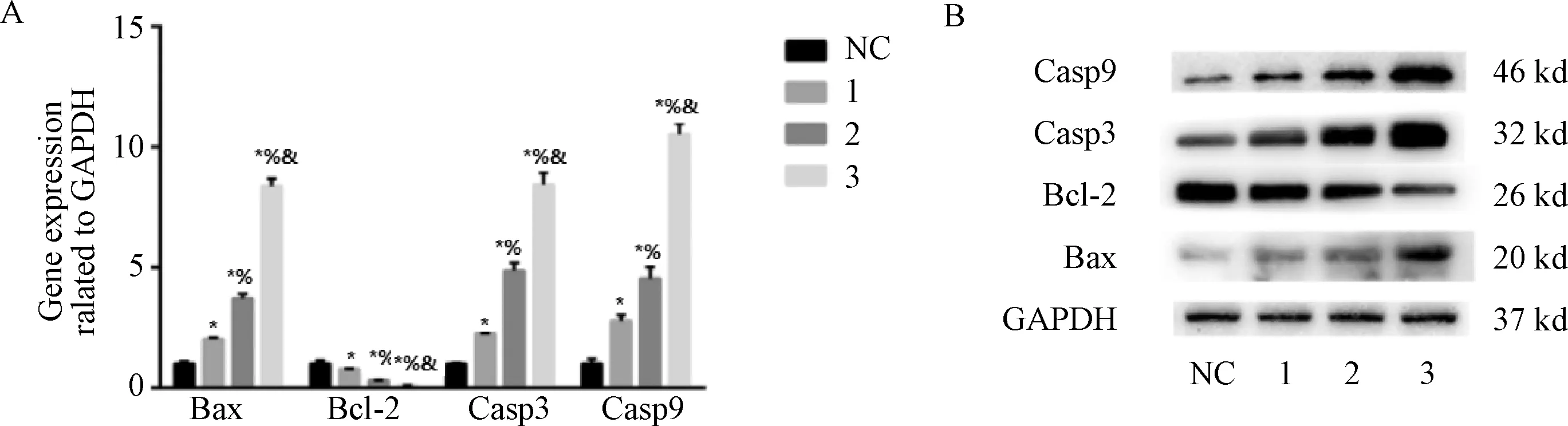
注:与对照组比较:*P<0.05;与夏枯草低剂量组比较:%P<0.05;与夏枯草中剂量组比较:&P<0.05;NC.对照组;1.夏枯草低剂量组;2.夏枯草中剂量组;3.夏枯草高剂量组
2.5 夏枯草对在小鼠皮下成瘤的抑制作用
图5示,与模型组比较,夏枯草组皮下瘤体积均降低,皮下瘤Ki-67表达及增殖指数均降低(P<0.05),且呈剂量依赖性降低趋势。

注:与对照组比较:*P<0.05;与夏枯草低剂量组比较:%P<0.05;与夏枯草中剂量组比较:&P<0.05;MODEL.模型组;1.夏枯草低剂量组;2.夏枯草中剂量组;3.夏枯草高剂量组
3 讨论
夏枯草通过促进癌细胞凋亡,抑制癌细胞的增殖与迁移,达到对多种恶性肿瘤的抗癌效果[4]。本研究分别以瘤细胞及该细胞接种的裸鼠为研究对象,结果显示夏枯草可抑制胶质瘤细胞及瘤组织的增殖,均呈剂量依赖性关系,也印证了文献的观点。
夏枯草的抗癌机制较复杂[5,6],一是夏枯草提取物可以通过P53通路促进畸胎瘤细胞的凋亡,抑制其增殖;二是夏枯草可提高结肠癌细胞对氟尿嘧啶的敏感性,提高结肠癌细胞的凋亡率;三是夏枯草的乙醇提取液可以促进结肠癌细胞的凋亡,抑制胶质瘤细胞的增殖。本实验将瘤细胞与夏枯草低、中和高剂量共培养24 h,夏枯草组的瘤细胞集落数量逐渐减少,细胞活性降低,凋亡细胞数增多,凋亡相关基因Bax、Caspase-3、Caspase-9 mRNA表达增加,抗凋亡基因Bcl-2 mRNA表达降低,凋亡相关基因Bax、Cleaved-Caspase-3、Cleaved-Caspase-9蛋白表达均增加,Bcl-2 蛋白表达降低,均呈夏枯草剂量依赖性趋势。小鼠皮下瘤体积试验示,与模型组比较,夏枯草组皮下瘤体积均降低,皮下瘤Ki-67表达及增殖指数均降低,提示夏枯草可用于治疗胶质瘤,与其所含的有效成分相关[7-9]。如夏枯草含有大量β-谷甾醇、豆甾醇、菠甾醇及槲皮素且均有明确的抗癌效果,其口服生物利用度≥36%;夏枯草所含的齐墩果酸可调节Caspase-3途径或抑制MAPK/ERK 信号通路,抑制颅内胶质瘤增殖、迁移和侵袭。
文献报道,将夏枯草注射液用于治疗临床恶性肿瘤患者,提示夏枯草口服难以通过血脑屏障[10]。刘泰[11]等将夏枯草纳入传统方剂五苓散中,夏枯草具有保护血脑屏障及消除脑血管源性水肿等效果,提示夏枯草有效成分可穿越血脑屏障。尽管本研究显示,夏枯草灌胃给药可降低小鼠皮下成瘤的体积,抑制促瘤蛋白Ki-67表达及增殖指数,尚无明确数据证实胶质瘤血脑屏障对夏枯草发挥抗癌效果。
夏枯草通过调控Bax mRNA及蛋白、Bcl-2 mRNA及蛋白、Caspase-3 mRNA、Caspase-9 mRNA、Cleaved-Caspase-3、Cleaved-Caspase-9表达抑制胶质瘤U87细胞增殖,促进凋亡,且呈夏枯草剂量依赖性趋势。
