巴西橡胶树转录中介体HbMed25基因克隆与表达分析
2021-10-16张世鑫吴绍华杨署光晁金泉李招娣田维敏
张世鑫 吴绍华 杨署光 晁金泉 李招娣 田维敏


摘 要:转录中介体(mediator,Med)中的Med25基因在植物的组织发育、器官发生、胁迫响应以及调控茉莉酸(JA)信号途径等方面起重要调控作用。该文在巴西橡胶树基因组序列中找到了橡胶树Med25基因的序列,通过RT-qPCR和RACE技术克隆HbMed25基因的全长序列并进行生物信息学预测分析结果显示,HbMed25基因包含2 655 bp的开放阅读框,编码884个氨基酸,蛋白分子量为95 kD,理论等电点为8.68,疏水性蛋白,亚细胞定位最可能为细胞核。Real-time PCR分析结果显示,HbMed25基因在树皮中表达量最高,在植物激素JA处理的形成层和胶乳材料中HbMed25基因在处理早期(1 h和2~4 h)上调表达,受割胶处理HbMed25基因在处理早期上调表达且对高产的橡胶树品系(CATAS 8-79和CATAS 7-33-97)的割胶处理响应更明显。综上结果认为,HbMed25基因极大可能参与了JA信号途径的调控,对阐明JA诱导橡胶树次生乳管分化的分子调控机制具有促进作用。
关键词:巴西橡胶树,HbMed25,表达分析,茉莉酸信号途径,乳管分化,橡胶合成
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2021)09-1548-13
Abstract:The Med25 gene in the transcription mediator (Med)plays an important regulatory role in many processes,such as tissue development,organogenesis,stress response,and regulation of jasmonate acid(JA)signaling pathway in plants. The Med25 gene sequence was found in the genome of Hevea brasiliensis,and the full-length sequence of HbMed25 gene was cloned by RT-qPCR and RACE technology,and the biological information was predicted and analyzed. The results were as follows:The HbMed25 gene included an open reading frame for 2 655 bp,encoded 884 amino acids,the molecular weight was 95 kD and theoretical isoelectric point was 8.68,hydrophobic protein,and most likely localized in the nucleus in subcellular localization analysis. Real-time PCR analysis results showed that HbMed25 was the most highly expressed in the bark; HbMed25 was up-regulated at the early stage of treatment (1 h and 2-4 h)in the cambium and latex treated by the plant hormone of JA. After tapping,HbMed25 had the highest expression at the early stage of tapping treatment,and up-regulates expression in high-yield rubber clones(CATAS 8-79 and CATAS 7-33-97). All the results indicate that HbMed25 is highly likely to participate in the regulation of the JA signal pathway,and it plays a role in promoting the molecular regulation mechanism of JA-induced secondary laticifer differentiation.
Key words:Hevea brasiliensis,HbMed25,expression analysis,jasmonate signaling pathway,laticifer differentiation,rubber synthesis
中介體复合物(mediator,Med)在植物不同组织发育、花期、花的结构、植物抗逆性等方面具有重要作用。例如:Med8、Med17、Med18、Med20A可以调控植物的花期(Kim et al.,2011);Med18、Med21参与植物响应生物逆境胁迫(Dhawan et al.,2011);Med16参与植物对非生物的逆境响应(Wathugala et al.,2011)。在众多的Med成员中,Med25的研究相对较多且对基因功能的了解更详细。AtMed25可调控拟南芥中光敏色素信号的PFTI (Wollenberg et al.,2007; Backstrom et al.,2011),在植物响应逆境胁迫过程中具有显著作用(Elfving et al.,2011)。AtMed25的缺失突变体植株细胞体积变大、细胞数目增加,导致植物的器官体积增大;过量表达AtMed25的植株细胞体积变小、细胞数目变少,导致植物器官体积减小。可见,AtMed25可以调控植物细胞的增殖速度和体积大小,是植物器官体积大小的负调控因子(Xu & Li,2011)。Chen et al.(2012)发现Med25与抗逆相关的茉莉酸(jasmonate acid,JA)信号途径有密切联系,AtMed25通过与AtMYC2直接相互作用使RNA聚合酶Ⅱ招募到AtMYC2 的靶标启动子区域来调控茉莉酸响应基因表达,之后又发现Med25参与调控茉莉酸信号途径的关键环节COI1-JAZ-MYC2。在植物处于自然状态下,Med25与JAZ蛋白是竞争关系,竞争结合MYC2的结合位点,Med25与MYC2间的相互作用相对较弱;Med25还与JA受体COI1直接发生相互作用,将COI1招募到茉莉酸途径的核心转录因子MYC2的靶标基因启动子区域。植物发育或应对逆境胁迫时,产生活性茉莉酸(JA-Ile),Med25促进依赖于活性形式茉莉酸的“COI1-JAZ”受体复合物的形成,引起JAZ蛋白的降解,使Med25与MYC2的相互作用增强,MYC2由转录抑制转变为转录激活,招募RNA聚合酶Ⅱ等转录机器,激活茉莉酸下游的响应基因的表达(Chen et al.,2012; Zhai & Li,2019; Wu et al.,2019)。
天然橡胶(natural rubber)是四种重要的工业原料和战略物资之一,世界上99%的天然橡胶来自巴西橡胶树(Hevea brasiliensis)(祁栋灵等,2012)。巴西橡胶树的乳管是天然橡胶合成和贮存的地方,与天然橡胶产量直接相关的是树干树皮中的次生乳管(郝秉中和吴继林,1982;Hao & Wu,2000)。乳管由维管形成层细胞分化而来,是一种特化的分泌组织。维管形成层细胞分化成次生乳管的过程,称为次生乳管分化。我们前期研究发现割胶、机械伤害和茉莉酸类物质都可以诱导橡胶树的次生乳管分化(Hao & Wu,2000;刘惠芳等,2001;Wu et al.,2002;Zhang et al.,2015;Tian et al.,2015),并建立了一套稳定的体外诱导橡胶树萌条次生乳管分化的实验系统。我们前期还发现橡胶树的乳管细胞中存在特定的茉莉酸信号通路HbCOI1-HbJAZ3-HbMYC2,其通过上调法尼基焦磷酸合酶(FPS)基因和小橡胶粒子蛋白(SRPP)基因的表达增强天然橡胶生物合成(Deng et al.,2018)。因此,我们提出调节橡胶树次生乳管分化和橡胶生物合成的茉莉酸信号途径可能是乳管细胞的一条主要信号途径,并且推测植物中介体Med25在JA信号途径中起重要的调控作用。
模式植物中Med25的研究较多,其功能被越来越多地揭示出来。然而,橡胶树中Med25的研究相对滞后。本文克隆了巴西橡胶树的Med25基因,通过Real-time PCR技术分析其在组织特异性、茉莉酸处理的形成层和胶乳样品以及不同植物激素处理的胶乳样品中的基因表达,为揭示Med25参与茉莉酸信号途径调控橡胶树次生乳管分化和橡胶生物合成的分子调控机理提供理论依据。
1 材料與方法
1.1 HbMed25基因的克隆
HbMed25基因的开放阅读框(ORF)信息来自巴西橡胶树无性系CATAS 7-33-97基因组测序结果(Tang et al.,2016),得到的基因序列信息经过Blast比对后,设计ORF引物扩增出基因开放阅读框并测序确认。
引物序列HbMed25-OF为5′-ATGGCGGAGAAGCAGCTGGT-3′,HbMed25-OR为5′-TTAACTCATAAATCCACCTCCAGGC-3′。使用橡胶树无性系CATAS 7-33-97的胶乳cDNA作为模板,进行PCR扩增HbMed25基因的全长cDNA。PCR程序:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,循环35 次;72 ℃延伸20 min;16 ℃终止反应。PCR产物通过1%的琼脂糖凝胶电泳检测,回收并纯化目的条带,连接转化到pEASY-Blunt Simple载体上,挑取阳性单克隆,使用M13引物进行菌落PCR筛选,选取插入DNA片段正确的阳性单克隆,送到广州天一测序公司进行测序,以确定克隆基因cDNA序列的准确性。
1.2 同源性分析和系统进化分析
通过NCBI ORF finder工具对获得的HbMed25基因序列进行ORF预测和确定,使用DNAMAN 7.0软件将ORF序列翻译为相应的氨基酸序列,并进行序列同源性比对;使用NCBI Conserved Domains工具和SMART工具获取HbMed25蛋白的保守结构域信息;使用ExPASy网站的ProtParam、ProtScale 和TMpred Server等工具进行HbMed25蛋白的理化性质、亲疏水性以及跨膜结构的推测;使用The predicted NLS进行氨基酸序列的核定位信号的预测;使用SWISS-MODEL工具对HbMed25蛋白的三级结构进行预测。
通过JGI网站Phytozome工具检索到来源于陆生植物和藻类的65个Med25的蛋白序列。本文将橡胶树HbMed25蛋白序列和其他陆生植物和藻类的65个Med25的蛋白序列进行系统进化分析,使用MEGA 6软件绘制Neighbor joining系统进化树,并进行1 000 bootstrap的统计学检测。
1.3 组织特异性表达
所用材料为巴西橡胶树无性系CATAS 7-33-97的开割成龄树和一年生萌条,均种植在中国热带农业科学院试验场三队基地。同一时间采集同一棵橡胶树的侧根、幼茎、稳定期叶片、雌花、种仁(外胚乳)、树皮、萌条的形成层区和胶乳等样品进行组织特异性表达,每个样品均来自3棵树样品的混合。采集胶乳样品时,弃去前1 min流出的胶乳,取割胶后2~5 min流出的胶乳,胶乳直接在1.5 mL RNase free离心管中与裂解液SL(TIANGEN RNAprep Pure PlantKit,DP441)以胶乳与裂解液的体积比为1∶5进行混合,置于冰上,立即提取总RNA 或-80 ℃保存备用;其他组织样品采集后,液氮速冻,液氮研磨后提取总RNA 或-80 ℃保存备用。
1.4 割胶处理
一天时间中橡胶树的韧皮部组织膨压在凌晨时段最高,割胶后的排胶动力最大,随后在一天中逐步降低,到了晚上逐步恢复(Buttery & Boatman,1966)。凌晨时环境温度低,能够降低黄色体破裂导致的胶乳凝集,增加排胶的时间(Shi et al.,2019)。此外,橡胶生物合成关键酶基因表达还具有明显的昼夜节律性(杨鹏等,2019)。为避免割胶时间、环境温度和节律性等因素对本实验的干扰,割胶组和对照组需在同一时间进行割胶和采集胶乳。选取同一林段且割龄一致的巴西橡胶树无性系CATAS 7-33-97的开割树,分为割胶和对照两组,割胶组的橡胶树35株,在同一时间进行割胶处理后,分别在割胶后的0.5、2、6、12、24、48、72 h等时间点进行第二次割胶,采集第二次割胶的胶乳作为不同时间割胶处理的样品。对照组的35株橡胶树不进行同一时间割胶处理,仅在割胶组第二次割胶时进行割胶,采集的胶乳样品作为不同时间割胶处理的对照。每个时间点的开割树胶乳样品来自5棵树胶乳样品的混合,并采集3个生物学重复。
1.5 植物激素等化学因子处理
用单面刀片刮去面积为2 cm × 4 cm的萌条茎表皮及部分皮层,用灭菌的脱脂棉包裹处理部位,分别施加含有4 500 μg·mL-1 6-BA(对照组为灭菌水)、50 000 μg·mL-1 GA(对照组为灭菌水)、5 000 μg·mL-1 ET(对照组为灭菌水)、0.032 μg·mL-1曲古抑菌素A(trichostatin A,TSA)(对照组为5% DMSO溶液)、6.39 μg·mL-1冠菌素(coronatine,COR)(对照组为灭菌水)的溶液,利用塑料封口膜包裹,分别处理1、2、8、24、48、72、120 h,拆去脱脂棉和塑料封口膜,收集处理部位的胶乳。每个时间点的胶乳样品来自5根萌条的胶乳混合,并采集3个生物学重复。
按照同样的方法,使用6.39 μg·mL-1 COR(对照组为灭菌水)的溶液处理,分别处理0.5、1、2、8、24、48、72 h,切取处理部位的萌条树皮,通过冰冻切片和激光显微切割的方法,分离形成层区样品。每个时间点的形成层样品来自15根萌条样品的混合,并采集3个生物学重复。
1.6 Real-time PCR 分析
使用总量为1 μg的总RNA样品,参照Thermo Scientific RevertAid First Strand cDNA Synthesis Kit (K1622)的说明书,反转录合成cDNA的第一链。反转录得到的cDNA模板,稀释10倍以后,进行Real-time PCR分析。通过Bio-Rad CFX Manager 3.0的分析系统(Bio-Rad Labratories Inc,Ca,USA)进行Real-time PCR分析,以巴西橡胶树的肌动蛋白基因HbACTIN(Gene bank:JF270598)(Zhao et al.,2011)为内参基因,分析HbMed25基因在橡膠树各个组织和各种处理样品中的相对表达量。
Real-time PCR的引物序列HbMed25-QF为5′-GCAGCACCATGATTCCAACTC-3′,HbMed25-QR为5′- AGCCGAAGCACTCCTGTAAC-3′。参照TransStart Tip Green qPCR SuperMix (AQ141-04)的使用说明配制Real-time PCR的反应体系,使用Bio-rad CFX Manager 3.0配套的384孔板进行Real-time PCR的反应,每个反应配制10 μL的反应体系,成分如下:1 μL cDNA模板,0.6 μL的正向引物和反向引物,5 μL TransStart Tip Green qPCR SuperMix,用ddH2O补齐至10 μL。基因的相对表达量,使用Bio-Rad CFX Manager 3.0的分析系统自带的 2-ΔΔCT 方法进行统计。每个样品进行3次实验技术重复。
2 结果与分析
2.1 HbMed25基因的克隆和生物信息学分析
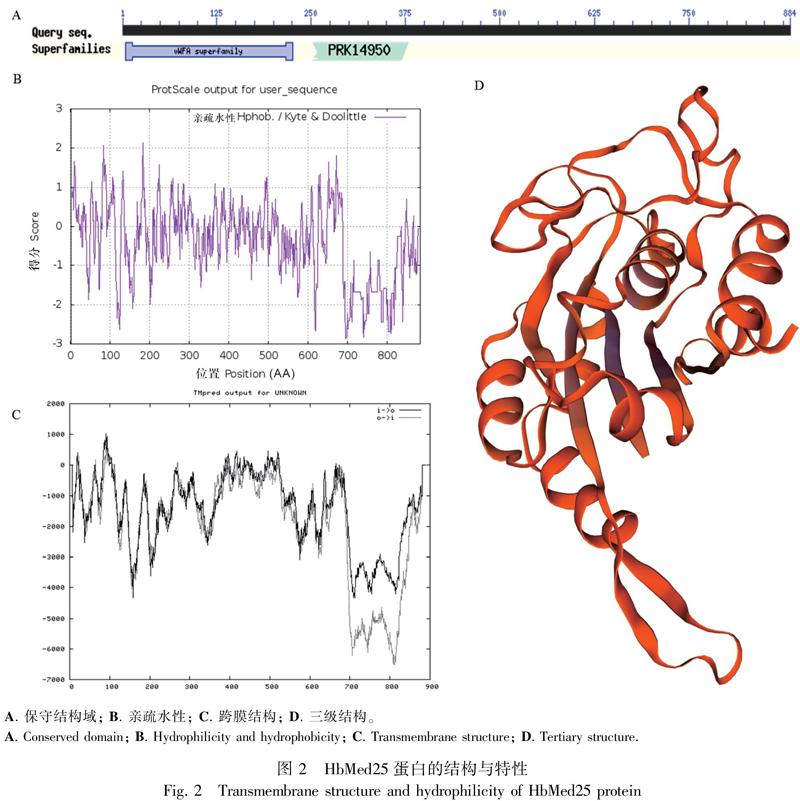
通过基因克隆及测序验证,从巴西橡胶树胶乳中扩增获得HbMed25基因的全长ORF-cDNA序列2 655 bp(图1)。使用ExPASy ProtParam在线分析工具分析HbMed25推导氨基酸序列的蛋白质理化性质,发现HbMed25氨基酸数量为884(图1),并存在Med25蛋白特有的MED25_VWA保守结构域(图2:A),相对分子量为95 kD,理论等电点8.68,HbMed25蛋白为偏碱性蛋白。HbMed25蛋白的脂肪系数为76.45,HbMed25蛋白的不稳定系数为34.83,为稳定蛋白。使用ExPASy-TMpred Server在线分析工具进行HbMed25蛋白的跨膜结构分析,发现HbMed25蛋白为亲水性蛋白(图2:B),HbMed25蛋白的总平均疏水指数均为-0.401,HbMed25蛋白没有跨膜结构(图2:C)。使用SignalP4.1 Server的神经网络算法预测蛋白质的信号肽,结果表明HbMed25蛋白可能不存在信号肽。使用WoLF PSORT在线分析工具预测HbMed25蛋白的亚细胞定位,结果表明HbMed25蛋白能够定位到细胞核且得分较高。通过The predicted NLS工具进行核定位信号预测,发现HbMed25含有较强的核定位信号,预测的核定位信号得分高达0.86分(分数范围为0~1),核定位信号序列为EKKLCA,如图3的红点所示。利用SWISS-MODEL全自动蛋白质结构同源性建模的方法,建立HbMed25的蛋白三级结构,如图2:D所示。
2.2 HbMed25基因的系统发育和同源性分析
将HbMed25推导的氨基酸序列,与其他模式植物的Med25基因所编码的氨基酸序列进行比对,结果显示HbMed25蛋白序列与拟南芥AtMed25(AT1G25540.2)、木薯MeMed25 (LOC110600417)、蓖麻RcMed25(LOC8260402)和杨树PtMed25 (PF11265)蛋白,如图4的五角星所示的序列相似性分别为61.34%、87.01%、51.91%和73.63%,且均具有Med25_VWA结构域(图3)。HbMed25蛋白与不同种类植物Med25蛋白序列一致性较高,说明该基因在植物进化过程中较保守。
使用MEGA 6软件将橡胶树HbMed25氨基酸序列和其他陆生植物和藻类的65个Med25的氨基酸序列进行系统进化分析,由图4可知,65个Med25共分为6个组别(通过不同颜色区分),这些组别主要是按照植物的进化程度进行分类,如HbMed25与拟南芥(Arabidopsis thaliana)、杨树(Populus trichocarpa)、蓖麻(Ricinus communis)、木薯(Manihot esculenta)等高等植物聚类在一起,分在第1组(Group 1)中(分别用红色和蓝色五角星形标示);黄瓜(Cucumis sativus)和胡萝卜(Daucus carota)两种植物分在第2组(Group 2);矶山耧斗菜(Aquilegia coerulea)单独在第3组(Group 3);二穗短柄草(Brachypodium distachyon)和团藻(Volvox carteri)等12种植物单分在第4组(Group 4);紫萍(Spirodela polyrhiza)单独分在第5组(Group 5);凤梨(Ananas comosus)和卷柏(Selaginella moellendorffii)等8种植物分在第6组(Group 6)。
2.3 HbMed25基因的组织特异性表达
对橡胶树无性系CATAS 7-33-97的侧根、幼茎、叶片、雌花、 种仁、开割树树皮、 开割树胶乳以及一年生萌条的形成层和初生胶乳等不同组织样品中的HbMed25基因表达进行Real-time PCR分析,结果表明HbMed25基因在开割树皮中表达丰度最高,在侧根、雌花、开割胶乳中表达丰度较高,在幼茎、叶片和胚乳中表达丰度较低(图5:A)。
在自然状态下的橡胶树一年生萌条的形成层和初生胶乳样品中的HbMed25基因表达丰度较低,差异不大(图5:B)。
2.4 割胶对HbMed25基因表达的影响
对橡胶树无性系CATAS 7-33-97的未开割树和开割成龄树的胶乳进行比较,分析割胶对HbMed25基因表达的影响。通过Real-time PCR 结果发现,HbMed25基因割胶处理的胶乳中的表达量比未开割树的虽高一些,但没有达到显著差异(图6:A)。
为进一步验证割胶对HbMed25基因的影响,通过统一时间割胶后,在不同时间内第二次割胶,收集第二次割胶的胶乳来研究橡胶树的胶乳生物合成,以消除割胶过程中机械伤害对胶乳生物合成过程中的影响。Real-time PCR结果表明,割胶处理的胶乳中HbMed25基因受割胶处理上调表达,割胶后2 h显著上调表达,在6 h时达最大值,在12 h时虽有所恢复,但仍有极显著的上调表达,直到24 h时才逐渐恢复至对照水平,整个割胶过程中对HbMed25的基因表达模式呈正向抛物线型(图6:B)。
为进一步了解割胶在橡胶树不同品系中HbMed25基因表达的变化,本文对橡胶树PPIM 600、PR 107、CATAS 7-33-97和CATAS 8-79等4个品系的未开割树进行割胶处理,每72 h割1刀,共割5刀(第0、第1、第2、第3和第4刀),采集不同刀次的胶乳,分析割胶在橡胶树不同品系中HbMed25基因表达的变化。Real-time PCR结果表明,除RRIM 600在第0刀的表达量最高,随后几刀的表达量都低于第0刀,整体呈现下调模式以外,在PR 107、CATAS 7-33-97和CATAS 8-79等3个品系的胶乳中,割胶处理的胶乳中HbMed25基因均表现出上调表达的趋势,且大致在第1刀的表达量最高,呈现上调后下调的正向抛物线型变化(图6:C-F)。
2.5 茉莉酸对HbMed25基因表达的影响
利用茉莉酸活性形式结构的类似物—冠菌素(COR)体外诱导橡胶树萌条次生乳管分化实验系统,使用COR处理橡胶树无性系CATAS 7-33-97的一年生萌条并采集处理部位的形成层区样品和初生胶乳样品。Real-time PCR结果表明,HbMed25基因在COR处理后的形成层区和初生胶乳样品中均上调表达。根据基因在形成层区和胶乳中的表达丰度、上调表达的时间点、上调表达持续时间和上调表达倍数几个指标分析,发现以下一些规律。在形成层区和初生胶乳中的表达丰度比较,HbMed25基因在形成层区中的表达丰度低于初生胶乳(图7)。HbMed25基因在COR处理的形成层样品中主要在早期时间段(1~4 h)有显著的上调表达,且在形成层材料中在1 h达最高峰值,约为对照水平的5倍,呈正向抛物线型变化(图7:A);在COR处理的初生胶乳中HbMed25在各时间段持续高水平的上调表达,且在2 h和4 h达最高峰值,为对照水平的10~20倍,也呈现正向抛物线型变化,说明COR处理可以明显上调HbMed25基因在橡胶树中的表达(图7:B)。
2.6 植物激素对HbMed25基因表达的影响
使用COR体外诱导巴西橡胶树萌条次生乳管分化类似的实验系统分析乙烯(ET)、赤霉素(GA)、生长素(IAA)、细胞分裂素(6-BA)等植物激素处理的初生胶乳样品中HbMed25的基因表达。Real-time PCR结果表明,ET处理的初生胶乳样品中,HbMed25基因最开始是下调表达,在2~8 h有明显的上调表达,且在8 h达最高峰值,随后又下調表达(图8:A)。IAA处理的初生胶乳中,HbMed25基因处于下调模式,在1、8、72 h都是极显著的下调表达,表达模式相对比较混乱,没有明显的规律(图8:B)。在GA和6-BA处理的初生胶乳中,HbMed25基因的表达模式大致相似,在整个处理时间段内都是处于下调表达,且在最早期(1 h)和中期(8~72 h)都是显著或极显著的下调表达(图8:C,D)。
根据基因在初生胶乳中的表达丰度、表达的时间点、上调表达持续时间和上调表达倍数几个指标分析,发现以下的一些表达规律。在四种植物激素处理初生胶乳中的表达丰度与COR处理相比较要低很多,与未处理的未开割树和开割树胶乳的丰度差不多;与HbMed25基因在COR处理的初生胶乳样品中整体的显著上调表达且呈正向抛物线型变化,在其他四种植物激素处理的初生胶乳中,除ET处理的初生胶乳中在前期(2~8 h)有明显上调表达外,其他植物激素处理都是下调表达,表达模式相反;与COR处理的初生胶乳中HbMed25在2 h和4 h达最高峰值,为对照水平的10~20倍,其他植物激素处理的初生胶乳中,仅ET处理的前期(2~8 h)虽有上调表达,但也未达到对照水平的2倍。可见,其他四种植物激素处理对HbMed25基因表达没有直接作用。
3 讨论与结论
本文克隆得到巴西橡胶树HbMed25基因,通过生物信息学分析发现橡胶树HbMed25与木薯、杨树等高等植物的Med25相似性较高,可能编码亲水性蛋白,亚细胞定位于细胞核,这些信息与中介体复合物作用于RNA聚合酶Ⅱ的功能是吻合的。通过组织特异性表达的结果,发现HbMed25在橡胶树的树皮、侧根和雌花中的表达丰度较高,与拟南芥(Elfving et al.,2011)、红掌(任保兰等,2019)的组织特异性研究的结果类似。这些结果是与Med25在根中可以调节活性氧分布、生长素的浓度、细胞壁基因表达等,以及调控根毛的发育过程(Xu & Li,2011);在花中可以调节花期、花的生成和花器官发育(Wollenerg et al.,2011);并调节猕猴桃的花期和果实的大小(郭洋涛等,2014)等方面发挥特殊功能是密切相关的。
天然橡胶是在巴西橡胶树树干树皮韧皮部中的特化组织——次生乳管中合成的(Hao & Wu,2000),这些次生乳管的数量与天然橡胶的产量密切相关,是由维管形成层的纺锤状原始细胞分化而来(Hao & Wu,2000)。我们前期研究的证据表明,茉莉酸(JA)(Hao & Wu,2000;刘惠芳等,2001)、机械伤害(Wu et al.,2002;Tian et al.,2015)和茉莉酸活性形式的类似物——冠菌素(COR)都可以诱导橡胶树次生乳管分化,而且COR诱导橡胶树乳管分化的效果比茉莉酸和茉莉酸甲酯(MeJA)要更强(Zhang et al.,2015)。在COR处理形成层区中,HbMed25在处理的早期表现出极显著的上调表达,且表达模式与茉莉酸处理的树皮中JAZ成员、MYC成员的相似(Zhao et al.,2011; Deng et al.,2018)。在模式植物拟南芥的JA信号转导途径中,MYC2是茉莉酸信号转导途径中的核心转录因子,调控JA反应的多个方面,包括根生长发育、机械损伤反应、抗病抗虫等逆境胁迫反应(Kim et al.,2011; Dhawan et al.,2011;Wathugala et al.,2011)。最近研究证明,AtMed25通过与AtMYC2直接相互作用,使RNA聚合酶Ⅱ招募到AtMYC2的靶标启动子区域来调控茉莉酸响应基因表达(Chen et al.,2012; Zhai & Li,2019; Wu et al.,2019)。后来又发现,Med25参与调解茉莉酸信号途径的关键环节COI1-JAZ-MYC2,在植物处于自然状态下,体内没有活性形式的茉莉酸(JA-Ile)时,JA受体COI1与抑制子蛋白JAZ不能发生互作,JAZ蛋白相对稳定,并与MYC2相互作用以抑制MYC2的转录活性。在此过程中,JAZ蛋白与Med25处于竞争关系,竞争结合MYC2的结合位点,此时的Med25与MYC2间的相互作用相对较弱;此外,Med25还可以与JA受体COI1直接发生相互作用,将COI1招募到JA的核心转录因子MYC2的靶标基因启动子区域。可见,转录中介体Med25在茉莉酸信号转导途径中起重要调控作用。据此推测Med25在JA橡胶树次生乳管分化的进程中也起重要的调控作用,而HbMed25在COR处理的早期就表现出极显著的上调表达,可以印证HbMed25参与了橡胶树体内的JA信号传导途径调控。
外施MeJA上调橡胶合成相关基因及增强橡胶合成的作用是相似的(Deng et al.,2018),并能够增加橡胶产量(杨署光等,2019)。乙烯利作为最有效的排胶刺激剂,能显著延长排胶时间,增加胶乳产量(史敏晶等,2015),但与橡胶生物合成没有直接关系(Deng et al.,2018)。割胶和JA促进橡胶树次生乳管分化和胶乳再生(郝秉中和吴继林,1982),割胶可以引起两方面的反应,即机械伤害反应和排胶导致膨压的变化。机械伤害会诱导乙烯生物合成关键酶基因ACS的表达,合成大量内源乙烯(Argueso et al.,2007),机械伤害和膨压的变化会产生内源JA(Howe & Schilmiler,2002)。目前,割胶引起胶乳产量增加是ET还是JA导致的还不甚明了。ET是一种强刺激剂,ET处理会引起诸多反应,如ET促进HEVB7、44KD蛋白等胶乳凝集因子的增加,排胶时间延长(Shi et al.,2016);ET提高水通道蛋白基因HbPIP的表达,增强水分向乳管细胞的运输,增加胶乳的水稀释效应,增加胶乳产量等(An et al.,2015)。HbMed25是转录中介体基因,可以在组织发育、器官形成、植物抗逆性等方面起重要调控作用,HbMed25很有可能参与胶乳凝集反应、水分调节等进程,但目前尚无相关研究验证。
从本文的HbMed25基因表达的模式发现,HbMed25在割胶处理胶乳中上调表达,且在产量相对较高的橡胶树品系(CATAS 8-79和CATAS 7-33-97)的膠乳中也呈现上调表达模式,因此可以看出割胶是促进HbMed25表达的。在JA活性形式结构类似物——COR处理的初生胶乳中,HbMed25在早期就表现出极显著的上调表达模式,与茉莉酸处理的胶乳样品中HbCOI1和HbJAZ1成员上调表达模式相似(Deng et al.,2018; Howe et al.,2019),而在ET处理的胶乳中HbMed25基因基本处于下调表达。从基因表达的丰度方面分析,HbMed25在割胶、COR处理胶乳中的表达丰度也远远高于ET处理。最近,我们发现割胶树的乳管细胞茉莉酸含量显著高于未开割树,割胶促进天然橡胶生物合成与激活乳管细胞中的茉莉酸信号途径密切相关(Deng et al.,2018;杨署光等,2019)。因此,我们推测割胶促进橡胶生物合成的效应大部分来自于机械伤害诱导的内源JA的功效,而非内源ET的作用。
由此可见,HbMed25是极有可能参与了橡胶树茉莉酸信号转导途径调控橡胶树的次生乳管分化和橡胶生物合成反应。下一步,我们将对Med25与JA信号途径的关键环节成员COI1-JAZ-MYC2进行蛋白互作分析,为阐明巴西橡胶树次生乳管分化和橡胶生物合成的分子调控机制打下良好基础。
参考文献:
AN F,ZOU Z,CAI XQ,et al.,2015. Regulation of HbPIP2;3,a latex-abundant water transporter,is associated with latex dilution and yield in the rubber tree (Hevea brasiliensis Muell. Arg.)[J]. PLoS ONE,10(4):e0125595.
ARGUESO CT,HANSEN M,KIEBER JJ,2007. Regulation of ethylene biosynthesis[J]. J Plant Growth Regul,26(2):92-105.
BACKSTROM S,ELFVING N,NILSSON R,et al.,2007. Purification of a plant mediator from Arabidopsis thaliana identifies PFT1 as the Med25 subunit[J]. Mol Cell,26(5): 717-729.
BUTTERY BR,BOATMAN SG,1966. Manometric measurement of turgor pressures in laticiferous phloem tissues[J]. J Exp Bot,17(2):283-296.
CHEN R,JIANG HL,LI L,et al.,2012. The Arabidopsis mediator subunit MED25 differentially regulates jasmonate and abscisic acid signaling through interacting with the MYC2 and ABI5 transcription factors[J]. Plant Cell,24(7): 2898-2916.
DENG XM,GUO D,YANG SG,et al.,2018. Jasmonate signalling in the regulation of rubber biosynthesis in laticifer cells of rubber tree,Hevea brasiliensis [J]. J Exp Bot,69(15): 3559-3571.
DHAWAN R,LUO H,FOERSTER AM,et al.,2009. HISTONE MONOUBIQUITINATION1 interacts with a subunit of the mediator complex and regulates defense against necrotrophic fungal pathogens in Arabidopsis [J]. Plant Cell,21(3):1000-1019.
ELFVING N,DAVOINE C,BENLLOCH R,et al.,2011. The Arabidopsis thaliana Med25 mediator subunit integrates environmental cues to control plant development[J]. Proc Natl Acad Sci USA,108(20):8245-8250.
GUO YT,LIN MM,QI XJ,et al.,2014. Cloning and expression analysis of AcMED25 and its relationship with fruit growth and size in kiwifruit[J]. J Fruit Sci,31(4):558-565.[郭洋濤,林苗苗,齐秀娟,等,2014. 猕猴桃 AcMED25 克隆、表达分析及其与果实生长和大小的关系[J]. 果树学报,31(4):558-565.]
HAO BZ,WU JL,2000. Laticifer differentiation in Hevea brasiliensis:induction by exogenous jasmonic acid and linolenicacid[J]. Ann Bot London,85(1):37-43.
HOWE GA,SCHILMILER AL,2002. Oxylipin metabolism in response to stress[J]. Curr opin plant boil,5(3):230-236.
KIM YJ,ZHENG B,YU Y,et al.,2011. The role of mediator in small and long noncoding RNA production in Arabidopsis thaliana[J]. EMBO J,30(5):814-822.
LIU HF,WU JL,HAO BZ,2001. Effect of jsamonic acid and other plant growth regulators on laticifer differentiation in Hevea brasiliensis[J]. Chin J Trop Crop,22(3):6-16.[刘惠芳,吴继林,郝秉中,2001. 茉莉酸和其它激素对巴西橡胶树乳管分化的协同作用[J]. 热带作物学报,22(3):6-16.]
QI DL,WANG XQ,ZHANG ZY,et al.,2013. Current situation of chinese natural rubber industry and development suggestions[J]. Chin J Trop Agric,33(2):79-87.[祁栋灵,王秀全,张志扬,等,2013. 中国天然橡胶产业现状及其发展建议[J]. 热带农业科学,33(2):79-87.]
REN BL,NIU JH,ZHANG L,et al.,2016. Cloning and expression analysis of AaPFT1/MED25 gene from Anthurium andraeanum[J]. Mol Plant Breed,14(3):554-561.[任保兰,牛俊海,张凌,等,2016. 红掌基因PFT1/MED25类基因AaPFT1的克隆与表达分析[J]. 分子植物育种,14(3):554-561.]
SHI MJ,CHENG C,TIAN WM,2015. Effects of ethrel on physiological parameters of latex flow in rubber tree clones RY8-79 and PR 107[J]. Chin J Trop Crop,36(5):926-932.[史敏晶,程成,田维敏,2015. 乙烯利刺激对橡胶树无性系RY8-79和PR 107排胶生理参数的影响[J]. 热带作物学报,36(5):926-932.]
SHI MJ,CAI FG,TIAN WM,2016. Ethrel-stimulated prolongation of latex flow in the rubber tree (Hevea brasiliensis Muell. Arg.):an Hevb7-like protein acts as a universal antagonist of rubber particle aggregating factors from lutoids and C-serum[J]. J Biochem,159(2):209-216.
SHI MJ,LI Y,DENG SM,et al.,2019. The formation and accumulation of protein-networks by physical interactions in the rapid occlusion of laticifer cells in rubber tree undergoing successive mechanical wounding[J]. BMC Plant Biol,19(1):8.
TANG CR,YANG M,FANG YJ,et al.,2016. The rubber tree genomereveals new insights into rubber production and species adaptation[J]. Nat Plants,2(6):16073.
TIAN WM,YANG SG,SHI MJ,et al.,2015. Mechanical wounding-induced laticifer differentiation in rubber tree:An indicative role of dehydration,hydrogen peroxide,and jasmonates[J]. J Plant Physiol,182:95-103.
WATHUGALA DL,RICHARDS SA,KNIGHT H,et al.,2011. OsSFR6 is a functional rice orthologue of sensitive to freezing-6 and can act as a regulator of COR gene expression,osmotic stress and freezing tolerance in Arabidopsis[J]. New Phytol,191(4):984-995.
WOLLENBERG AC,STRASSRE B,CERDAN PD,et al.,2008. Acceleration of flowering during shade avoidance in Arabidopsis alters the balance between flowering locus C-mediated repression and photoperiodic induction of flowering[J]. Plant Physiol,148(3):1681-1694.
WU FM,DENG L,ZHAI QZ,et al.,2019. Mediator subunit MED25 couples alternative splicing of JAZ genes with fine-tuning of jasmonate signaling[J]. Plant Cell,32:429-448.
WU JL,HAO BZ,TAN HY,2002.Wound-induced differentiation in Hevea brasiliensis shoots mediated by jasmonic acid[J]. J Rubber Res. 5(5):53-63.
XU R,LI YH,2011. Control of final organ size by mediator complex subunit 25 in Arabidopsis thaliana[J]. Development,138(20):4545-4554.
YANG P,ZHANG SX,CHEN HP,et al.,2015. Rhythmic expression of genes encoding enzymes for rubber biosynthesis in rubber trees[J]. Chin J Trop Crop,36(9):1587-1592.[杨鹏,张世鑫,陈惠萍,等,2015. 巴西橡胶树乳管细胞中5个橡胶合成关键酶基因节律性表达研究[J]. 热带作物学报,36(9):1587-1592.]
YANG SG,ZHAO Y,CHEN YY,et al.,2019. Correlation between the expression level of genes related to jasmonate signaling and rubber yield[J]. Guihaia,39(5):641-649.[杨署光,赵悦,陈月异,等,2019. 橡胶树茉莉酸信号途径相关基因表达与橡胶产量的相关性[J]. 广西植物,39(5):641-649.]
YOU YR,ZHAI QZ,AN CP,et al.,2019. LEUNIG_HOMOLOG mediates MYC2-dependent transcriptional activation in cooperation with the coactivators HAC1 and MED25[J]. Plant Cell,31:2187-2205.
ZHAI QZ,LI CY,2019. The plant mediator complex and its role in jasmonate signaling[J]. J Exp Bot,70(13):3415-3424.
ZHANG SX,TIAN WM,2015. Cross talk between cytokinin and jasmonates in regulating the secondary laticifer differentiation in rubber tree[J]. J Rubber Res,18(1):38-48.
ZHAO Y,ZHOU LM,CHEN YY,et al.,2011. MYC genes with differential responses to tapping,mechanical wounding,ethrel and methyl jasmonate in laticifers of rubber tree (Hevea brasiliensis Muell. Arg.)[J]. J Plant Physiol,168(14): 1649-1658.
(責任编辑 蒋巧媛)
