蒲公英耐盐突变体‘滨蒲1号’的耐盐性研究
2021-10-16陈桂平张晓东
陈桂平 张晓东


摘 要:土壤盐渍化是当今农业生产上的重要危害之一,它严重影响当地农作物的生长、发育及产量的提高。为了提高盐碱地的利用效率,该文以蒲公英耐盐突变体 ‘滨蒲1号 及其亲本叶片为材料进行丙二醛(MDA)含量等8种生理指标的测定,同时利用cDNA-RAPD技术对蒲公英耐盐突变体及其亲本根胁迫0、12、24 h的差异表达基因进行分析。结果表明:(1)突变体 ‘滨蒲1号 叶片中脯氨酸含量、叶绿素含量、可溶性蛋白含量、CAT活性、POD活性、SOD活性在不同胁迫时间点均大体高于亲本;MDA含量、相对电导率低于亲本。(2)以筛选出的 10条 RAPD 引物进行cDNA-RAPD分析,共扩增出 22 条清晰的条带,差异条带10条,多态性为45.4%。(3)扩增产物片段大小在150 ~1 000 bp之间,主要为盐抑制基因片段,推测蒲公英耐盐突变体 ‘滨蒲1号 的耐盐性既与渗透调节物质脯氨酸及多种抗氧化酶上升引起的保护作用有关,也与根中一些与耐盐相关的基因表达变化有关。该研究为进一步克隆蒲公英耐盐基因并利用基因工程手段培育耐盐优质的蒲公英新品系奠定一定的理论基础。
关键词:蒲公英,耐盐突变体,生理指标,cDNA-RAPD,差异表达基因
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2021)09-1417-08
Abstract:Soil salinization is one of main hazards in agricultural production,seriously declining growth,development and yield of local crops. In order to improve utilization efficiency of saline land,salt-tolerant mutant ‘BINPU 1. of Taraxacum mongolicum and its parents were chosen as experimental materials,and eight physiological parameters such as malondialdehyde (MDA)contents were determined,as well as analysis of differentially expressed genes in the root under saline treatments of 0,12 and 24 h through cDNA-RAPD technique. The results were as follows:(1)Except for MDA content and relative conductivity,contents of proline,chlorophyll and soluble protein,and activities of CAT,POD and SOD in leaves of the mutant ‘BINPU 1. under different saline treatments were all higher than those of the parents in general. (2)Totally 22 clear bands were amplified through cDNA-RAPD technique using 10 screened RAPD primers,of which,10 different bands were found and the polymorphism was 45.4%. (3)Fragment size of amplification product ranged from 150 to 1 000 bp,mainly consisting of fragments of salt suppressor genes,indicating that the ability of salt-tolerant mutant ‘BINPU 1. T. mongolicum was related to the protective effects caused by the increase of osmotic regulating substance such as proline and various of antioxidant enzymes activities,as well as some differentially expressed genes in roots. This study provides a theoretical support for further cloning salt-tolerant genes in T. mongolicum and breeding new salt-tolerant T. mongolicum cultivars through genetic engineering.
Key words:Taraxacum mongolicum,salt-tolerant mutant,physiological indexes,cDNA-RAPD,differentially expressed gene
土壤鹽渍化是植物的主要非生物胁迫形式,严重阻碍着农业的发展(张荣梅和马彦军,2017)。近年来随着生态环境的恶化和盲目过量的施用化肥,土壤盐渍化程度在进一步加大,筛选培育耐盐植物是开发利用盐碱地的一种有效方法。近年来植物体细胞耐盐突变体筛选研究已经成为抗盐植物育种学术研究的热点问题。前人已经在水稻、玉米、狼尾蕨等多种植物上获得耐盐细胞系的再生植株并对其耐盐机理进行了研究(马进等,2009;梁丽建等,2015)。
蒲公英 (Taraxacum mongolicum)别名蒲公草、黄花地丁、婆婆丁、黄花三七,是菊科(Asteraceae)蒲公英(Taraxacum F. H. Wigg)属多年生草本植物。蒲公英性寒味苦,具有清热解毒等功效,蒲公英的化学成分复杂,其主要活性成分是蒲公英甾醇,此外还含有绿原酸、总黄酮、咖啡酸、生物碱、多糖等,其药用价值很高,对许多致病菌均有一定的杀菌作用(沈凤阁和袁昌齐,2011)。近几年,人们充分认识到蒲公英的营养价值、医疗价值和经济价值,开始进行蒲公英的大规模栽培。蒲公英属盐生植物,适应性强,耐寒、耐热、耐酸碱、耐瘠薄性均较强。目前有关蒲公英耐盐性研究报道不多。例如,张晓辉和林辰壹(2012)研究发现蒲公英对单盐及混合盐堿胁迫均表现出一定的耐受性,适当浓度盐碱溶液胁迫有助于促进蒲公英萌发出苗,碱性盐对蒲公英出苗的胁迫作用大于中性盐。冯昕等(2013)以碳酸氢钠溶液为胁迫溶液,研究蒲公英叶片中蛋白表达的动态变化规律,发现了12个耐盐性相关的蛋白质。刘雅辉等(2017)采用盆栽试验,分析不同盐分质量分数的滨海原土对蒲公英幼苗的生长发育及体内不同部位Na+和K+质量分数及K+/Na+的影响,确定了蒲公英苗期耐盐鉴定指标为叶长,耐盐阈值为0.42%。河北省农林科学院滨海农业研究所通过无性系繁殖结合耐盐性筛选获得了耐盐突变体‘滨蒲1号,初步观察到该突变体与对照相比发生了表型的变化:叶片变宽变大、生物量增大、有效成分增加、耐盐性和抗病性增强(刘艳芬等,2018;王秀萍和鲁雪林,2019)。植物生理指标的变化与品种耐盐性之间有较高的相关性,因此研究盐胁迫下蒲公英耐盐突变体‘滨蒲1号的生理指标变化,对了解其耐盐机理非常重要。
cDNA-RAPD (cDNA-Random Amplified Polymorphic DNA)技术是以cDNA为模板进行的RAPD扩增方法,可用于进行基因差异表达的分析。该方法简便、费用低、省时省力(李鹏等,2007)。前人利用该技术在不同物种中进行了差异基因的分析,并分离和克隆了多个有价值的基因 (Mizumoto et al.,2009;Pagrivam et al.,2011)。本研究通过从生理生化和分子水平探讨耐盐突变体‘滨蒲1号的耐盐机理,为进一步克隆蒲公英耐盐基因并利用基因工程手段培育耐盐优质的蒲公英新品系奠定一定的理论基础。
1 材料与方法
1.1 试验材料
蒲公英突变体 ‘滨蒲1号及其亲本由河北省农林科学院滨海农业研究所提供。
1.2 试验方法
1.2.1 蒲公英耐盐突变体及其亲本材料的培养及盐胁迫处理
1.2.1.1 亲本材料的培养 将蒲公英种子水培,每天光照16 h,待种子生根发芽后,将幼苗移至营养土(营养土∶蛭石=3∶1)中。挑选土培两个月且生长状况良好的蒲公英耐盐突变体及其亲本进行水培两天后进行盐胁迫处理。
1.2.1.2 NaCl最佳胁迫浓度的筛选 结合Amel & Zoheir(2016)的方法初步选取NaCl浓度为120、170、220 mmol·L-1,对蒲公英植株进行72 h的胁迫,观察其生长状况,选取最佳盐浓度。
1.2.1.3 盐胁迫处理 用筛选出的最佳盐胁迫浓度的盐溶液对蒲公英进行0、2、12、24、48、72 h处理,按照不同胁迫时间取样(生理指标测定:0、2、12、24、48、72 h;根RNA提取:0、12、24 h)。样品迅速放入液氮中以便后续实验。
1.2.2 生理指标测定方法 丙二醛(MDA)含量采用硫代巴比妥酸法测定,叶绿素含量采用无水乙醇提取法结合分光光度计测定,相对电导率采用DDS-11A型电导仪测定,脯氨酸含量采用酸性茚三酮-甲苯法测定,可溶性蛋白含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性均采用试剂盒测定(购自南京建成生物工程公司)。
1.2.3 RNA提取与cDNA合成 蒲公英根总RNA的提取采用TRIZOL试剂法,用DNaseⅠ酶 (RNasefree)消化和氯仿抽提,所提取的RNA经琼脂糖凝胶检测可见条带完整,无降解现象。OD 260/280值均在1.9~2.0之间,表明RNA无污染,可用做cDNA反转录模板。反转录反应采用反转录试剂盒[FastQuant RT Kit (With gDNase)KR106,购自天根科技生化有限公司(北京)]。
1.2.4 RAPD法扩增cDNA
1.2.4.1 引物筛选 选取两个质量较好的 RNA,反转录成cDNA,稀释5倍后作为模板。对42条引物进行筛选,42条引物选自文献(李红等,2018)及北京鼎国生物公布的 520 条 RAPD引物,扩增产物在2% 琼脂糖凝胶中电泳,溴化乙锭染色,凝胶成像系统成像拍照。最终从42条随机引物中筛选出10条重复性高且清晰的引物作为PCR扩增的最适引物(表1)。
1.2.4.2 PCR扩增及电泳检测 RAPD反应体系20 μL:cDNA(反转录产物原液稀释5倍)2 μL,2 x Taq PCR MasterMix 10 μL,RAPD随机引物(10 μmol·L-1)1.6 μL,RNase Free dH2O 6.4 μL。扩增反应程序:95 ℃预变性2 min; 95 ℃变性30 s,复性30 s (温度参考表1),72 ℃延伸1min,共35个循环; 最后72 ℃延伸7 min。扩增产物在2.0%的琼脂糖凝胶上电泳分离,电压120 V,在凝胶成像系统成像,拍照记录。
2 结果与分析
2.1 最佳盐胁迫浓度筛选
将蒲公英幼苗在120、170、220 mmol·L-1 3个浓度梯度NaCl溶液中进行胁迫72 h,以在水中生长的幼苗作为对照,观察蒲公英幼苗变化情况。结果如图1:A所示,对照中3盒蒲公英幼苗长势相近,生长均较旺盛。胁迫72 h之后,120 mmol·L-1 NaCl溶液对蒲公英幼苗影响不明显,170 mmol·L-1 NaCl溶液对蒲公英幼苗有影响但不致死,220 mmol·L-1 NaCl溶液使蒲公英幼苗部分致死(图1:B)。选取对蒲公英幼苗有影响且不致死浓度为最佳胁迫浓度,将最终胁迫浓度定为170 mmol·L-1。
2.2 蒲公英耐盐突变体‘滨蒲1号及其亲本在盐胁迫下生理指标的分析
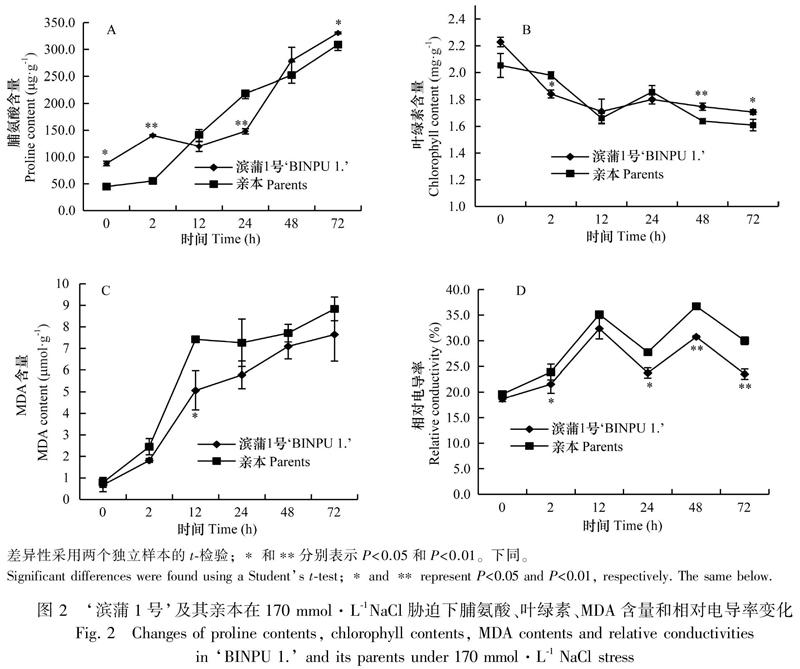
2.2.1 脯氨酸、叶绿素、MDA含量和相对电导率的分析 蒲公英耐盐突变体‘滨蒲1号和亲本经170 mmol·L-1 NaCl胁迫0~72 h各时间点所测得的脯氨酸含量结果如图2:A所示,两种样品的脯氨酸含量整体均呈上升趋势,突变体‘滨蒲1号脯氨酸含量在0 h显著高于亲本,盐胁迫2 h后极显著高于亲本,随着胁迫时间延长至12 h时有所下降,之后又开始上升,胁迫72 h时‘滨蒲1号中脯氨酸含量显著高于亲本。两种样品的叶绿素含量整体上均呈下降趋势,‘滨蒲1号的叶绿素含量在整体上高于亲本,胁迫2 h后‘滨蒲1号叶绿素含量显著低于亲本,胁迫48 h后‘滨蒲1号叶绿素含量极显著高于亲本,胁迫72 h后‘滨蒲1号显著高于亲本(图2:B)。两种样品的MDA含量均随胁迫时间延长而上升,上升的趋势为先快后慢,并且在整个盐胁迫的过程中亲本的MDA含量都高于耐盐突变体‘滨蒲1号(图2:C)。两种样品相对电导率均呈波动上升趋势,并且在整个盐胁迫的过程中亲本的相对电导率都高于耐盐突变体‘滨蒲1号(图2:D)。
2.2.2 盐胁迫下可溶性蛋白含量以及CAT、SOD、POD活性分析 蒲公英突变体‘滨蒲1号及其亲本在170 mmol·L-1 NaCl胁迫下0~72 h测得的可溶性蛋白含量结果如图3:A所示,突变体‘滨蒲1号呈波动下降趋势,亲本可溶性蛋白含量变化趋势呈先下降后上升再下降趋势,‘滨蒲1号可溶性蛋白含量在0、2、24、48和72 h时极显著高于亲本。突变体‘滨蒲1号和亲本CAT活性都是在胁迫2 h后上升到最高点之后逐渐下降,‘滨蒲1号CAT活性在盐胁迫之后(除胁迫2 h外)显著高于亲本,其他时间点均极显著高于亲本(图3:B)。突变体‘滨蒲1号和亲本SOD活性几乎呈同步波动上升趋势,但在48 h时达到最高点之后又逐渐下降,‘滨蒲1号SOD活性在盐胁迫0、2、24、48 h时极显著高于亲本,在胁迫12和72 h时显著高于亲本(图3:C)。盐胁迫下‘滨蒲1号及亲本POD活性均呈波动上升趋势,在2、12 h盐胁迫过程中,‘滨蒲1号POD活性显著高于亲本,在0、24、48、72 h盐胁迫过程中,‘滨蒲1号POD活性极显著高于亲本(图3:D)。
2.3 蒲公英耐盐突变体‘滨蒲1号及其亲本在盐胁迫下根中cDNA-RAPD分析
以筛选出的 10条 RAPD 引物对突变体‘滨蒲1号及其亲本盐胁迫0、12、24 h 的根中cDNA进行RAPD扩增分析,扩增产物片段的大小在150~1 000 bp之间,共扩增出 22 条清晰的条带,多态性条带有10条,其中2条条带为盐诱导相关基因片段,8条为盐抑制相关基因片段。多态性为45.4%。如引物U11所扩增的400 bp左右的条带在盐胁迫0 h时亲本及‘滨蒲1号表达较强,可见较亮条带,在盐胁迫12 h时二者均不表达,而在盐胁迫24 h时二者均表达,但条带较暗、表达较弱,推测为盐抑制基因片段(图4:A)。
引物I09所扩增的900~1 000 bp的条带随盐胁迫时间延长表达逐渐减弱,可能为盐抑制基因片段,而且在突变体在盐胁迫12 h时表达量受抑制程度大于亲本;引物U13所扩增的在600~700 bp之间的条带随盐胁迫时间增加表达逐渐减弱,并且突变体‘滨蒲1号的表达总是强于亲本,而且突变体在盐胁迫12 h时表达量受抑制程度大于亲本;引物U19扩增的4条为200~300 bp、600 bp左右、600~700 bp以及1 500 bp左右的条带在盐胁迫各时间段中均有表达,其中1 500 bp左右的条带随着盐胁迫时间的延长逐渐减弱,可能为盐抑制基因片段,其他3个条带均稳定表达,不受胁迫时间影响(图4:B)。
3 讨论与结论
土壤盐渍化是限制植物生长的重要因素之一。
研究盐胁迫调控机制和选育耐盐植物有利于农业生产和增产。植物受到盐胁迫后多个生理指标会发生改变。脯氨酸会迅速增加来调节细胞的渗透能力、维持膨压、保护酶和膜系统免受毒害,已有资料表明脯氨酸可以作为植物对水分胁迫或盐胁迫的一种耐性生理指标(Jaleel et al.,2007)。本研究中蒲公英耐盐突变体‘滨蒲1号脯氨酸含量在胁迫中期比亲本含量有所下降,但随着胁迫时间的延长又逐渐升高,表明盐胁迫对突变体造成的损伤更低,通过增加脯氨酸含量来调节渗透平衡,对植株在渗透胁迫下的生长起到保护作用。叶绿体是对盐胁迫最敏感的细胞器之一,Rao et al.(1981)发现盐胁迫会破坏植物叶片内的叶绿体结构,抑制叶绿素的合成或者促进叶绿素的分解,使叶绿素含量下降,引起植株光合能力降低。梁丽建等(2015)研究表明随盐浓度的增加和胁迫时间的延长狼尾蕨耐盐突变体NY-7的叶绿素含量下降幅度低于亲本。本研究中蒲公英耐盐突变体‘滨蒲1号在盐胁迫不同时间点叶绿素下降幅度均低于亲本,与梁丽建等(2015)的研究结果一致,表明其对盐分的缓冲作用较强,能更好地适应NaCl诱发的毒害环境,耐盐性高于亲本。植物受低温、盐碱等逆境伤害往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,其含量的变化常常作为脂质过氧化的生物化学指标,能够反映膜结构的损伤程度及胁迫条件下的耐性。同时逆境的伤害引起质膜的结构改变、透性增大、相对电导率增加。因此,用电导率法测定质膜的透性变化情况可作为鉴定植物抗逆性的指标(刘文竹等,2019;王旭明等,2019)。本研究中突变体‘滨蒲1号在盐胁迫不同时间所测定的MDA含量和相对电导率上升幅度均小于亲本,说明突变体‘滨蒲1号能够通过缓解质膜受损程度来提高其耐盐性。
周婵等(2009)研究认为植物的可溶性蛋白作为渗透调节物质,能提高细胞的保水能力,对细胞的生物膜起到保护作用,含量一般也会增加。植物受到盐胁迫后会产生大量的活性氧自由基从而对细胞膜产生伤害,而清除这些活性氧自由基的抗氧化酶活力也会发生变化从而维持细胞膜的稳定性。虽然随着盐浓度的增加,植物体内保护酶活性呈现升高的趋势,但当盐浓度超过一定的范围时,植物体内积累的活性氧超出了保护酶清除范围,保护酶活性会随之下降(高彩婷等,2017;白丽丽等,2019)。本研究中蒲公英耐盐突变体‘滨蒲1号受盐胁迫后可溶性蛋白含量、CAT活性、POD活性、SOD活性整体均高于亲本,而且CAT活性、SOD活性均随着胁迫时间的延长有下降的趋势,这与刘燕等(2019)认为草地早熟禾幼苗‘解放者、‘午夜2号和‘抢手股通过启动抗氧化酶系统来抵御盐胁迫的研究结论一致,说明蒲公英耐盐突变体‘滨蒲1号具有比亲本更强的酶促防御系统,能有效地清除活性氧,以确保植物体内较低的膜脂过氧化程度。总之,通过测定蒲公英耐盐突变体‘滨蒲1号盐胁迫下8种生理指标的变化,推测‘滨蒲1号耐盐性提高可能与提高渗透调节物质脯氨酸含量、叶绿素含量及多种抗氧化酶上升引起的保护作用和降低MDA含量和相对电导率等伤害作用有关,说明它能通过增加渗透调节物质,降低活性氧自由基来缓解胁迫带来的伤害,提高耐盐性。突变体‘滨蒲1号不但耐鹽性强,而且株型高大,长势旺盛,绿原酸等有效成分含量高,现已在唐山滨海地区中度以下盐碱地推广种植,具增强免疫力的蒲公英功能性饮料和功能性饲料正在开发之中。后续可在全国其他盐碱地区推广种植,为高效利用盐土资源,调整滨海盐碱区农业种植结构和农民增收探索新途径。
cDNA-RAPD分析法作为一种操作简便、成本低廉的基因表达差异分析技术,近年来国内已有多人利用该技术进行了基因差异表达分析。例如,郭磊等(2011)用10条引物分析藤稔葡萄夏芽不同发育时期相关基因的差异表达;黄守程等(2013)用9条引物初步探究了耐铝大豆的基因表达差异情况;李新梅(2006)利用 cDNA-RAPD技术建立了一套较为稳定的桑树基因差异表达的检测体系,并对桑树盐胁迫及甜菜碱处理下3种不同材料的基因差异表达进行了分析。本项目采用cDNA-RAPD技术对盐胁迫处理0、12、24 h的突变体‘滨蒲1号及其亲本根中与盐胁迫相关的差异表达基因进行分析,筛选出的10条引物cDNA-RAPD 扩增结果良好,得到了10条差异表达基因条带,其中2条为盐诱导基因片段,8条为盐抑制基因片段。由于该方法存在一定的假阳性,这些差异基因片段还需通过Northern 杂交或逆转录定量 PCR (qRT-PCR)进行重复证实。进一步克隆这些差异基因的全长并验证其在耐盐性中的功能,为挖掘蒲公英抗性基因并利用基因工程技术培育耐盐植物提供一定的依据。
参考文献:
AMEL A,ZOHEIR M,2016. Effect of salinity and water stress on the germination of Medicago arborea L. seeds[J]. J Appl Environ Biol Sci,6(2)113-121.
BAI LL,LI YL,GONG J,et al.,2019. Physiological effects of Lycium barbarum seedlings on salt stress[J]. Farm Prod Proc,4:50-56.[白丽丽,李玉龙,巩建,等,2019. 枸杞幼苗对盐胁迫的生理响应[J]. 农产品加工,4:50-56.]
FENG X,SUN H,WANG JZ,et al.,2013. 2-DE method and proteomic pattern analysis in Taraxacum mongolicum leaves under salt stress[J]. Food Sci Technol,38(5):108-111.[冯昕,孙浩,王吉中,等,2013. 盐胁迫条件下蒲公英叶片蛋白的双向电泳及其图谱分析[J]. 食品科技,38(5): 108-111.]
GAO CT,LIU JH,ZHANG YQ,et al.,2017. Physiological responses of oats seedlings to short-term salt stress[J]. Acta Agr Sin,25(2):337-343.[高彩婷,刘景辉,张玉芹,等,2017. 短期盐胁迫下燕麦幼苗的生理响应[J]. 草地学报,25(2):337-343.]
GUO L,WANG C,CAO X,et al.,2011. cDNA-RAPD analysis on genes during flower differentiation and development of the summer buds of grapevine[J]. Acta Agric Boreal-Sin,26(2):43-48.[郭磊,王晨,曹雪,等,2011. 葡萄夏芽成花过程中相关基因的cDNA-RAPD分析[J]. 华北农学报,26(2):43-48.]
HUANG SC,QIAN LS,YE MR,et al.,2013. Preliminary analysis of differentially expressed genes of Al-tolerant soybean genotype BX10 under aluminum treatment[J]. Chin J Trop Crops,34(7):1278-1281.[黄守程,钱立生,叶梅荣,等,2013. 耐铝大豆BX10铝胁迫下基因表达差异初步分析[J]. 热带作物学报,34(7):1278-1281.]
JALEEL CA,GOPI R,SANKAR B,et al.,2007. Studies on germination,seedling vigour,lipid peroxidation and proline metabolism in Catharanthus roseus seedlings under salt stress[J]. S African J Bot,73(2):190-195.
LI H,LI C,ZHANG M,2018. RAPD analysis of genetic diversity of mushroom strains[J]. Jiangsu Agric Sci,46(1):19-22.[李紅,李超,张敏,2018. 金针菇菌株遗传多样性的RAPD分析[J]. 江苏农业科学,46(1):19-22.]
LI P,MU QH,SHI YQ,et al.,2007. Screening transcript associated with V-CMS wheat using cDNA-RAPD analysis[J].
J Triticeae Crops,27(5):750-754.[李鹏,牟秋焕,石运庆,等,2007. 利用cDNA-RAPD 方法筛选与V 型小麦细胞质雄性不育育性相关的线粒体转录产物的研究[J]. 麦类作物学报,27(5):750-754.]
LI XM,2006. Metabolic physiology of glycinebetaine and molecular biology of salt-resistant response in mulberry (Morus alba L.)[D]. Suzhou:Soochow University.[李新梅,2006. 桑树甜菜碱代谢生理及抗盐反应的分子生物学研究[D]. 苏州:苏州大学.]
LIANG LJ,YE XQ,DENG YM,et al.,2015. Effect of salt stress on the growth and physiological characteristics of the salt-tolerant somatic mutants of Davallia bullata[J]. Acta Agric Univ Jiangxi (Nat Sci Ed),37(4):618-624.[梁丽建,叶晓青,邓衍明,等,2015. 盐胁迫对狼尾蕨体细胞耐盐突变体生长和生理生化特性的影响[J]. 江西农业大学学报,37(4):618-624.]
LIU WZ,LAN YQ,LUO M,et al.,2019. 6 submerged plants:The physiological response to salt stress and salt tolerance evaluation[J]. Chin Agric Sci Bull,35(12):54-62.[刘文竹,蓝于倩,骆梦,等,2019. 6种沉水植物对盐胁迫的生理响应及耐盐性评价[J]. 中国农学通报,35(12):54-62.]
LIU Y,YANG W,MA HL,et al.,2019. Effects of salt stress on seed in physiological characteristics of six kentucky bluegrass[J]. J Gansu Agric Univ,54(5):140-150.[刘燕,杨伟,马晖玲,等,2019. 盐胁迫对6种草地早熟禾幼苗生理特性的影响[J]. 甘肃农业大学学报,54(5):140-150.]
LIU YF,WANG XP,CHEN CG,et al.,2018. Screening of salt-tolerant mutants of dandelion macrophylla and plant regeneration[J]. Jiangsu Agric Sci,46(21):106-109.[刘艳芬,王秀萍,陈翠果,等,2018. 大叶蒲公英耐盐突变体的筛选与植株再生[J]. 江苏农业科学,46(21):106-109.]
LIU YH,WANG XP,ZUO YM,et al.,2017. Response of dandelion to saline stress and determination of salt-tolerance threshold at seedling stage[J]. SW Chin J Agric Sci,26 (8):1223-1229.[刘雅辉,王秀萍,左永梅,等,2017. 蒲公英苗期盐胁迫反应及耐盐阈值的确定[J]. 西北农业学报,26(8):1223-1229.]
MA J,BAO QX,TANG GG,et al.,2009. Selecting salt-tolerant mutants from somatic plant cells[J]. J Zhejiang For Coll,26(2):273-278.[马进,鲍沁星,汤庚国,等,2009. 植物体细胞耐盐突变体的研究进展[J]. 浙江林学院学报,26(2): 273-278.]
MIZUMOTO K,HATANO H,HIRABAYASHI C,et al.,2009. Altered expression of wheat AINTEGUMENTA homolog,WANT-1,in pistil and pistil-like transformed stamen of an alloplasmic line with Aegilops crassa cytoplasm[J]. Dev Genes Evol,219(4):175-187.
PAGRIVAM C,HARIKRISHNAN M,KULKARNI PA,et al.,2011. Physio-biochemical analysis and transcript profiling of Saccharum officinarum L. submitted to salt stress[J]. Acta Physiol Plant,33(4):1411-1424.
RAO GG,RAO GR,1981. Pigment composition and chlorophyllase activity in pigment pea and Gingelley under NaCl salinity[J]. Indian J Exp Biol,19(8):768-770.
SHEN FG,YUAN CQ,2011. Plant resources of the genus dandelion in China[J]. Chin Wild Plant Resour,20(3):9-14.[沈凤阁,袁昌齐,2011. 中国蒲公英属植物资源[J]. 中国野生植物资源,20(3):9-14.]
WANG XM,MAI QJ,ZHOU HK,et al.,2019. Effects of salt stress on resistance physiology of four rice germplasms[J]. J Trop Subtrop Bot,27(2):149-156.[王旭明,麦绮君,周鸿凯,等,2019. 盐胁迫对4个水稻种质抗逆性生理的影响[J]. 热带亚热带植物学报,27(2):149-156.]
WANG XP,LU XL,2019. A new variety of dandelion with high yield,high quality and salt tolerance- “BIN PU1”[J]. Xiandai Nongcui Keji,(2 ):52.[王秀萍,鲁雪林,2019. 高产、优质、耐盐蒲公英新品种-‘滨蒲1号[J]. 现代农村科技,(2):52.]
ZHANG RM,MA YJ,2017. Effect of NaCl stress on physiological characteristics of Lycium ruthenicum leaves[J]. J Gansu Agric Univ,52(4):110-117.[张荣梅,马彦军,2017. NaCl胁迫对黑果枸杞叶片生理指标的影响[J]. 甘肃农业大学学报,52(4):110-117.]
ZHANG XH,LIN CY,2012. Effects of alkali stress on seed germination of wild dandelion[J]. Chin Hortic Cult Abstr,7:10-11.[張晓晖,林辰壹,2012. Na2CO3 胁迫对野生蒲公英种子萌发的影响[J]. 中国园艺文摘,7:10-11.]
ZHOU C,ZOU ZY,YANG YF,2009. Effect of salt-alkali stress on soluble protein of Leymus chinensis[J]. J NE Norm Univ(Nat Sci Ed),41(3):94-96.[周婵,邹志远,杨允菲,2009. 盐胁迫对羊草可溶性蛋白的影响[J]. 东北师大学报(自然科学版),41(3):94-96.]
(责任编辑 周翠鸣)
