基于1H-NMR肝脏代谢组学的白芍抗抑郁作用研究
2021-10-09李添李肖田俊生高晓霞秦雪梅周玉枝
李添,李肖,田俊生,高晓霞,秦雪梅,周玉枝
(山西大学中医药现代研究中心,山西 太原 030006)
抑郁症作为一种常见的精神类疾病,以情绪低落、思维迟缓为临床表现,重度抑郁还会出现失眠,幻觉甚至有自杀行为。慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)通过温和且不可预测的模仿引起人类压力应激源来诱发动物产生抑郁行为,与人类抑郁症的发生及发展机制更接近,是目前药理实验中常见的抑郁模型之一[1]。现代研究针对该模型的研究主要集中在海马、额叶皮质和纹状体等中枢神经系统[2-3],而其对肝组织的研究也必不可少。中医理论认为治疗抑郁症应当从疏肝解郁入手,肝主疏泄且肝脏是调节情志的主要器官,肝气顺,则人体的气血运行通畅;肝气郁结,人体气血受阻[4]。因此,深入探索抑郁症对肝脏组织产生的影响对于解释抑郁症的发病机理至关重要。
白芍是毛茛科白芍属植物,酸寒收敛,养血柔肝,常与其他药味共同组成疏肝解郁复方。贺妮等[5]证明白芍提取物对抑郁症有较好的改善作用,可能是通过作用于单胺递质系统抑制炎症因子相关靶点而产生抗抑郁和抗炎作用。白芍的主要化学成分包括芍药苷、芍药内酯苷等,王景霞等[6]发现白芍提取物(芍药苷48.89 %和芍药内酯苷18.99 %)具有抗抑郁作用,对中枢单胺类神经递质有调节作用并能明显改善嗅球损毁大鼠的行为活动。然而,关于白芍是否通过调节CUMS大鼠的肝组织代谢轮廓从而发挥抗抑郁作用尚没有文献研究。
基于核磁共振技术的代谢组学,可利用动植物样本的核磁共振谱图,充分展示小分子代谢物的信息,通过对这些信息多元统计分析和模式识别处理[7],了解相关代谢物的动态变化并揭示它们对于机体整体的生物学意义。在对抑郁症CUMS模型的研究中,相比于抑郁样行为学分析,代谢组学技术更能反映内在机制[8-9]。因此本文通过行为学指标结合1H-NMR代谢组学技术来综合评价白芍对CUMS大鼠肝脏代谢轮廓的调节作用,从而揭示其抗抑郁的作用机理,实验流程见图1。
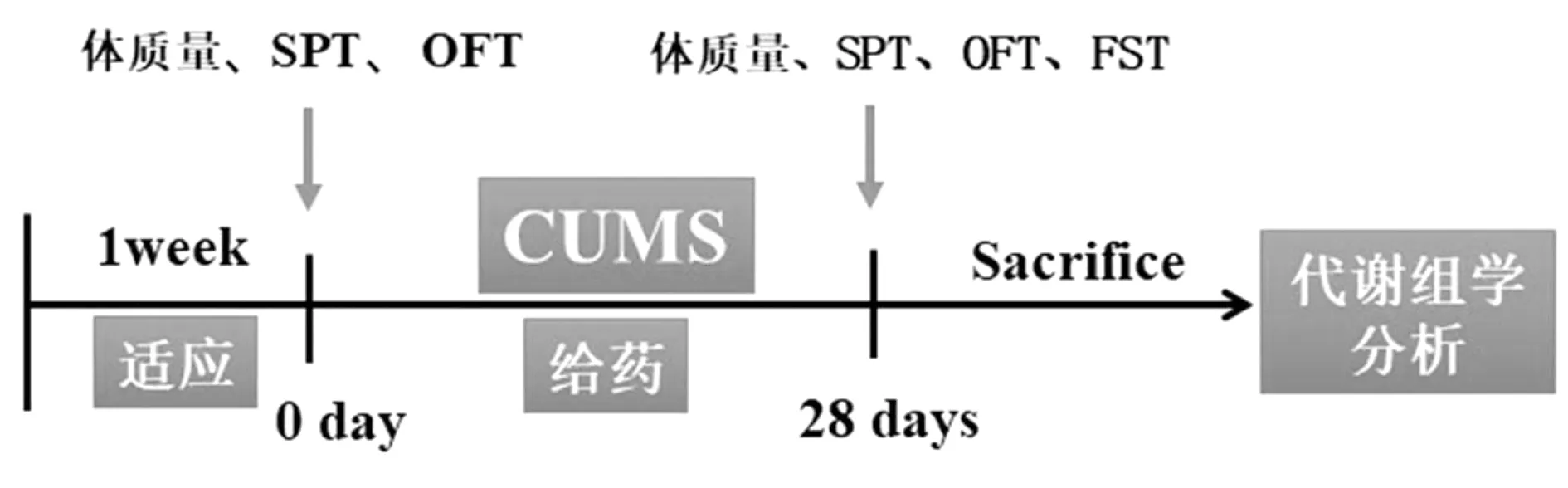
图1 实验流程图
1 材料
1.1 试剂与仪器
蔗糖(天津市风船化学试剂科技有限公司);水合氯醛(天津市大茂化学试剂厂);SCIENTZ-12N冷冻干燥机(宁波新芝生物科技股份有限公司);DHG-9050B恒温鼓风干燥箱(上海琅玕实验设备有限公司);RV 10 digital V旋转蒸发仪(德国艾卡集团);BRUKER 600 MHz AVANCE III超导核磁共振波谱仪(瑞士);TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司)。
1.2 实验药品
白芍(批号:1710436111,产地:安徽)药材饮片购于河北安国市祁澳中药饮片有限公司;盐酸文拉法辛胶囊(规格:25 mg/粒,批号:130101,厂家:成都康弘药业集团股份有限公司)。
1.3 实验动物
SPF级雄性SD大鼠,体质量(200 ± 20)g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。饲养环境:室温20~24 ℃,室内相对湿度45%~55%,明暗交替周期12 h。动物实验获得山西大学伦理委员会的批准(批准号:SXULL2016036)。
1.4 白芍提取制备
称取适量白芍药材饮片,用8倍量70%乙醇浸泡1 h后回流提取2次,每次2 h,合并提取液,静置、过滤、旋转浓缩、冷冻干燥,制成细粉,储存于-20 ℃冰箱备用。药物使用前用蒸馏水超声溶解为溶液。
2 方法
2.1 动物分组与给药
按照体质量、旷场实验、糖水偏爱实验结果,选择指标相近的大鼠60只,将其随机分为空白组,模型组,阳性药组(文拉法辛,35 mg·kg-1),白芍低、高剂量组(生药量15、30 g·kg-1),给药组按照大鼠体质量10 mL·kg-1灌胃给药,空白、模型组给予同等量的蒸馏水。
2.2 CUMS抑郁模型的复制
动物适应7 d后,空白组大鼠正常饲养,不进行任何刺激,其余各组大鼠装入单笼喂养,并按照前期实验室建立的建模程序重建慢性不可预测的轻度应激(CUMS)模型。为了确保刺激因素的不可预测性,随机安排每日刺激,并保证各项刺激不连续出现,且发生的总数不应超过4次,该过程持续28 d[10],包括:禁水、禁食(各24 h);热刺激10 min;超声刺激(60 W,3 h);足底电击(持续2 s,间隔10 s,共10次);冰水游泳(4 ℃,高50 cm,直径20 cm有机玻璃缸);昼夜颠倒;束缚3 h。
2.3 行为学测试
2.3.1 体质量
在实验的第0、1、2、3、4周对大鼠进行称量。
2.3.2 旷场测试(OFT)
纳入标准:(1)所有患者均符合临床关于白内障的诊断标准,经眼压检查、房角检查或B超检查确诊;(2)年龄>60岁;(3)患者意识清晰、交流能力正常;(4)知晓实验目的,签署《知情同意书》。
利用旷场实验[11]评估大鼠的运动和空间探索能力,在实验开始的第0、1、2、3、4周进行。实验装置由100 cm2(25个相等正方形)的黑色区域组成,周围是高40 cm的黑色墙壁。将大鼠缓慢地放到装置的中心,适应1 min,探索4 min,观察测试期间每只大鼠的穿越横格数双肢离开地面1 cm的直立次数。每次测试后,用10%的酒精清洗旷场设备,以消除残留的气味。
2.3.3 糖水偏爱实验(SPT)
根据文献[11]报道,在第0和28天进行糖水偏爱测试。实验前,将大鼠单独饲养,并提供两瓶1%的蔗糖水以适应蔗糖溶液。在最初的24 h内放入两瓶1%的蔗糖水,在接下来的24 h,用日常饮用水替换其中一瓶1%的蔗糖水。经过上述糖水偏爱率训练后,所有动物被剥夺食物和水12 h,然后大鼠自由选择饮用蔗糖水或水12 h。根据消耗量计算出大鼠的糖水偏爱率糖水偏爱率(%)=蔗糖水消耗量/(蔗糖水消耗量+饮用水消耗量)×100%。
2.3.4 强迫游泳实验(FST)
参考前期文献[11],在测试前1天,将大鼠放入水深30 cm、温度(25±1)℃的玻璃圆筒(直径20 cm,高50 cm)中,进行15 min预测试以消除水引起的急性压力。预测试24 h后,进行5 min的强迫游泳。不动时间被定义为当大鼠仅进行微妙的必要动作且其头部保持在水上时状态的时间。
2.4 肝组织样本的收集
水合氯醛麻醉大鼠后进行腹主动脉取血,快速收集肝组织并立刻置于液氮中,并在-80 ℃冰箱冷冻保存以待进行核磁分析。
2.5 代谢组学样品制备及测定
收集每只大鼠的肝脏外侧叶组织约200 mg,加入600 μL甲醇,300 μL超纯水于冰水浴中匀浆;在13 000 r/min和4 ℃下离心20 min,收集上清液,氮气流吹干,于600 μL D2O磷酸盐缓冲液(0.2 mol/L Na2HPO4/NaH2PO4,pH=7.4,含0.010 % TSP)中涡旋复溶后,在13 000 r/min和4 ℃下离心20 min。将上清液转移到5 mm NMR管中用于分析。
2.6 1H-NMR谱图数据处理与分析
1H-NMR图谱处理使用MestReNova(6.1.1版,Mestrelab Research,Santiagode Compostella,西班牙)进行处理。对每张核磁图谱进行相位和基线手动校正,以TSP的化学位移δ 0.00为标准,切除δ4.62~5.17区间的水峰,对δ0.75~8.56范围的核磁图谱以0.01为单位进行积分和总峰面积归一化,产生数据矩阵。
2.7 数据统计分析
将矩阵导入Excel表格中,采用SIMCA-P 13.0软件(Umetrics公司,瑞典)进行主成分分析(PCA)观察样本整体分布情况,偏最小二乘判别分析(PLS-DA)和正交偏最小二乘法判别分析(OPLS-DA)用于检查各组之间的趋势,并对建立的模型进行排列检验,排列检验是对R2(模型拟合度)和Q2(预测能力)的计算,V-S-plot图结合VIP>1及t检验(P<0.05)作为筛选潜在生物标志物条件。使用生物学数据库HMDB(http://www.hmdb.ca)进行代谢物的鉴定,并使用MetaboAnalyst网页(https://www.metaboanalyst.ca/)进行代谢通路分析。SPSS 25.0软件用于进行统计学分析,通过t检验比较两组之间的统计学差异;one-way ANOVA比较多组之间的统计学差异。
3 实验结果
3.1 行为学测试
3.1.1 体质量实验
第4周模型组大鼠的体质量显著降低(P<0.001),表明CUMS造模成功;给药后,阳性药组(P<0.01)、白芍低剂量组(P<0.001)的体质量均发生显著性增加(见表1),表明白芍能有效逆转CUMS造模引起的体质量减轻。
3.1.2 旷场实验
第4周模型组大鼠的穿越格数和直立次数都显著减少(P<0.001,P<0.001);给药后,阳性药组(P<0.001)、白芍低剂量组(P<0.01)的穿越格数均显著增加(见表1);阳性药组(P<0.01)、白芍高低剂量组(P<0.05,P<0.05)的直立次数也有显著增加(见表1)。结果表明,白芍能够改善抑郁大鼠的旷场活动情况。
3.1.3 糖水偏爱实验
第4周模型组大鼠糖水偏爱率显著性减少(P<0.001),给药后,阳性药组(P<0.001)、白芍低剂量组(P<0.05)的糖水偏爱率均显著增加(见表1)。结果表明,白芍能显著逆转抑郁大鼠的快感缺失现象。
3.1.4 强迫游泳实验
第4周模型组大鼠强迫游泳不动时间显著增加(P<0.001)。给药后,阳性药组(P<0.001)、白芍低剂量组(P<0.05)的不动时间均显著减少(见表1),结果说明白芍能有效逆转抑郁大鼠的行为绝望现象。
3.2 1H-NMR代谢组学
3.2.1 核磁图谱归属
1H-NMR谱图如图2,结合文献[12]报道和 HMDB(http://www.hmdb.ca/)数据库对图谱进行分析,共指认出42种内源性代谢产物,结果如表2。
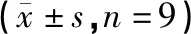
表1 第4周造模后大鼠行为学指标

表2 大鼠肝脏样本1H-NMR数据归属
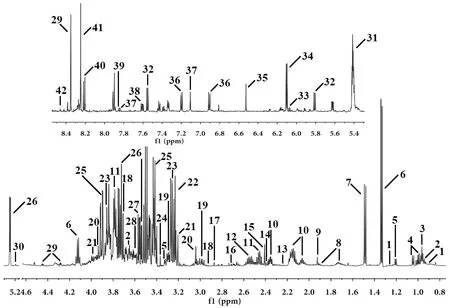
图2 空白组大鼠肝脏样本1H-NMR图谱
3.2.2 多元统计分析
根据1H-NMR 图谱成分归属获得的肝脏内源性代谢物信息,首先采用无监督的主成分分析(PCA)方法,从PCA得分图及3D图可以发现空白组和模型组能明显分开(图3A、3B);为了验证模型的可靠性,构建PLS-DA模型图(图3C),所有左侧排列均低于右侧原始值且相交于负半轴 (R2X=0.741、R2Y=0.987、Q2=0.947),即为CUMS模型重建成功、可靠。进而采用有监督的OPLS-DA,以筛选出与抑郁症相关的差异变量。OPLS-DA得分图显示空白组和CUMS模型组可明显分开(图3D),结合V-S-plot图中VIP>1、P(corr)≥0.58且≤-0.58及t检验(P<0.05)筛选空白组与CUMS组的差异变量(图3E)。对空白组、模型组、阳性药组、白芍高、低剂量组进行OPLS-DA分析,可以看出各组间能清楚分离(图3F),说明各给药组对筛选出的肝脏差异代谢物的调节程度不同。
注:A.空白组与模型组PCA得分图;B.PCA-3D得分图;C.PLS-DA模型验证图;D.OPLS-DA散点图;E.V-S-plot图;F.各组OPLS-DA散点图图3 多元统计分析图
3.2.3 差异代谢物分析
由OPLS-DA分析结果筛选出24个与抑郁相关的生物标志物,相较于空白组大鼠,模型组大鼠肝脏中尿囊素、α-葡萄糖、β-葡萄糖、胆碱、甜菜碱、二甲基甘氨酸、甘油和氧化型谷胱甘肽8种代谢物含量升高;醋酸盐、丙氨酸、肌酸、二甲胺、谷氨酸、谷氨酰胺、甘氨酸、次黄嘌呤、异亮氨酸、亮氨酸、低密度脂蛋白、赖氨酸、丙酮酸、酪氨酸、邻磷酸胆碱和缬氨酸16种代谢物含量降低。给药后结果分析,白芍低剂量组能够显著回调与抑郁相关的全部差异代谢物,而白芍高剂量组能显著回调其中除甘氨酸、邻磷酸胆碱之外的22种代谢物。综上可见,白芍高、低剂量组对肝脏中与抑郁相关的差异代谢物均有显著回调作用。见图4。
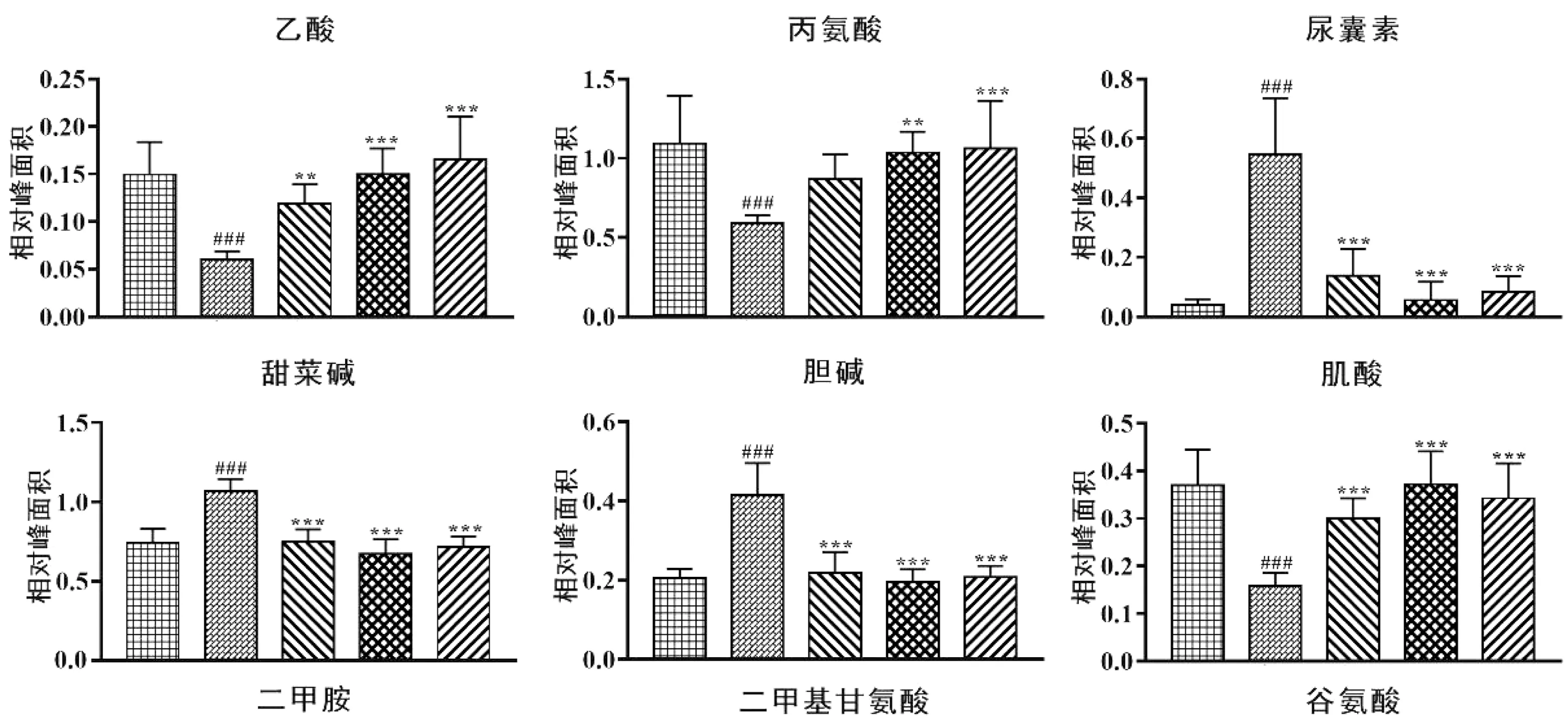
注:与空白组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。图4 各组大鼠肝脏差异代谢物的变化
3.2.4 代谢通路分析
将上述24种与抑郁症相关的以及白芍能显著回调的差异代谢物输入metaboanalyst网页中进行代谢通路分析。横坐标Pathway impact表示代谢通路重要值,纵坐标-log(p)表示通路富集分析的P值水平。本研究以代谢通路重要值(impact value)>0.1以及代谢通路富集水平(-log p)>2作为筛选标准,筛选得到10条与抑郁相关的代谢通路(图5),分别为a:D-谷氨酰胺和D-谷氨酸代谢;b:苯丙氨酸,酪氨酸和色氨酸的生物合成;c:甘氨酸,丝氨酸和苏氨酸的代谢;d:丙氨酸,天冬氨酸和谷氨酸代谢;e:丙酮酸代谢;f:酪氨酸代谢;g:谷胱甘肽代谢:h:糖酵解/糖异生;i:精氨酸的生物合成;j:乙醛酸酯和二羧酸酯代谢。代谢通路分析发现白芍能调节CUMS模型影响的10条代谢通路。利用KEGG数据库对与抑郁症相关的10条代谢通路及所涉及的生物标志物进行关联分析(图6),可见各代谢通路与生物标志物之间相互关联,证明了抑郁症发病机制的复杂性及白芍整体性调节的特点。
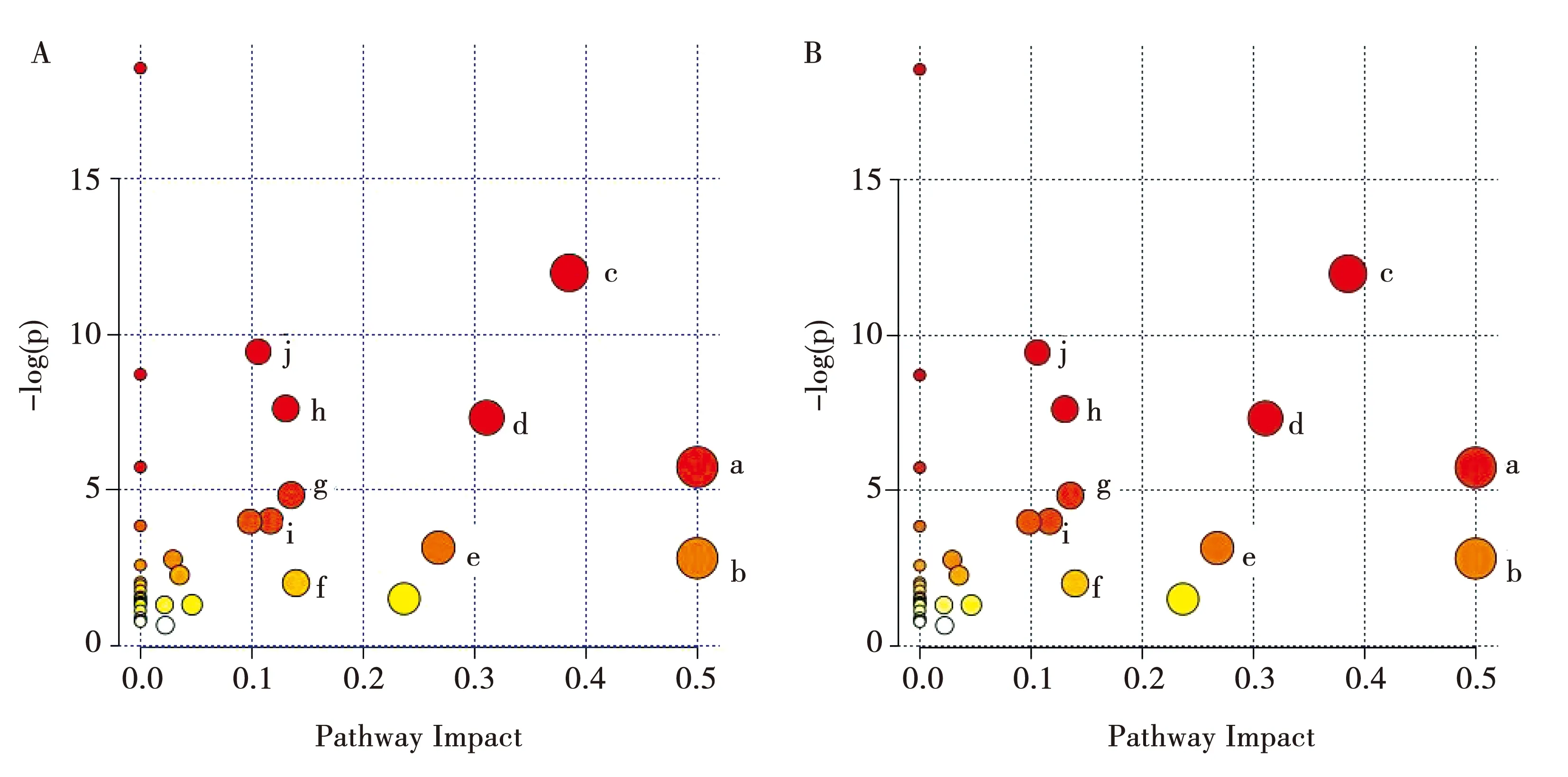
注:A.抑郁相关代谢通路;B.白芍调节代谢通路图5 肝脏代谢通路的MetPA分析
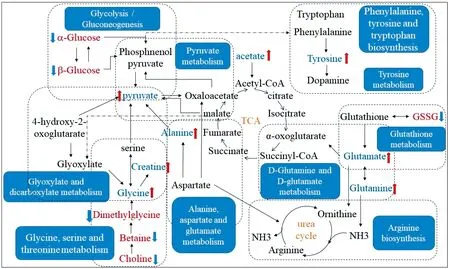
注:空白组相比,红色字体代表模型组上调的代谢物,蓝色字体代表模型组下调的代谢物;与模型组相比,红色箭头代表白芍组代谢物显著增加,蓝色箭头代表白芍组代谢物显著减少。图6 抑郁症相关的10种代谢通路的代谢网络
4 讨论
白芍味苦、酸,性微寒,功能养肝血、补肝阴、抑肝阳,为养血柔肝,维持正常情志活动的要药。四逆散、枳实芍药散、柴胡疏肝散、逍遥散等历代疏肝解郁的名方中,皆以白芍为主药;现代中医对于抑郁症的临床治疗,无论在组方频次和用药剂量上,白芍也都占有重要的位置[6]。
本研究将CUMS模型大鼠视为研究对象,白芍给药后,行为学指标得到显著改善,表明白芍具有明确的抗抑郁药效,运用核磁代谢组学技术鉴定出肝脏中24种与抑郁相关的差异代谢物,白芍干预后能回调全部的代谢物,代谢通路富集分析也表明白芍可以通过改善10条代谢通路发挥抗抑郁作用。其中谷氨酸作为一种已知的兴奋性神经递质,其含量发生异常会诱发神经毒性[13]。谷氨酸的生成途径主要有两条,分别是谷氨酰胺经谷氨酰胺酶作用发生的转化以及丙氨酸通过丙氨酸转氨酶发生的转化,谷氨酸在中枢神经系统中作为主要的兴奋性神经递质具有重要作用。本研究发现模型组大鼠的肝脏谷氨酸含量显著降低,代谢通路分析结果也表明CUMS造模可引起大鼠肝脏中谷氨酸代谢发生紊乱,而白芍干预后都有所改善,表明白芍可改善谷氨酸在体内的代谢紊乱情况,从而起到抗抑郁效果。
谷胱甘肽(GSH)是人体组织中含量最丰富的抗氧化剂,是抗氧化能力以及氧化应激的关键指标,有研究表明,谷胱甘肽系统调节异常会降低谷氨酸NMDA受体的谷氨酸能活性,减弱神经营养蛋白的产生,从而影响认知与情感[14]。本研究发现CUMS 模型可引起大鼠体内氧化型谷胱甘肽(GSSG)含量的升高,说明抑郁模型削弱了大鼠肝组织中抵御氧化应激的能力,当给予抑郁大鼠白芍后,大鼠体内GSSG的含量有所降低,提示白芍可以通过调节谷胱甘肽代谢增强体内抗氧化能力发挥抗抑郁作用。
甘氨酸是N-甲基-D-天冬氨酸(NMDA)受体的竞争性配体,当甘氨酸结合到选择性甘氨酸结合位点时,可间接增强NMDA 受体激动后所产生的生理效应,而NMDA 受体的过度激活被认为是抑郁症发生的重要原因之一[15]。本研究发现CUMS 造模大鼠与正常大鼠相比,其肝脏中甘氨酸的含量显著降低,白芍给药后改善这一情况,可能与上述机理有关。
综上所述,本研究从内源性代谢物及代谢通路的角度,探索了白芍抗抑郁的作用机制,发现白芍对CUMS诱导的抑郁症大鼠发生的肝脏代谢紊乱有明显改善作用,其发挥抗抑郁作用涉及多条代谢通路,但各差异性代谢物与抑郁症的内在联系以及相关代谢通路的验证仍需要进一步考察。
