急性中耳炎中IL-27通过信号通路PI3K对肺炎链球菌清除的影响
2021-09-03闫晶晶邓安春朱先柏王敏
闫晶晶,邓安春,朱先柏,王敏
(中国人民解放军陆军军医大学第二附属医院 耳鼻咽喉科,重庆 400037)
肺炎链球菌导致的急性中耳炎(acute otitis media,AOM)是临床常见儿科感染疾病。AOM可导致患儿永久性的听力丧失,严重危害青少年的健康成长。研究表明[1]在细菌感染后,宿主体内的中性粒细胞被激活,增殖,并募集到炎性部位,为机体构筑抵抗入侵的首要屏障,同时中性粒细胞会增强多种细胞因子的表达,参与肺炎链球菌的清除。研究表明[2]磷脂酰肌醇-3-激酶(phosphoinositide 3-kinases,PI3K)信号是机体内重要的转导通路,在与免疫、炎性应激等疾病相关的生物病理改变中,对于细胞的增殖,活化以及募集等过程其中心调控作用。吴盈盈等[3]研究表明PI3K信号通路在调节肺炎链球菌HSP40诱导的小鼠巨噬细胞的免疫应答中发挥关键作用。李海龙等[4]研究表明抑制PI3K信号能明显抑制哮喘小鼠的炎性应激,减少炎性细胞的浸润,减少小鼠肺泡灌洗液中中性粒细胞计数。白细胞介素-27(interleukin 27,IL-27)能对多种免疫细胞发挥调控作用,在细胞抗感染、以及炎症应激等机体免疫生理过程中起重要的作用[5]。Wang等[6]研究表明在由艰难梭菌诱导的结肠炎C57BL/6小鼠中,与野生型小鼠相比,敲除IL-27基因后,IL-27表达的缺失明显加重其结肠炎病理改变。但未见IL-27在AOM中的相关研究报道。本研究通过建立AOM小鼠,基于PI3K信号通路,探讨IL-27对AOM小鼠中耳组织的保护作用,从而为AOM的临床治疗提供实验依据。
1 材料和方法
1.1 实验动物
6~8周龄的BALB/c雄性小鼠,SPF级,体重在200~220 g,共计80只,从北京维通利华实验动物有限公司采购,动物许可证号SCXK(京)2017-0652;所用动物依照本院实验动物管理办法,室温下标准饲料、自由饮水、分笼(4笼)适应性饲养1周后用于试验。本研究中所有动物实验操作均经本院实验动物管理伦理委员会批准(批准号:2019-032)。标准肺炎链球菌菌株(D39)购自中国科学院微生物研究所。
1.2 主要试剂
IL-27(1 mL/支,广东厚德水准生物科技有限公司,生产批号:NA02020034),PI3K特异性抑制剂2-(4-吗啉基)-8-苯基-4H-1-苯并吡喃-4-酮[2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-on,LY294002](1 mL/支,美国Invivo Gene公司,生产批号:AV-58H009),PI3K、磷酸化磷脂酰肌醇-3激酶(phosphorylation of phosphatidylinositol 3-kinase, p-PI3K)、磷酸化丝苏氨酸蛋白激酶(phosphorylation serine-threonine kinase,p-AKT)、肿瘤坏死因子α(tumour necrosis factor-alpha,TNF-α)、白细胞介素6(interleukin-6,IL-6)、兔抗GAPDH 抗体(美国Santa公司),western blot试剂盒(德国Rebstock公司),免疫组化试剂盒(南京建成生物有限公司),苏木精-伊红染色(hematoxylin-eosinstaining,HE)试剂盒(上海碧云天生物技术公司),蛋白质浓度测定试剂盒、化学发光试剂盒(美国 Forma公司)。
1.3 主要仪器
LIOOS600T生物显微镜(日本尼康公司),Bio-rad凝胶成像系统(美国Bio-rad公司),-80℃深冷冰箱(德国维根斯公司),Leica RM2135组织切片机(德国Leica公司),高速低温离心机(北京六一仪器厂)。
1.4 模型构建和分组处理
适应性喂养1周后,将小鼠随机分为4组,每组20只,依次为正常组、模型组、IL-27组(实验组)、PI3K特异性抑制剂LY294002干预组(对照组)。采用肺炎链球菌感染建立急性中耳炎小鼠模型,实验组和对照组小鼠分别在感染肺炎链球菌前12 h耳后注射200 μL的IL-27(5 μg/mL)和LY294002(5 μg/mL),正常组、模型组注射等剂量的生理盐水。模型组、实验组、对照组小鼠每只耳鼓膜前下方注射5 μL肺炎链球菌[7],正常组注射等剂量的生理盐水。注射完毕后,所有小鼠自由饮水,标准饲料喂养。
1.5 各组小鼠听性脑干反应(auditory brainstem response,ABR)
在感染注射5 d后,将各组小鼠麻醉后,在隔音室使用小微动物ABR 仪器进行听力检测,从80 dB 声压级(sound pressure level,SPL)测试声开始,依次递减10 dB,在临近阈值处以5 dB递减,以可重复的,较为明确的Ⅲ波作为ABR阈值。
1.6 各组小鼠中耳灌洗液(middle ear lavage fluids,MELF)标本采集
在感染注射5 d后,收集各组小鼠的MELF:动物麻醉后,将5 μL预冷的PBS液经穿破鼓膜注入中耳,收集灌洗液,至少灌洗20次[8]。每只耳需要收集100 μL MELF。取20 μL MELF经PBS缓冲液稀释后进行炎性细胞计数以及细菌计数。剩余MELF转入深冷冰箱中待测。
1.7 ELISA法测定各组小鼠MELF中炎性因子TNF-α、IL-6的含量
取50%各组小鼠MELF标本,经PBS液稀释后,严格按照ELISA试剂盒要求进行操作,测定各组小鼠中耳灌洗液中炎性因子TNF-α、IL-6的表达。
1.8 HE染色观察各组小鼠中耳组织病理学改变
在感染注射5 d后,上述检测结束后,处死各组小鼠,同时收集各组小鼠的中耳组织,90%组织并迅速转至深冷冰箱待测。10%组织标本,多聚甲醛固定24 h后,包埋、切片,HE染色,光镜下观察各组小鼠中耳组织的病理变化。
1.9 Western blot检测各组小鼠中耳组织中p-PI3K、p-AKT的表达水平
每组取3只小鼠,然后取中耳组织,提取目标蛋白,测定蛋白浓度后,称取适量样品,经电泳、PVDF转膜后,加入10%脱脂奶粉封闭3 h,以(1∶1 500)比例稀释后,维持4℃过夜孵育,洗涤加入二抗(1∶1 000),孵育3 h,增强化学发光ELC显色30 min,经曝光、显影、定影后,以GAPDH为内参来表示蛋白的表达水平。
1.10 统计学分析
2 结果
2.1 各组小鼠ABR检测结果
各组小鼠ABR检测各组结果显示,模型组、实验组、对照组的ABR阈值明显高于正常组(t依次为2.754、4.569、3.681,P均<0.05),而实验组、对照组ABR阈值明显低于模型组(t依次为5.672、5.247,P均<0.05),实验组和对照组相比,差异不具有统计意义(t=0.324,P>0.05),见表1,图1。
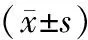
表1 各组小鼠ABR阈值比较
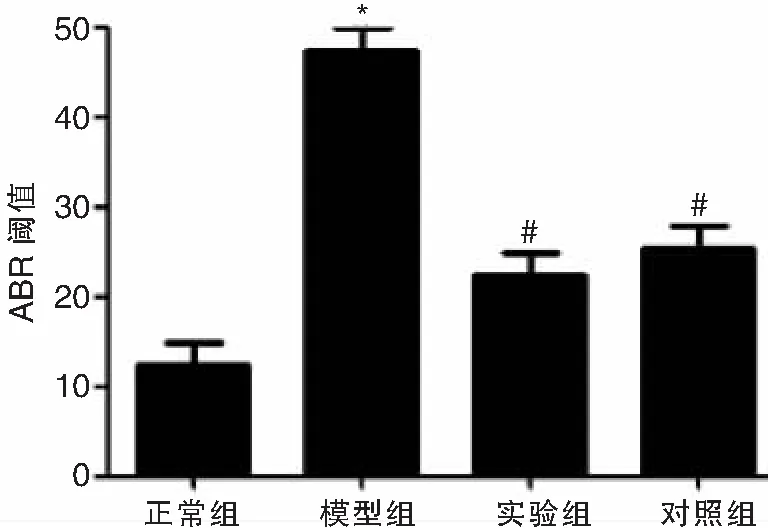
图1 各组小鼠ABR阈值比较
2.2 显微镜下观察各组小鼠MELF中炎性细胞计数和细菌计数
显微镜下观察各组小鼠MELF中炎性细胞计数结果如图2a显示,模型组、实验组、对照组小鼠MELF中炎性细胞计数明显高于正常组(t依次为29.855、25.324、23.597,P均<0.05),而实验组和对照组小鼠MELF中炎性细胞计数明显低于模型组(t依次为14.071、13.254,P均<0.05),实验组和对照组相比,差异不具有统计学意义(t=0.125,P>0.05)。
显微镜下观察各组小鼠MELF中细菌数量结果图2b显示,模型组、实验组、对照组小鼠MELF中的细菌数量明显高于正常组(t依次为20.138、16.217、15.987,P均<0.05),实验组、对照组MELF中的细菌数量明显低于模型组(t依次为10.027、9.648,P均<0.05),实验组和对照组相比,差异不具有统计意义(t=0.011,P>0.05),见表2、图2。
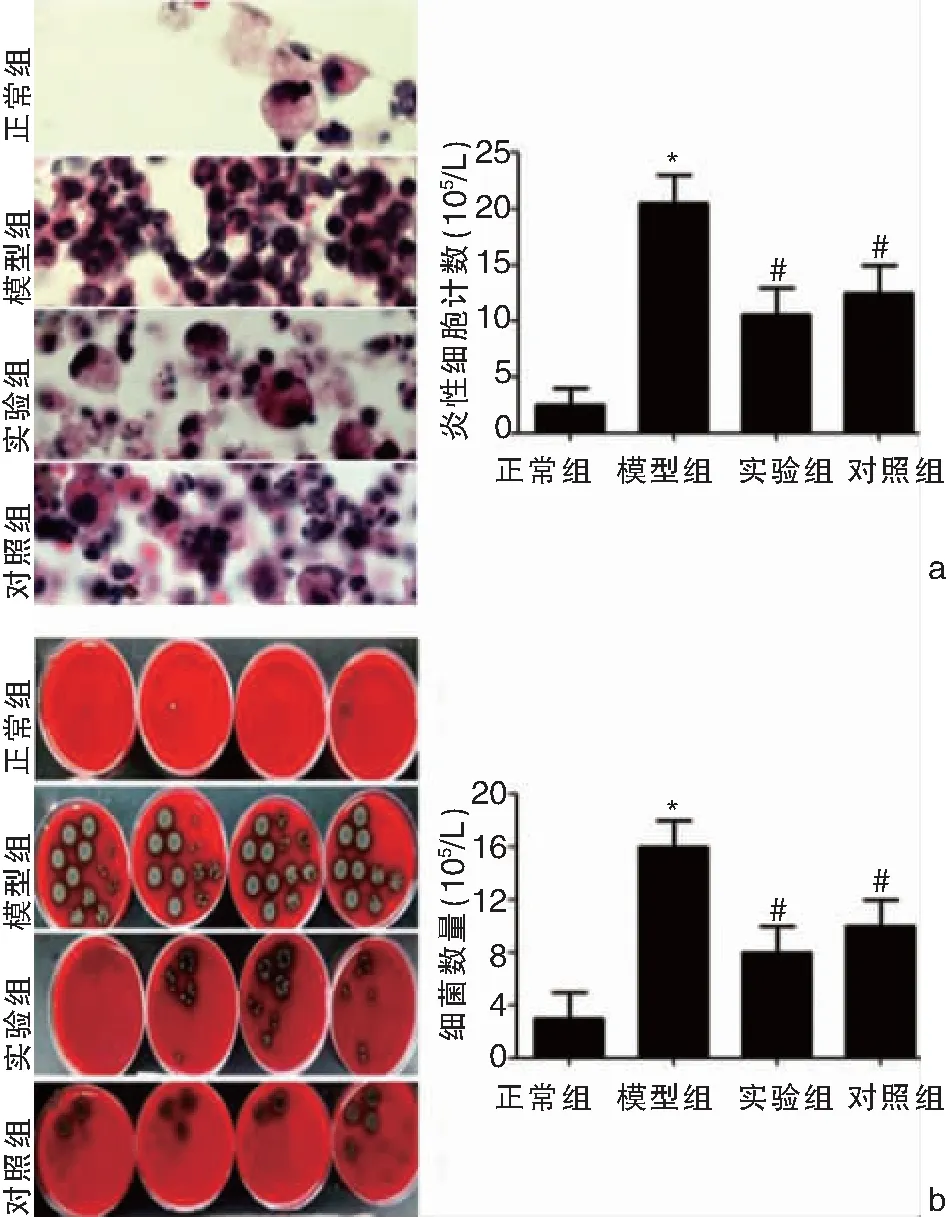
图2 显微镜下观察各组小鼠MELF a:炎性细胞计数;b:细菌数量
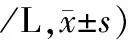
表2 各组小鼠MELF中炎性细胞计数和细菌数量的比较 (×105个
2.3 ELISA法检测各组小鼠MELF中TNF-α、IL-6的表达
ELISA法检测各组小鼠MELF中TNF-α、IL-6的含量结果如图3显示,模型组、实验组、对照组小鼠MELF中TNF-α含量明显高于正常组(t依次为45.942、35.685、36.984,P均<0.05),实验组、对照组MELF中TNF-α含量明显低于模型组(t依次为25.634、24.969,P均<0.05),实验组和对照组相比,差异不具有统计意义(t=0.125,P>0.05);模型组、实验组、对照组小鼠MELF中IL-6含量明显高于正常组(t依次为58.367、42.618、43.254,P均<0.05),实验组、对照组MELF中IL-6含量明显低于模型组(t依次为37.892、38.521,P均<0.05),实验组和对照组相比,差异不具有统计意义(t=0.163,P>0.05),见表3。
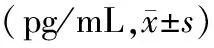
表3 各组小鼠MELF中TNF-α、IL-6的含量的比较
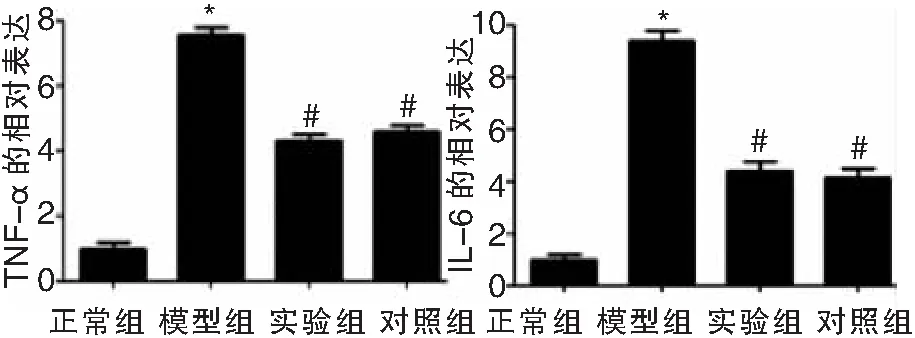
图3 ELISA法检测各组小鼠MELF中TNF-α、IL-6的表达
2.4 HE染色观察各组小鼠中耳组织病理学改变
各组小鼠中耳组织HE染色结果如图4所示,正常组小鼠中耳组织结构完整,上皮未见有分泌物渗出,黏膜细胞排列正常,中耳骨质无异常;与正常组相比,模型组小鼠中耳上皮肿胀明显,上皮黏膜明显增厚,并且有分泌物渗出,中耳骨质损伤明显,与模型组相比,实验组和对照组小鼠中耳组织损伤明显减轻,略见肿胀,黏膜增厚明显减轻,渗出物明显减少,中耳骨质损伤明显减轻。
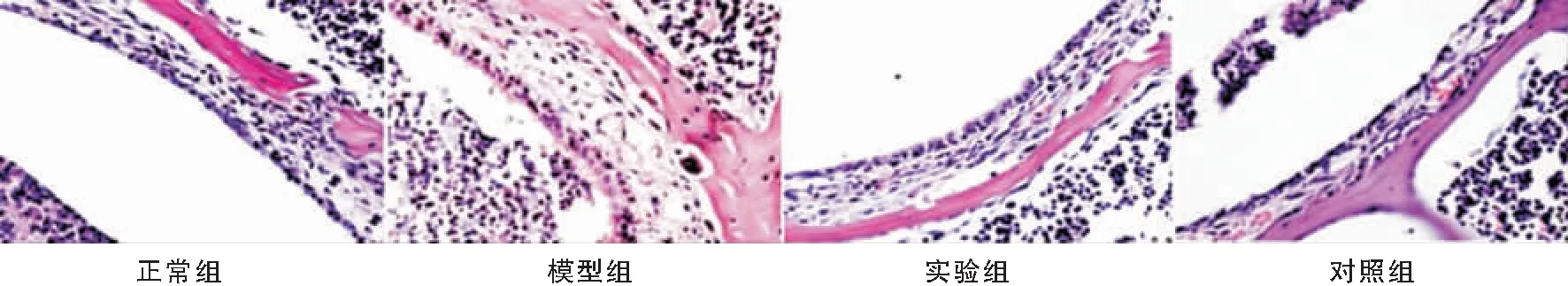
图4 各组小鼠中耳组织 (HE ×200)
2.5 各组小鼠中耳组织中p-PI3K、p-AKT的表达
Western blot检测各组小鼠中耳组织中p-PI3K、p-AKT的表达结果如图5、6所示:模型组小鼠中耳组织中p-PI3K、p-AKT的相对表达比正常组明显升高(t分别为6.315,5.169,P<0.05),实验组和对照组小鼠中耳组织中p-PI3K、p-AKT的相对表达比模型组明显降低(F分别为3.257,3.543,P<0.05);实验组和对照组相比,差异不具有统计意义(t分别为0.124,0.211,P>0.05)。
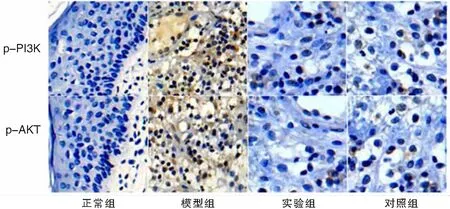
图5 免疫组化检测各组小鼠中耳组织中p-PI3K、p-AKT的表达 (SP ×400)
3 讨论
AOM是与儿童的健康成长密切相关的全球感染性疾病。定植在鼻咽部位但极易上行至机体中耳腔的肺炎链球菌是常见致病菌之一[9]。尽管AOM是机体的自限性疾病,但是如果不能有效地控制病菌入侵,极可能导致患者出现脑膜炎、永久性听力丧失等严重后遗症。临床上尚缺乏快速而有效的根治手段。大量研究证实[10]中性粒细胞在细菌感染后成为宿主进行免疫应答清除病原体的主要效应细胞。因此阐明AOM中中性粒细胞的分子机制,为临床上治疗AOM具有重要意义。
IL-27作为一种重要的机体免疫调节因子,在机体的固有免疫、适应性免疫应激以及抗感染、抗病毒过程中发挥重要的调控作用。Jacobs 等[11]临床研究发现IL-27可作为由细菌感染导致新生儿免疫低下的分子标志物,血清中IL-27的含量能准确反映其受病原体感染的程度。Fan等[12]研究表明在由内毒素致小鼠急性肝损伤模型中,IL-27处理后能明显增强肝组织中性粒细胞的免疫能力,增强小鼠肝脏抗感染的能力。Robinson 等[13]研究表明在金黄色葡萄球菌导致的肺炎小鼠模型中,外源性添加IL-27能明显抑制促炎分子IL-17的表达,增强抑炎分子IL-10的表达。Lin等[14]研究表明针对肺结核患者的支气管肺泡灌洗液进行IL-27处理,能明显减少其灌洗液中细菌的种类和数量。本研究通过建立BALB/c小鼠急性中耳炎模型,经过IL-27干预后,与模型组相比,实验组小鼠的ABR阈值,MELF中炎性细胞以及细菌计数,炎性因子TNF-α、IL-6的表达均明显降低,HE染色结果表明实验组小鼠中耳组织损伤明显改善,小鼠听力功能明显恢复。
PI3K通路是机体内重要的信号通路,AkT是PI3K下游的关键信号转导蛋白,在应激条件下该信号被活化,PI3K、AKT发生磷酸化直接参与调控细胞增殖、分化以及免疫应答和炎性应激等相关生理过程。Kurosawa 等[15]研究表明PI3K信号的激活,PI3K、AKT发生磷酸化,直接促进化脓性链球菌对患者的上皮细胞粘附和侵袭,诱发患者出现咽喉炎或者中毒性休克综合征等症状。Lv 等[16]研究表明抑制PI3K信号的磷酸化能明显抑制金黄色葡萄球菌感染RAW264.7巨噬细胞的炎性应激。Lin 等[17]研究表明在临床上治疗类风湿关节炎(rheum atoid arthritis,RA)时,给以PI3K抑制剂LY294002干预后,能明显抑制中性粒细胞的炎性浸润,改善患者的RA症状。粟玉凤等[18]研究证实PI3K抑制剂LY294002能明显抑制肺炎链球菌感染引起的小鼠巨噬细胞中IL-6、TNF-α的表达,增强细胞的免疫能力。本研究采用PI3K抑制剂LY294002处理作为对照组,结果表明,对照组小鼠症状明显改善,并且对照组与实验组之间差异无统计学意义(P>0.05),说明IL-27与LY294002对急性中耳炎小鼠起到的作用相类似;而Western blot结果显示,与模型组相比,实验组和对照组小鼠中耳组织中p-PI3K、p-AKT的表达明显降低,由此推断IL-27可能是通过抑制PI3K信号通路的磷酸化来实现对小鼠中耳组织的保护作用的。
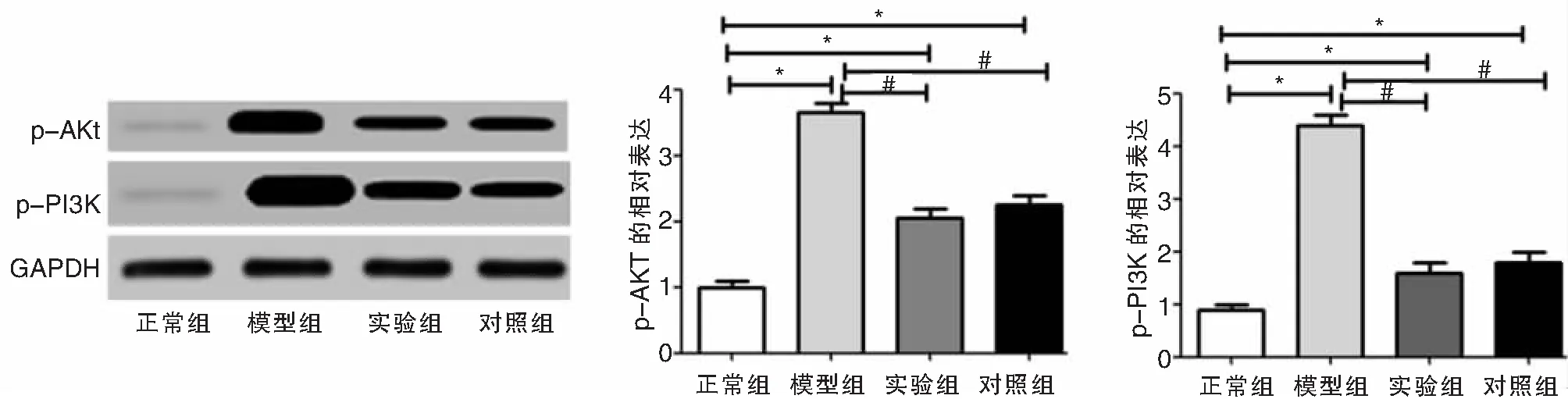
图6 Western blot检测各组小鼠中耳组织中p-PI3K、p-AKT的表达
综上所述,在肺炎链球菌感染的急性中耳炎中,IL-27能通过抑制PI3K信号的磷酸化来调节中性粒细胞对病菌的清除。但IL-27是否还通过其他通路影响AOM进程还需更深入的研究。
