前噬菌体对细菌毒力的影响
2021-08-06季强金琳栗绍文宋厚辉刘梅
季强,金琳,栗绍文,宋厚辉,刘梅*
(1. 华中农业大学动物医学院,湖北 武汉 430070;2. 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,浙江 杭州 311300)
噬菌体(bacteriophage, phage)是感染细菌、真菌和藻类等微生物的一类病毒。根据复制方式,可以将噬菌体分为裂解性噬菌体(lytic phage)和溶原性噬菌体(lysogenic phage)。裂解性噬菌体是指噬菌体侵入宿主菌后,在宿主体内自主复制,裂解细菌,释放子代噬菌体的一类噬菌体。溶原性噬菌体亦称温和噬菌体(temperate phage),是指侵入宿主菌的噬菌体将自己的基因组整合到宿主细菌的染色体(或基因组)上,随着细菌基因组的复制而复制的一类噬菌体。溶原性噬菌体整合到宿主细菌基因组的核酸称为前噬菌体(prophage)。携带有前噬菌体的细菌称为溶原性细菌(lysogenic bacterium; lysogen),简称溶原菌。当整合到细菌基因组后,前噬菌体会受到噬菌体编码的阻遏蛋白的抑制而保持静止状态即溶原状态,但在一定条件下,前噬菌体会被切除,从细菌基因组上脱离,从溶原状态进入裂解状态,产生并释放子代噬菌体,这个过程称为前噬菌体的诱导。前噬菌体的诱导通常是在细菌DNA受到损伤时被引发的。细菌DNA受到损伤后,触发细菌的SOS反应,使噬菌体阻遏蛋白失去活性,从而消除对前噬菌体的抑制作用,前噬菌体脱离细菌基因组,进入裂解状态[1]。因此,一些可以引起细菌DNA损伤的因素,比如紫外线[2]、丝裂霉素C[3]和喹诺酮类药物[4]等,都可以诱导溶原菌产生子代噬菌体,紫外线照射和丝裂霉素C处理是实验室中常见的前噬菌体诱导的方法。
随着基因测序技术的发明和不断升级换代,以及生物信息学的诞生和发展,大量的细菌基因组被测序,前噬菌体序列被预测,两个预测工具为Prophage Hunter(https://pro-hunter.bgi.com)和PHASTER(https://phaster.ca),这使得对前噬菌体的研究能够深入到分子水平。Touchon等[5]对2 110个细菌基因组测序后发现,约一半细菌是溶原菌,对病原菌来说更是如此,且研究证明,前噬菌体与细菌的毒力密切相关。本文就该方面的研究结果进行综述,以增加人们对噬菌体的了解,并为研究细菌的毒力提供参考,进而帮助人们制定出从噬菌体的角度来消除病原菌的方针和策略。
1 前噬菌体增强细菌的黏附性
细菌感染的第一步是黏附到机体组织细胞表面,前噬菌体能够增强宿主细菌对组织细胞的黏附性。缺失了前噬菌体phiv142-3后的禽致病性大肠杆菌(avian pathogenicEscherichiacoli, APEC)菌株DE142,对鸡的心、肝和肺等组织的黏附性显著下降[3]。菌毛是细菌的黏附结构,其帮助细菌结合到宿主细胞的受体上;鞭毛相当于细菌的运动器官,其驱动细菌扩散到更有利的位置定植。进一步研究发现,前噬菌体phiv142-3基因组上的orf20编码的蛋白促进了菌株DE142鞭毛蛋白的输出和菌毛相关基因的表达,从而增强了菌株的黏附性[6]。大肠杆菌(Escherichiacoli)λ噬菌体的基因lom(lambda outer membrane)编码一种外膜蛋白,该蛋白能使大肠杆菌对口腔上皮细胞的黏附性增加50%[7]。耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus, MRSA)的ΦSPβ样前噬菌体编码的表面锚定蛋白SasX,能促进MRSA对鼻腔上皮细胞的黏附[8],该蛋白是治疗和疫苗设计的潜在靶标[9]。前噬菌体编码的蛋白还可以增强细菌对宿主血小板[10]和免疫球蛋白[11]的黏附能力,以增强细菌的毒力。
2 前噬菌体编码细菌毒素和调控毒素的产生与释放
2.1 前噬菌体编码细菌毒素
细菌毒素是细菌致病的重要毒力因子,某些毒素的基因是细菌通过水平基因转移(horizontal gene transfer, HGT)获得的,HGT可以通过以噬菌体为媒介的转导进行[12]。携带毒素基因的溶原性噬菌体侵入宿主细菌后成为前噬菌体,毒素基因被表达,使菌株产毒,所以许多病原菌依赖前噬菌体编码的基因产生毒素(表1)。

表1 前噬菌体编码的细菌毒素
例如,C型肉毒梭菌(Clostridiumbotulinumtype C)菌株468C产生的肉毒毒素,是由前噬菌体CEβ编码的[13];金黄色葡萄球菌(Staphylococcusaureus)菌株PS42-D产生的葡萄球菌肠毒素A是前噬菌体PS42-D(与菌株名相同)编码的[14];化脓链球菌(Streptococcuspyogenes)T253菌株被溶原性噬菌体T12侵染后,产生A型致热外毒素(又称红疹毒素),这个毒素的基因就定位在T12上[15]。前噬菌体发生诱导后可以携带这些毒素基因在细菌间转移,将非致病菌转化为致病菌,比如,非致病性的霍乱弧菌(Vibriocholerae)由于整合了编码霍乱毒素的前噬菌体CTXΦ,从而转变为致病性的霍乱弧菌[16];金黄色葡萄球菌的前噬菌体80α发生诱导后产生的子代噬菌体,能包裹细菌毒力岛SaPI1基因片段并转移至受体菌株,使受体菌株具有了致病性[17]。
2.2 前噬菌体调控细菌毒素的产生与释放
有些前噬菌体虽然不直接编码细菌毒素,不直接影响细菌的毒力,但可以通过调控细菌毒素的产生来间接影响细菌的毒力。如艰难梭菌(Clostridiumdifficile)的两个重要外毒素TcdA和TcdB基因的表达,受选择性RNA聚合酶σ因子TcdR(又称为TxeR)的正向调控[26],而TcdR又受前噬菌体ΦCD119编码的RepR蛋白的调控,RepR能结合到TcdR基因的上游,抑制TcdR的表达,从而抑制两种外毒素的产生[27]。
前噬菌体可以通过诱导后裂解细菌,促进毒素的释放,来增强细菌的毒力。有的细菌素如大肠杆菌素(colicin)是通过前噬菌体诱导裂解菌体释放出来的。大肠杆菌素分为A和B两类,A类依靠与之配对的大肠杆菌素释放蛋白(colicin release protein, CRP)释放到菌体外,而B类没有与之配对的释放蛋白,那么B类的大肠杆菌素是怎么释放出菌体的呢?鼠伤寒沙门菌(salmonellaentericaserovar typhimurium)菌株SL1344,能产生大肠杆菌素 Colicin Ib (ColIb),ColIb属于B类大肠杆菌素。研究发现,ColIb的释放是菌株SL1344内的前噬菌体ST64B来完成的。当用丝裂霉素C诱导时,前噬菌体ST64B进入裂解循环,导致菌体裂解,从而释放出大肠杆菌素ColIb[28]。
3 前噬菌体协助细菌逃避宿主防御
在细菌感染期间,前噬菌体可以协助细菌逃避宿主的防御,促进细菌在机体内的繁殖和扩散。
3.1 前噬菌体协助细菌逃逸巨噬细胞的吞噬
巨噬细胞是重要的免疫细胞,它吞噬病原菌,在胞内降解和消化菌体,并将菌体的抗原成分递呈给T细胞,以启动机体的特异性免疫功能来抵抗病原菌的侵染。病原菌若能避免被巨噬细胞吞噬掉,就能成功逃脱机体的免疫防御。有的前噬菌体就能帮助病原菌逃逸巨噬细胞的吞噬,使病原菌成功地在机体内繁殖和扩散。
单增李斯特菌(Listeriamonocytogenes)是胞内病原菌(intracellular bacterial pathogen),其被宿主巨噬细胞捕获后不但不会被吞噬掉反而能在巨噬细胞中生长繁殖,原因是该菌能从巨噬细胞的吞噬小体中逃逸出来,进入胞质,得以生长繁殖,这逃逸的本事离不开前噬菌体的帮助。以单增李斯特菌10403S菌株为例,研究发现,菌株要从吞噬小体中逃逸出来,需要comK基因产物的调控,但comK基因上带有前噬菌体φ10403S,由于该前噬菌体的插入使comK处于无功能状态[30]。当10403S菌株进入巨噬细胞吞噬小体后,菌株启动前噬菌体诱导系统,切除了comK上的φ10403S,使comK基因恢复功能,促使菌株从吞噬小体中逃逸出来。简而言之,由于前噬菌体φ10403S的切除增强了细菌的毒力。奇妙的是,前噬菌体φ10403S从细菌基因组上切除后,并未产生子代裂解性噬菌体使宿主细菌裂解消亡,反而增强了宿主菌在巨噬细胞内的生长能力,这个前噬菌体如同一个基因开关调节着细菌在感染过程中的毒力。
3.2 前噬菌体协助细菌抑制机体的炎症反应
炎症反应是机体抵御入侵的病原菌的一种免疫机制。病原菌为了不被炎症反应消灭掉,会进化出抑制炎症反应的能力以便能在体内定植和扩散,这其中有前噬菌体的功劳。
鼠伤寒沙门菌的前噬菌体Gifsy-1编码蛋白GogB,它是一个经沙门氏菌三型分泌系统(T3SS)释放出来的分泌性蛋白,其具有抑制宿主机体细胞转录因子NFκB活性的功能,活化的NFκB能正向调控促炎细胞因子的表达。GogB通过干扰NFκB的抑制蛋白IκBα的降解来抑制NFκB的活性,进而抑制了炎症反应,是个抗炎效应分子[31]。鼠伤寒沙门氏菌的前噬菌体Gifsy-1还编码另一个参与抗炎的蛋白,称为SarA(Salmonellaanti-inflammatory response activator),SarA能诱导细胞因子IL-10的产生。IL-10能减弱促炎细胞因子(如TNFα和IFNγ)的表达、抑制Th1细胞、减少巨噬细胞中活性氧(reactive oxygen species, ROS)的产生和降低巨噬细胞中炎症小体(inflammasome)的活性。SarA与上面的GogB一样,是T3SS释放出来的分泌性蛋白,能激活宿主细胞转录因子STAT3,STAT3调控IL-10的表达,IL-10发挥抑炎作用进而促进沙门氏菌在宿主细胞内的复制[32]。所以前噬菌体Gifsy-1为沙门氏菌逃避宿主炎症反应立下了汗马功劳。
4 前噬菌体参与细菌生物被膜的形成
细菌生物被膜(bacterial biofilm, BF)是指细菌为了适应环境,黏附接触表面,分泌蛋白质、多糖和核酸等胞外基质,将自身包绕其中的一种细菌聚集膜样物[33]。形成生物被膜是细菌体现其毒力的一个重要方面。细菌通过形成生物被膜,抵御机体免疫细胞、免疫分子和药物的攻击,克服机体液态流的冲击而持续留在定植部位,难以根除,导致长期慢性感染。约有65%的细菌感染与生物被膜的形成有关[34]。在细菌生物被膜的形成过程中,前噬菌体发挥着重要的作用。
4.1 前噬菌体影响细菌产毒的同时也影响生物被膜的形成
有些细菌由于前噬菌体的存在而具有产毒能力并能形成生物被膜,但当前噬菌体消失后,菌体变得不能产毒且同时也丧失了形成生物被膜的能力。
霍乱弧菌的霍乱毒素CT(cholera toxin)的编码基因(ctxA和ctxB)位于前噬菌体CTXφ上,带有CTXφ的菌株为产毒菌株,当CTXφ缺失后,产毒菌株变为非产毒菌株。非产毒菌株不仅丧失了毒力,同时也丧失了形成生物被膜的能力,其原因与位于染色体上的调控基因aphA密切相关。aphA的产物AphA既调控包括前噬菌体CTXφ上的ctxA和ctxB在内的毒力基因的表达,又调控形成生物被膜的基因的表达。前噬菌体CTXφ缺失后,使aphA的转录水平降低,进而影响到形成生物被膜的基因的表达。CTXφ缺失后是如何导致aphA的转录水平降低的还不清楚,但推测aphA的转录水平受细胞里CT等毒力因子的浓度的反馈调节,当CTXφ存在时,CT浓度高,aphA的转录水平高,CTXφ缺失后,无CT产生,aphA的转录水平就下降了,继而导致菌体丧失形成生物被膜的能力[35]。
4.2 前噬菌体参与液晶状生物被膜的形成
当细菌的生物被膜呈现出高度有序的状态时,即成为了液晶状生物被膜(图1)。与非液晶状生物被膜即普通生物被膜相比,液晶状生物被膜的黏附力和抗逆性更强,因此,液晶状生物被膜使细菌的毒力增强,这种增强与菌株携带的前噬菌体密切相关。
铜绿假单胞菌(Pseudomonasaeruginosa)PAO1菌株就能形成液晶状生物被膜,这与PAO1菌株携带的前噬菌体Pf4密切相关。Pf4是一种丝状噬菌体(filamentous bacteriophage)。当PAO1菌株由自由生活阶段切换到生物被膜生活阶段后,菌体中发生前噬菌体Pf4的诱导而产生子代噬菌体颗粒,随之裂解宿主菌,被裂解的菌体DNA和释放出来的大量Pf4参与生物被膜基质的构建,丝状的Pf4将生物被膜基质组织成高度有序的液晶状(图1),这种液晶状的基质使生物被膜的黏附力、抗干燥能力和耐受抗生素的能力增强。奇妙的是,基质中的Pf4噬菌体并不会导致被膜中细菌的消亡,而是与宿主菌共生存在于液晶状的生物被膜中[36]。
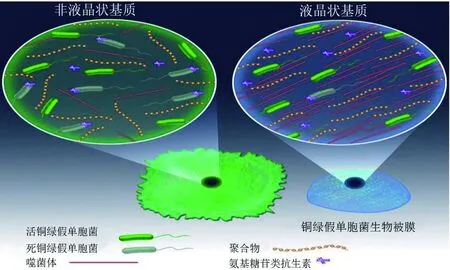
此图来自参考文献[36]
4.3 前噬菌体促进eDNA的释放
胞外DNA(extracellular DNA, eDNA)是生物被膜基质中重要的结构性成分,其能促进细菌细胞附着和生物被膜的形成[37]。前噬菌体对生物被膜中eDNA的增加有贡献。如,龋齿放线菌(Actinomycesodontolyticus)菌株XH001在形成生物被膜时,菌体中的前噬菌体xhp1发生自发诱导(spontaneous induction),导致部分细菌细胞裂解而释放出菌体DNA,菌体DNA作为eDNA参与生物被膜的构建[38]。
4.4 细菌通过调控前噬菌体的诱导促进生物被膜的形成
在生物被膜形成的早期,细菌群落作为一个整体可以从有限的前噬菌体诱导中受益,但过量的前噬菌体诱导使大量菌体裂解消亡反而不利于生物被膜的形成,因此,为了更好地促进生物被膜的形成,细菌会对前噬菌体的诱导进行调控。
铜绿假单胞菌菌株PA14含有前噬菌体Pf5。在生物被膜形成过程中,前噬菌体Pf5的诱导受菌体细胞中DppA1的调控。DppA1是ABC转运系统(ATP Binding Cassette transporter system)DppBCDF的一个底物结合蛋白(substrate binding protein, SBP),DppA1结合的底物是二肽和三肽。DppA1能抑制前噬菌体Pf5的诱导,从而限制大量裂解性子代噬菌体的产生,控制了大量菌体裂解事件的发生,进而增进生物被膜的形成。DppA1如何具体抑制前噬菌体Pf5的诱导还未探究清楚,但推测,当胞外氮源充足时,DppA1通过转运二肽给Pf5整合酶或切除酶传递了一个抑制前噬菌体切除的信号;当胞外氮源匮乏时,DppA1转运二肽的活动减弱,抑制信号消失,Pf5被诱导,产生大量的子代噬菌体,菌体裂解,生物被膜出现空洞而发生溃散[39]。细菌还可以通过转录因子Hha[40]和群体感应(quorum sensing, QS)系统[41]控制前噬菌体的诱导以促进生物被膜的形成。
5 前噬菌体降低细菌的毒力
多数情况是,溶原性噬菌体携带毒力基因,侵入宿主菌,从而增强宿主菌的毒力,而少有溶原性噬菌体使病原菌毒力减弱的情况,下面就介绍一下前噬菌体降低细菌毒力的研究。
5.1 前噬菌体的特异性整合降低了细菌的毒力
溶原性噬菌体整合到宿主细菌基因组的位置并非千篇一律。大多数噬菌体的整合位置是在非编码RNA(Non-coding RNA)中,其中tRNA是最为常见的位置。少数溶原性噬菌体整合到细菌编码蛋白质的基因中,从而破坏了该蛋白质的功能,如果这个蛋白质是毒力因子,那么细菌的毒力则会下降。
研究发现,支气管败血波氏杆菌(Bordetellabronchiseptica)菌株Bb01整合了溶原性噬菌体PHB09后,毒力下降。测序后发现,PHB09整合到了宿主基因组编码菌毛蛋白的基因中。菌毛蛋白能形成毛发样的菌毛,位于细菌表面,起黏附作用,是重要的毒力因子。前噬菌体PHB09插入到菌毛蛋白基因中,破坏了菌毛蛋白的合成,这可能就是导致菌株Bb01毒力降低的原因。用携带前噬菌体PHB09的溶原菌(相当于减毒菌株)对小鼠滴鼻免疫后,可以完全保护小鼠免受有毒力的支气管败血波氏杆菌的致死攻击,显示了前噬菌体减毒溶原菌作为疫苗的潜力[42]。
5.2 同一种前噬菌体对不同的菌株在毒力方面的影响不同
同一种前噬菌体对一种细菌中的不同菌株的毒力的影响效果不同,有的使其毒力增强,而有的则使其毒力减弱,这些现象体现出前噬菌体对细菌毒力影响的复杂性。
在肠道沙门氏菌(Salmonellaenterica)中,有一个bstA基因,其编码一个功能尚未知的蛋白,位于前噬菌体BTP1上。对于鼠伤寒沙门氏菌序列型为313的菌株02-03/002,当bstA缺失后,菌株在巨噬细胞内的存活率下降,对小鼠的毒力也下降,显然bstA是一个毒力基因[43]。但是,对都柏林沙门氏菌(S.entericaserovar Dublin)菌株3246来说,情况则相反,当bstA缺失后,菌株在巨噬细胞内的存活率上升,对小鼠的毒力增强,显然bstA是一个抗毒力基因[44],与之相同的是,对鼠伤寒沙门氏菌ST313参考菌株D23580来说,不管是缺失bstA基因,还是缺失整个前噬菌体BTP1,菌株均表现出毒力增强[45]。从后面这种情况来看,携带有bstA的前噬菌体BTP1具有降低肠道沙门氏菌毒力的能力。为什么同一种前噬菌体对不同的菌株在毒力方面的影响截然相反,这还有待进一步的探究。
5.3 利用抗毒力前噬菌体阻遏细菌毒素的产生
利用抗毒力前噬菌体可以阻遏病原菌毒素的产生。肠出血性大肠杆菌(enterohemorrhagicE.coli, EHEC)是产志贺毒素大肠杆菌,Stx中的Stx2是导致危及生命的溶血性尿毒综合征的重要毒素。Stx2的编码基因位于λ噬菌体933W上。在溶原状态下,细菌并不产生Stx2,因为前噬菌体933W通过表达阻遏蛋白cI,阻止了stx2基因和裂解基因的表达。但当发生诱导如自发诱导或有抗生素等诱导剂存在时,阻遏蛋白cI发生降解,对stx2基因和裂解基因表达的阻遏作用丧失,前噬菌体933W进入裂解循环并表达Stx2,导致菌体裂解并释放Stx2[22]。由此可见,阻止Stx2产生的关键是维持cI的阻遏功能,保持噬菌体933W的溶原状态。Hsu等利用基因工程技术构建了一个抗重复感染排斥(superinfection exclusion)的温和性杂合噬菌体(hybrid phage)λBH2,λBH2带有突变了的cI基因,该基因表达出的阻遏蛋白cIind-不可降解。用λBH2侵染含有前噬菌体933W的大肠杆菌即E.coli933W后,产生了含有两个前噬菌体的双溶原菌(double lysogen),这样的细菌发生诱导时不产生Stx2,因为内源性前噬菌体933W产生的cI降解后,有λBH2表达的不可降解阻遏蛋白cIind-替补cI的阻遏作用,阻止stx2基因的表达,维持933W的溶原状态[46]。像λBH2这种抗毒力前噬菌体具有预防和治疗产毒病原菌导致的疾病的应用潜质,所以这类研究将会非常令人期待。
6 总结与展望
细菌基因组测序结果显示,前噬菌体广泛存在于细菌的基因组中。越来越多的研究表明,前噬菌体和细菌的毒力密切相关。本文从前噬菌体增强细菌的黏附性、前噬菌体编码细菌毒素和调控毒素的产生与释放、前噬菌体协助细菌逃避宿主防御、前噬菌体参与细菌生物被膜的形成和前噬菌体降低细菌的毒力方面论述了前噬菌体对细菌毒力的影响,以期增加人们对噬菌体的了解,同时为研究细菌的毒力提供参考,进而为人们制定从噬菌体的角度来消除病原菌的方针和策略提供依据。
前噬菌体对细菌的毒力既有增强作用也具有减弱作用。将来人们可以充分发挥前噬菌体的有益作用,以控制或消灭病原菌。如,对于携带前噬菌体的病原菌,采用诱导的方法,促使前噬菌体进入裂解循环,裂解菌体,从而使病原菌消亡;利用基因工程技术对溶原性噬菌体进行改造,使其整合到细菌基因组的毒力基因中,破坏毒力基因,降低或消除细菌的毒力;利用抗毒力前噬菌体可以降低或消除细菌毒力的作用,研发有抗毒力的前噬菌体治疗剂,这种治疗剂不破坏机体正常菌群,因为它不是去消灭机体内的病原菌,而是将病原菌转化为无毒菌体,而传统的噬菌体治疗剂裂解体内病原菌时,可能会裂解与病原菌相近但属于正常菌群的菌体。当前,对噬菌体的研究仍在不断深入和扩展,相信将来会听到噬菌体给人类健康带来的福音。
