根际促生菌Enterobacter sp.EG16对小白菜生长及硒吸收的影响
2021-08-06刘东昀袁永强仇荣亮王诗忠黄雄飞黄海燕
刘东昀,袁永强,仇荣亮,3,4,王诗忠,3*,黄雄飞,黄海燕
(1.中山大学环境科学与工程学院,广州 510006;2.广东省环境污染控制与修复技术重点实验室,广州 510006;3.广东省土壤重金属污染修复工程技术研究中心,广州 510275;4.岭南现代农业科学与技术广东省实验室,广州 510642;5.河南润友林业技术服务有限公司,郑州 450008)
硒是人体必需的微量元素,然而我国硒分布却极不均匀,超过七成省份缺硒,国民日均硒摄入量远低于健康成年人日均55 µg 的硒参考摄入值[1]。因此,提高我国居民的日均硒摄入对保障国民的健康十分重要。食用富含硒的功能食品是目前人们较为有效的硒摄入方式[2],我国居民日常饮食以植物性食物为主,其中蔬菜在营养金字塔中占有重要地位。随着富硒蔬菜的推广应用,食用富硒蔬菜成为了一种有效的硒补充方式。
生物强化技术(Biofortification)是一项具有潜力和成本效益的农业技术[3−5],即通常使用硒酸钠或亚硒酸钠辅以不同的施用技术(浸种、土壤添加、叶面喷雾和水培营养液等[1,6−7])来提高农作物对硒的积累[8−9]。虽然施加较高的外源硒会增加硒在植物体内的累积,但研究表明,高浓度的硒通常会抑制植物的生长[7]。如赵秀锋等[10]在小白菜水培研究中发现,硒浓度超过4.0 mg·L−1时小白菜生长会受到抑制。李登超等[11]则发现矮抗青在5 mg·L−1的硒环境中生长较差。VERSINI 等[12]实验证明,20~100 mg·L−1浓度的含硒Hoagland营养液会对黑麦草生长有较强抑制作用。由此可知,尽管植物品种和培养环境各异,在水培条件下,外源硒浓度超过20 mg·L−1时一般都会对植物的生长产生不利影响。因此,仅增强外源硒补充难以满足生物强化的需求,还需要探索其他的生物强化措施。
植物根际促生菌(Plant grow−prompting rhizobac⁃teria,PGPR)是一类能够定殖于植物根际,并通过分泌植物激素、铁载体等方式促进植物生长、提高植物抗逆性的菌。这类菌在重金属污染土壤的植物修复中展现了良好的应用潜力。例如本研究团队筛选出的一种根际促生菌——Enterobactersp.EG16,该菌能分泌铁载体,缓解镉对植物的胁迫,并能促进植物生长[13−14]。近年来,一些研究发现PGPR 还具有辅助植物富硒的能力,如Bacillussp.B47 作为生物肥料接种于罗勒(Ocimum basilicumL.)根系后,植物茎部硒含量显著高于单纯土壤施硒肥[15]。而Bacillussp.E5 与丛枝菌根真菌共同接种会增加生菜茎部的硒含量,还会使叶绿素和抗氧化酶含量上升,生菜抗旱能力增强[16]。这些发现,促使PGPR 在生物强化上的应用潜力受到越来越多的重视[17−18]。此外,EG16还能够提高植物抗逆性。因此,将EG16应用于硒的生物强化,是很有价值的尝试。
硒生物强化的目标是既要增加植物中硒含量,又要避免因硒过量而造成作物产量显著下降[6,11]。农产品和环境中硒浓度的关系是影响PGPR 辅助的硒生物强化方法能否推广应用的一个关键问题[19]。目前关于PGPR 硒生物强化的研究侧重于探究微生物的功效,比如PGPR 促进植物吸收钙、钾等元素、辅助植物抵抗干旱胁迫、改变硒的形态、促进植物根毛增加等[15−16,20−21]。而目前的研究主要还存在两个方面的不足:一方面,已知较高浓度的外源硒会对植物产生抑制,虽然PGPR 具有一定的促生作用,但是PGPR 能否帮助植物抵御这种生理毒害还缺少研究;另一方面,当硒和PGPR 共同作用时,随着硒浓度的变化,PGPR是否能对植物具有持续稳定的促生和富硒效果的研究还十分有限。所以,探讨不同硒浓度下PGPR 对植物生长和硒吸收的影响,不仅能深入了解PGPR 的促生机制,而且有利于PGPR 辅助的硒生物强化技术的推广应用。
本研究以小白菜为实验对象,设置了不同硒浓度梯度下接种EG16的水培实验,以不接种EG16的处理作为对照,通过对比分析不同处理下小白菜的生长状况、生理变化和植物体的硒含量变化特征,探究不同硒条件下EG16对植物生长及其对硒吸收的影响。本研究有助于揭示EG16 的促生机理,为PGPR 在植物富硒的生物强化应用提供更多科学依据。
1 材料与方法
1.1 供试材料
供试菌株为Enterobactersp.EG16(广东省微生物菌种保藏中心,编号GDMCC1.808)。从低温保藏冰箱中取出甘油保存的EG16,在LB 培养液[22]中活化。在活化至第二代后,取出5 mL 菌液接种至100 mL 无菌LB液体培养基,37 ℃恒温振荡培养约48 h,形成菌悬液,备用。用紫外−可见分光光度法[23]测定菌悬液浓度。本研究中EG16 的菌悬液浓度约为7.65×109CFU·mL−1。
培养液为MS培养液,改进自赵德修等[24]的方法,即不加入有机成分、蔗糖和植物激素。一部分MS 培养液用无菌水分别稀释成1/2 MS 培养液和1/5 MS 培养液,备用。
供试植物为小白菜(Brassica chinensisL.),由广东省农业科学院蔬菜研究所提供。种子用温水浸泡2 h 后,选取大粒饱满的种子种植于家庭园艺营养土(绿源园艺有限公司)中,待幼苗长至2~4 片叶时,连根取出整个植株并洗净根部,随后进行炼苗。植株先后转移至1/5 MS 培养液和1/2 MS 培养液中各培养5~7 d,最后转移至原浓度的MS 培养液中培养1 周。待植物长至4~6 片叶后植物炼苗结束,可进行后续处理。
1.2 水培实验
本实验为两因子交叉设计,两个因子分别为不同硒浓度处理和接种EG16 处理。在无菌MS 培养液加入若干1 000 mg·L−1硒(Ⅳ)储备液(0.219 g的Na2SeO3溶于100 mL 无菌蒸馏水,并在超净工作台中过0.22µm 无菌滤头除菌),分别配制成含硒量为2、5、10、20 mg·L−1的MS 培养液。每个浓度的培养液分别取100 mL 装入若干个100 mL 锥形瓶中。小白菜炼苗结束后,挑选株高[(10.9±0.1)cm,n=50]、叶片数[(4.21±0.25)片,n=50]、鲜质量[(1.29±0.48)g,n=50]较为一致的植株,在超净台分别用无菌水和0.5%次氯酸钠(0.5 mL 活性氯含量7.5%的次氯酸钠溶液加入95.5 mL 的无菌水中,现配现用)冲洗根部若干次,进行根部灭菌处理,之后用无菌水洗去残余次氯酸钠。将小白菜定植于装有含2、5、10、20 mg·L−1硒的培养液的锥形瓶中,分别记为Se2、Se5、Se10、Se20。以不含硒的无菌MS 培养液水培作为对照,记为CK。接种PG⁃PR 处理的小白菜则需要进行根系定殖处理[25],即冲洗根部残余次氯酸钠后,将小白菜的根系浸泡在1 mL 的EG16 菌悬液中10~15 min,再将小白菜定植于装有含2、5、10、20 mg·L−1硒的培养液的锥形瓶中,定植环节残留的菌悬液全部注入培养体系,分别记为ESe2、ESe5、ESe10、ESe20。在不含硒的MS 培养液中水培接种了EG16 的小白菜作为含菌对照,记为E1。共10 种处理,每个处理5 个重复,共50 个样品(n=50)。最后,将定植后的小白菜置于人工温室培养,培养温度26 ℃,湿度60%,光照强度维持在60 µmol·m−2·s−1,日均光照时间12 h,培养21 d后收获。
1.3 取样与测定
小白菜在移栽前和收获后,均测量样品的株高、叶片数等生理性状。样品收获后用剪刀剪为地上部和地下部。将地下部用自来水洗净,使用EPSON Flatbed Scanner V750根系扫描仪进行扫描,分析根系性状(总根长、总根体积、根系直径、分支数)。
剪取每个样品同一叶片的同一位置,参照唐延林等[26]的方法测量叶绿素a、叶绿素b、类胡萝卜素含量。
称取约0.5 g的地上部组织,用考马斯亮蓝法[27]测量蛋白质含量。使用南京建成生物工程研究所的相应试剂盒提取并测定SOD(Superoxide dismutase,超氧化物歧化酶)、CAT(Catalase,过氧化氢酶)、POD(Per⁃oxidase,非特异性过氧化物酶)活性和MDA(Malondi⁃aldehyde,丙二醛)含量。
其余小白菜地上部和地下部分别冷冻干燥(新芝SCIENTZ−10N),然后碾碎成粉末状。湿式消解法[28]消解后,用电感耦合等离子体质谱仪(ICP−MS,型号PerkinElmer NexION 350D)测定总硒含量。同时设置空白对照样,并用芹菜样(GBW10048)作为质量控制样品,实测芹菜的质控样硒含量为(0.111±0.010)mg·kg−1[标准值为(0.118±0.070)mg·kg−1]。计算出生物富集系数(Bioconcentration factor,BCF)和生物转运系数(Translocation factor,TF)来表示小白菜对硒的富集和转运能力,计算公式如下:
生物富集系数=植物体总硒浓度(mg·g−1)/培养液总硒浓度(mg·L−1)
生物转运系数=植物地上部总硒浓度(mg·g−1)/植物地下部总硒浓度(mg·g−1)
1.4 数据处理
用SPSS(Version 22)软件进行双因素方差分析(Two−way ANOVA),各实验组间数据差异用Duncan方法进行检验。用Origin 2018绘图。
2 结果与分析
2.1 植物生长指标的变化
由图1 可知,硒对小白菜的株高、叶片数、鲜质量均产生显著影响(PSe≤0.01)。收获后,CK 处理的株高为13.5 cm,叶片数为5.93 片,鲜质量为2.27 g。而Se2、Se5 处理的株高比CK 处理分别高7.43%、17.1%,叶片数分别高18.5%、19.7%,鲜质量分别高62.8%、33.3%。可见,硒浓度低于5 mg·L−1时,硒的加入对小白菜地上部的生长具有促进作用。但随着硒浓度的继续升高,小白菜生长受到硒的抑制越来越明显。具体表现为,Se10 处理虽然鲜质量和叶片数仍大于CK处理,但株高却比CK处理低11.4%,小白菜生长受到部分抑制;而Se20 处理株高、叶片数、鲜质量均低于CK处理,此时小白菜生长受到严重抑制。其中,小白菜的萎蔫是株高等物理指标数据减少的主要原因。这说明较低浓度硒会促进生长,而较高浓度的硒则对小白菜产生胁迫。根据培养时的观察,Se20 处理的小白菜在移植后第7 d 便开始出现叶片发黄、植株萎蔫等生理现象。移植14 d后,该处理的部分植株开始死亡,到第21 d收获时,该处理的大部分植株已完全枯黄死亡。这也说明了高浓度硒对小白菜产生不利影响。
在小白菜根际接种EG16(接种量7.65×109CFU,下同)后,如图1 所示,E1 处理的小白菜株高为12.8 cm,叶片数为7.00片,鲜质量为3.80 g,叶片数和鲜质量高于CK 处理,尤其是鲜质量显著高于CK 处理67.6%,表明EG16 的加入对小白菜有较好促生作用。根据图1B,在2 mg·L−1的外源硒环境下,ESe2 处理的叶片数高于其他处理,尤其是高于同硒浓度下不接种EG16 的Se2 处理。结合方差分析中PSe<0.01、PSe×E<0.01 的结果,可以推测EG16 和硒的共同作用会更加有利于小白菜叶片生长。当硒浓度大于或等于10 mg·L−1,接种了EG16 的小白菜生长同样受到抑制,具体表现为ESe10、ESe20 处理的叶片数和鲜质量均显著小于CK处理。因此,接种EG16不会影响硒对小白菜低促高抑的作用。据观察,ESe20 处理的植株样品在移植第7 d 起也出现了如Se20 处理生长不良的现象。但该处理的植物存活时间相对较久,在移植14 d后存活的植株数多于Se20 处理。到第21 d 收获时,ESe20 处理尚有超过一半的植株存活,说明EG16 具有缓解高浓度硒对小白菜生长胁迫的潜力。综合以上结果,在本研究的水培条件下,硒对小白菜生长由促进转向抑制的浓度阈值范围在5~10 mg·L−1。
2.2 植物根系形态变化
根据图2,CK 处理的小白菜总根长可达525 cm,根系直径约0.173 cm,总根体积达28.5 cm3,分支数达3 566 个。与CK 处理相比,Se2、Se5 处理组的小白菜总根长分别增加了39.6%、25.9%,总根体积分别增加了43.2%、80.4%,分支数分别增加了42.2%、49.6%,根系直径仅增加了1.35%、17.2%,硒浓度的增加对根系产生了较大促生作用。Se10 处理总根长比CK 处理减少19.1%,根系直径却增加43.0%,总根体积增加18.5%,分支数仅增加1.53%,该处理对小白菜根系的促生效果较弱。Se20 处理组中小白菜根系的生长受到显著抑制,总根长、总根体积、分支数分别比CK 处理减少了80.9%、66.8%、73.9%。方差分析发现,硒对所有根系性状变化均产生了显著影响,说明硒对小白菜根系生长同样具有低促高抑作用。
由图2可知,当加入EG16菌后,E1处理的小白菜总根长为615 cm,根系直径为0.215 cm,总根表面积为38.2 cm2,分支数达5 314个。单因素方差分析显示接种处理对4 个根系指标均没有显著影响,但各项根系性状数据均比CK处理高,说明EG16的加入一定程度上利于根系生长。
根据双因素方差分析,硒与EG16 两个因素的交互作用对总根长、总根体积、分支数产生显著影响,而根系直径只受到硒处理的显著影响。此外,ESe2、ESe5、ESe10、ESe20 处理的根系直径比CK 处理分别增加了15.6%、14.6%、36.3%、41.8%,可见接菌处理的小白菜根系随硒浓度增加而变粗。而其他根系指标中,ESe2、ESe5 处理的小白菜总根体积比CK 处理分别增加43.3%、95.3%,分支数分别增加13.3%、91.8%。同时,ESe5 处理的小白菜总根长比CK 处理增加44.5%,且其他的根系指标均比E1 处理和同硒浓度环境下的Se5 要高。ESe10、ESe20 处理比CK 处理总根长分别低78.9%、26.1%,总根体积分别低71.7%、23.7%,分支数分别低66.9%、24.1%,根系生长受到明显抑制。可见接种EG16对小白菜的根系生长具有一定促进作用。
2.3 植物叶绿素含量的变化
叶绿素含量在一定程度上反映了植物光合作用的能力。根据图3,CK 处理的小白菜叶绿素a、叶绿素b、类胡萝卜素平均含量分别为5.98、2.62、2.87 mg·g−1;E1 处理的叶绿素a、叶绿素b、类胡萝卜素含量分别为5.87、2.69、2.80 mg·g−1。硒浓度低于10 mg·L−1时,不论是否接种EG16,小白菜各类叶绿素含量均和CK 处理差异不显著。但当硒浓度达到10 mg·L−1时,接种EG16 对叶绿素含量产生了明显影响。与CK 处理相比,Se10 处理叶绿素a、叶绿素b、类胡萝卜素分别减少25.9%、7.53%、23.3%,而ESe10 的各项叶绿素却分别增加19.1%、53.7%、21.5%。可见10 mg·L−1的硒处理可能会降低小白菜的叶绿素含量,而EG16 的加入则有利于其叶绿素的合成。但在硒浓度达到20 mg·L−1时,Se20、ESe20 两个处理的叶绿素a 比CK 处理分别减少17.3%、28.5%,类胡萝卜素分别减少10.3%、25.6%。因此,在20 mg·L−1硒浓度条件下,无论接种EG16与否,小白菜各类叶绿素含量均降低,生长受到抑制。
2.4 蛋白质含量和抗氧化酶的变化
根据图4A,CK 处理的小白菜地上部蛋白质含量为1.38 mg·g−1,随着硒浓度增加,除Se2、Se10 处理略低于CK(减少6.91%、2.38%)外,小白菜蛋白质含量呈上升趋势,其中Se5、Se20 处理蛋白质含量比CK 处理分别增加了16.5%、21.3%。根据双因素方差分析,硒处理对蛋白质含量产生影响显著。在接种EG16的处理中,E1处理的蛋白质含量为1.21 mg·g−1,低于CK处理11.9%。随着硒浓度的上升,蛋白质含量也逐步上升,且ESe20处理的蛋白质比同硒浓度的Se20处理高8.00%。可见EG16和Se的共同作用会导致低硒环境中小白菜的蛋白质含量减少,但可提高高浓度硒环境中小白菜的蛋白质含量。
根据图4B,本研究中EG16 和硒的加入,对小白菜体内的SOD无显著影响。但POD、CAT的变化则有所不同。根据图4C,CK处理中CAT的活性为44.7 U·g−1,且随着硒浓度的增加呈现先降低后增加再降低的趋势。其中Se10 处理的CAT 活性为59.6 U·g−1,在所有不接种EG16处理中活性最强。仅接种EG16时,小白菜的CAT 活性显著降低,具体表现为E1 的CAT 活性为38.2 U·g−1,显著低于CK 处理。在接种EG16 的基础上,硒对CAT 活性的影响表现为低促高抑,其中ESe5 处理的CAT 活性达到60.2 U·g−1,是所有接种菌处理中活性最高的。当硒浓度≤5 mg·L−1时,同浓度硒条件下,接种处理的CAT 活性均大于不接种处理;但当硒浓度≥10 mg·L−1时,接种的CAT 活性则都小于同硒浓度的不接种处理。由此可知,单独的EG16 接种可降低小白菜CAT 活性;EG16 和≤5 mg·L−1的硒共同作用时,可提升CAT 活性且提升幅度大于单独的硒处理;而EG16 和≥10 mg·L−1的硒共同作用时,尽管CAT 活性仍高于CK 处理,但增强效果不如单独的硒处理。
根据图4D,CK 处理POD 活性达873 U·g−1,与之相 比,ESe10、ESe20处理的POD活性显著增高47.7%、82.4%,同时也比同硒浓度的Se10、Se20 处理活性高。除ESe20 处理外,其他处理的POD 均与CK处理无显著差异。可见,当硒浓度≤5 mg·L−1时,EG16和硒对小白菜POD 活性的作用较小,但当硒浓度≥10 mg·L−1时,硒与EG16 菌共同作用会显著提高POD 的活性。
2.5 MDA含量的变化
MDA 作为膜脂过氧化作用的指标,其含量越高一般说明植物遭受的伤害越大。根据图5,CK处理的MDA 含量为12.4 nmol·g−1,随着Se 浓度的上升,小白菜体内的MDA 含量分别比CK 处理增加了4.59%、5.25%、36.1%、69.8%。在硒浓度≤5 mg·L−1时,接种EG16 有效降低了MDA 含量,此时E1、ESe2、ESe5 处理的MDA 含量比CK 处理分别降低了33.1%、24.3%、0.3%。但当硒浓度≥10 mg·L−1时,接种处理的MDA含量均大于同硒浓度的不接种处理。可见,在一定的硒浓度范围内,接种EG16能缓解小白菜的生理胁迫。
2.6 不同处理对植物硒总量的影响
植物体内的硒总量反映了植物吸收硒的能力。除了Se20 和ESe20 两个处理,小白菜硒含量(包括地上部、地下部)随着外源硒浓度的升高而上升;生物富集系数先增大后降低,并在5 mg·L−1时达到最大,而生物转运系数则下降(表1),且这些变化趋势不受接种EG16 的影响。单因素方差分析发现,硒浓度的变化对生物转运系数、生物富集系数、地上部和地下部硒含量均有显著影响(表2),因此外源硒浓度是影响小白菜吸收硒的重要因素。当硒浓度不超过5 mg·L−1时,同硒浓度下,接种处理的地下部硒含量虽然略低于不接种处理,但是地上部硒含量差别很小,最终表现为生物转运系数较高(表1),根据双因素方差分析,硒与EG16 的共同作用对生物转运系数有显著影响(表2,PSe×E<0.01)。这说明EG16的接种有利于硒从小白菜的地下部向地上可食用部分的转运。
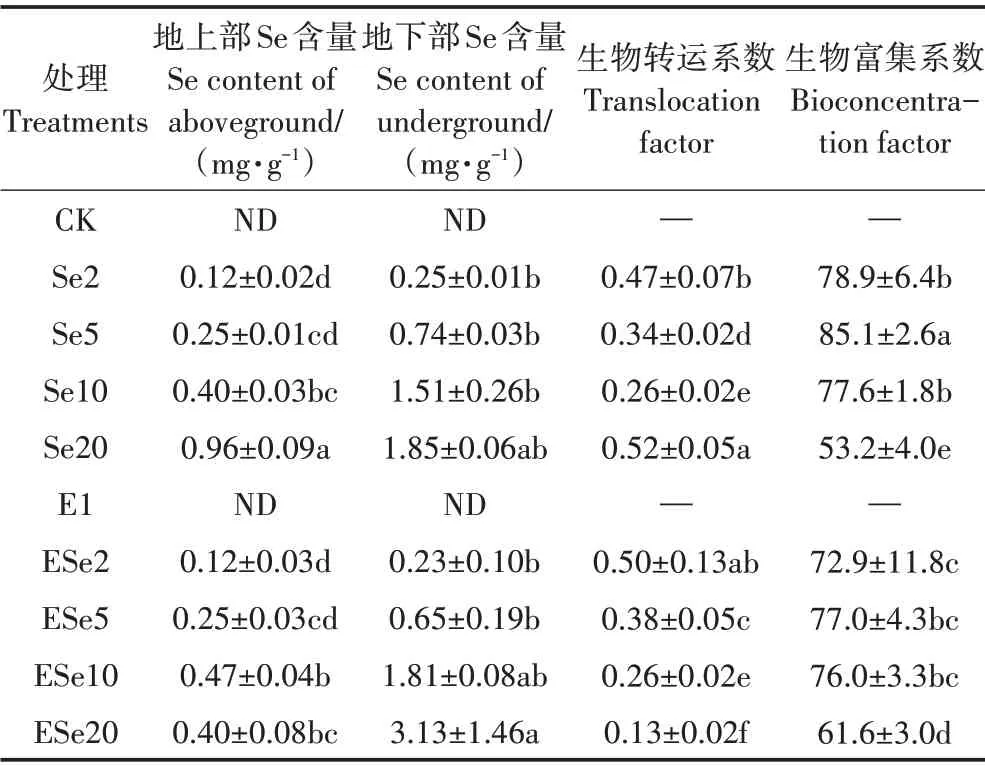
表1 植物地上部、地下部的总硒含量Table 1 Concentrations of Se in aboveground and underground parts of plants

表2 硒含量的双因素方差分析Table 2 Two−way ANOVA for Se content
当硒浓度大于10 mg·L−1时,同硒浓度下的地下部硒含量均高于不接种的处理(表1),尽管方差分析表明,EG16以及EG16和硒的共同作用对地下部硒含量的影响并不显著,但从结果看,接种EG16有利于硒在植物地下部的富集。当硒浓度升高至20 mg·L−1时,与Se20 处理相比,ESe20 处理中地下部硒含量显著上升,地上部硒含量却有所下降(表1)。ESe20 处理的生物富集系数明显大于Se20 处理,但转运系数却低于Se20 处理。即在20 mg·L−1的硒浓度下,接种处理的小白菜将硒富集于小白菜地下部的能力明显增强,但将硒从地下部转运至地上部的能力显著降低,最终地上部的硒含量低于不接种处理。方差分析表明,EG16 单独作用(PE<0.01)与菌和硒的共同作用(PSe×E<0.01)对地上部硒含量影响显著(表2)。说明EG16的接种可能对植物硒的转运造成了影响。结合Se20处理中小白菜大多萎蔫,而ESe20处理小白菜大多存活的现象,在硒浓度为20 mg·L−1环境下植物硒含量的变化也可能与植物生长状态的不同有关。
3 讨论
植物体内的硒主要来源于生长环境,施加外源硒是普遍采用的富硒生物强化措施。虽然硒是否为植物的必需元素目前还存在争议,但诸多研究均证实硒的加入对植物生长具有一定促进作用,且较高浓度的外源硒会增加植物体硒的累积[1,6−7]。然而较高浓度的硒通常也会抑制植物的生长。如本研究发现,硒浓度≤5 mg·L−1时促进小白菜生长,而硒浓度≥10 mg·L−1时则抑制生长。其他的研究也有类似发现,赵秀锋等[10]在小白菜水培研究中发现当硒浓度为0~2 mg·L−1时,硒不仅促进小白菜的生长,还缓解了小白菜受到的铅胁迫;但当硒浓度超过4 mg·L−1时,小白菜的生长将受到抑制。对水稻的研究则发现,当土壤中硒浓度低于5 mg·kg−1时对水稻生长有利,但高于5 mg·kg−1时会影响水稻抗胁迫的能力[7]。由于植物品种和培养环境的不同,不同研究中硒对植物产生毒害的阈值有所不同,但这些研究结果共同说明,硒浓度较高时会对植物生长产生抑制。因此在实际的富硒蔬菜培育过程中,需要注意外源硒的施用浓度,避免较高的外源硒施用造成硒胁迫,导致蔬菜产量下降。
为了探寻更加有效的硒生物强化措施,研究者们开始关注PGPR,如今已发现一些菌株能较好地促进植物的生长。如MOTESHAREZADEH 等[15]发现接种Bacillussp.B47 可以增强罗勒(Ocimum basilicumL.)吸收硒、钾与磷的能力,并使罗勒鲜质量增加。郭雨晴等[29]在荒漠植物根际土中分离并筛选出了Arthro⁃bactersp.BP4 等多种PGPR,这些菌的接种有助于高粱幼苗鲜质量的增加。本研究使用的PGPR,即EG16,也有相似的能力。接种EG16 能显著增加小白菜鲜质量(图1C)、促进根系生长(图2)、降低生理胁迫(图5),这说明单独接种EG16 对小白菜具有良好的促生作用。PGPR 一般通过固氮、溶磷、产生铁载体和分泌植物激素等方式促进植物生长[30−31]。本研究水培环境的氮、磷、铁等元素总量固定且多为植物可直接吸收的可溶态,因此EG16 对小白菜的促生作用可能与其分泌植物激素的功能有关。本研究团队此前证实,EG16 具有分泌生长素IAA(Indole−3−ace⁃tic acid,吲哚乙酸)的能力[14]。这为探究EG16 的促生机制提供了一些线索,但具体的作用机制还有待后续研究。
通过水培实验,本研究发现,EG16的接种不会改变硒对小白菜产生的低促高抑的影响(图1、图2)。但在不同的硒浓度下,EG16 和Se 的共同作用会对小白菜的生长产生不同的作用。与单独施加硒或接种EG16的处理相比,EG16和低浓度(≤5 mg·L−1)硒共同作用确实会对小白菜产生更好的促生效果。表现为小白菜叶片数增多(图1B)、根系分支更多(图2)和受到的生理胁迫减低(图4、图5)。可见,EG16 在富硒蔬菜的培养应用上有着极大的潜力。
当培养液中硒浓度较高(≥10 mg·L−1)时,小白菜生长受到较强抑制。不论接种EG16 与否,大部分生长指标均有明显下降(图1、图2),受到的生理胁迫也有所增强(图5)。但接种处理的小白菜抗逆性显著增强,尤其表现为POD 活性显著上升(图4)。POD 具有歧化H2O2、保护植物细胞膜作用[32],其活性的增加能一定程度上缓解植物所受的生理胁迫[33]。其他研究也曾发现PGPR 促进植物体内抗氧化酶的活性增强,从而增强植物抗逆性的现象[17,34]。如DURAN等[16]通过在生菜根部接种Bacillussp.E5 从而提升生菜的抗旱能力;黄瓜接种了短芽孢杆菌CH1 后,SOD、POD、CAT 活性明显高于不接种处理[35]。小白菜的长势也印证了抗逆性的增强产生了作用,收获时接种处理(ESe20 处理)的小白菜中枯萎的植株数量显著少于不接种处理(Se20 处理)。这表明EG16 能协助植物抵御较高硒浓度带来的生长胁迫,这种功能使得EG16在硒污染地区的植物修复上也具有一定的应用潜力。
EG16 不仅影响小白菜生长,还对硒的吸收及转运也具有一定的调控作用。本研究中,在2~5 mg·L−1的低硒环境下,EG16 和硒的共同作用虽然没有明显增加小白菜地上部硒的吸收,但增强了小白菜将硒转运至可食用部分的能力(表1、表2),从生长指标上看,其对小白菜也有较好的促生作用(图1、图2)。而当硒浓度为10 mg·L−1时,EG16 的接种增加了小白菜地上和地下部的硒含量(表1、表2),但小白菜的生长却受到了一定的抑制(图1、图2)。因此在实际的富硒蔬菜培养过程中,使用0~5 mg·L−1硒浓度配合接种EG16可达到较好的硒生物强化效果。
在培养液硒浓度达到20 mg·L−1时,不接种处理的地上部硒含量显著增加,但地下部硒含量则变化较小。而接种处理的小白菜地下部硒含量显著增加,但地上部硒含量却变化较小,表现为从环境中吸收硒的能力增强,转运能力减弱(表1、表2)。结合此前的观察到的接种处理的小白菜抗逆性增强、存活时间比不接种处理长的现象,小白菜逐渐枯萎的过程对地上部和地下部硒含量的变化有一定影响。
研究表明,植物通常借助根系转运蛋白的主动运输过程吸收亚硒酸盐[36−37],因此不接种处理小白菜在逐渐枯萎过程中,其主动吸收硒的能力也逐渐下降,进而使植物根部硒含量没有随环境中的硒浓度升高而明显增加。而不接种处理向地上部转运硒的能力较强(表1),这可能与植物器官衰亡过程中养分在植物体内的重新分配有关。有研究表明,植物的维管系统(包括木质部和韧皮部)可将营养物质从衰老或死亡器官转运并重新分配到其他的器官中[38−39]。而高浓度的硒会抑制植物生长并损坏其运输系统,造成养分运输紊乱[40]。这可能使不接种处理的小白菜根部大量的硒也随着养分一同被转运至地上部,进而使生物转运系数升高。相较之下,高浓度硒环境中接种处理(ESe20)的小白菜地上部硒含量变化较为平稳。可能是EG16 在高浓度硒环境下会保护植物的运输系统,避免过量的硒随着养分进入地上部,造成更严重的生理胁迫。这也许是PGPR 协助植物应对高浓度硒胁迫而调控硒转运的一种策略。
微生物对植物吸收及转运硒的调控还受其他因素影响,例如营养供给及植物生长状况等。有研究表明,在钙、钾、镁、磷等养分充足时,PGPR 会增强植物对大量营养元素的吸收,促进植物生长,进而提高植物对硒的吸收[16]。此外,也有研究发现,部分PGPR可通过改变硒的形态影响植物对其吸收[20,41]。更重要的是,植物对硒的吸收与转运离不开磷酸盐、硫酸盐等转运蛋白参与[36,42],而微生物很可能会提高某些转运蛋白的活性,从而提高对硒的吸收[43]。因此,在本研究工作的基础上,还需针对EG16 调控植物对硒的吸收与转运的机制进行进一步研究。
4 结论
(1)硒对小白菜的地上部和地下部生长均产生低促高抑的影响,且这种影响不因接种EG16 与否而发生改变。当浓度≤5 mg·L−1时,硒能促进植物生长,但当硒浓度≥10 mg·L−1时,植物生长受到抑制。
(2)仅接种EG16可促使小白菜鲜质量增加、促进根系生长,还能缓解由MDA升高带来的生理毒害。
(3)环境硒浓度较低(≤5 mg·L−1)时,与不接种处理相比,接种EG16处理的小白菜叶片数更多、根系更长、分支数更多、CAT活性更高。此时EG16还对硒由地下向地上的转运有一定的促进作用。EG16和硒的共同作用也呈现出较好的植物促生作用。
(4)环境硒浓度较高(≥10 mg·L−1)时,小白菜根系的硒含量显著上升,但其生长受到严重抑制。而接种EG16 处理的小白菜存活率高于不接种处理,蛋白质含量也更高,POD活性显著增强,表明EG16能适度提高植物的抗逆能力。
