罗非鱼皮胶原蛋白肽-锌螯合物的制备及结构表征与体外消化分析
2021-08-02柯枭胡晓杨贤庆陈胜军吴燕燕薛长湖李来好
柯枭,胡晓,杨贤庆,陈胜军,吴燕燕,薛长湖,李来好*
1(中国海洋大学 食品科学与工程学院,山东 青岛,266003)2(中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,农业农村部水产品加工重点实验室,广东 广州,510300)
罗非鱼是一种广泛养殖的淡水鱼,目前罗非鱼工业化产品主要为鱼片,加工过程中会产生大量的副产物,如头部,内脏,骨骼,鱼皮和鱼鳞。其中鱼皮含有丰富的胶原蛋白,可作为生物活性肽的理想原料。胶原蛋白具有特殊的三螺旋结构,其氨基酸序列呈现(G-X-Y)n周期性排列,G为甘氨酸,X多为脯氨酸[1]。因其含有丰富的甘氨酸和脯氨酸,因此具备良好的锌离子螯合能力的潜质[2-3]。本研究选用罗非鱼皮为原料,以期得到良好生物活性的螯合物。
锌是一种体内快速转换的微量元素,由于人体缺乏锌储存功能,因此每天需要从饮食中获得摄入量的20%~40%,以保持内环境的稳定[4]。锌在结构、催化和调节3个方面发挥重要作用[5],缺锌可能导致动脉粥样硬化、类风湿性关节炎、多种恶性肿瘤、神经系统疾病、自身免疫性疾病和衰老等慢性疾病[6]。传统的无机锌补充剂和有机锌补充剂与胃酸或者食物中的草酸结合易形成沉淀[7],导致锌的生物利用率较低[8]。因此,开发一种高效、安全且易吸收的锌离子补充剂至关重要。已有研究发现,多肽与锌离子形成可溶性螯合物,这种螯合物以整体的形式被消化吸收,能够有效地阻止锌在胃肠道中形成沉淀[9-11]。
本研究以罗非鱼为原料,分别用碱性蛋白酶、复合蛋白酶和胰蛋白酶提取胶原蛋白肽,以锌离子螯合率为指标,筛选出最佳活性的胶原蛋白肽。通过高效液相色谱对其分子质量分布进行测定,并借助线性拟合来探究分子质量分布与锌离子螯合率的相关性。运用紫外光谱和傅里叶红外光谱对其螯合位点进行探究,通过扫描电镜和原子力显微镜观察螯合前后的形态结构变化。此外采用体外模拟胃肠道消化模型评估肽-锌螯合物的生物利用率。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼皮,广东百维生物科技有限公司;碱性蛋白酶、胰蛋白酶、复合蛋白酶和胃蛋白酶,酷尔化学科技有限公司;硫酸锌,合肥巴斯夫生物科技有限公司;还原型谷胱甘肽(307.3 Da)、氧化型L-谷胱甘肽(612.63 Da)、杆菌肽(1 422.69 Da)、抑肽酶(6 511.44 Da)和细胞色素C(12 400 Da),北京睿博兴科生物技术有限公司;以上试剂均为分析纯。乙腈和三氟乙酸(色谱纯),Sigma-Aldrich化学试剂公司。
1.2 仪器与设备
Titrando-809型自动电位滴定仪,瑞士万通公司;KjeLtecTM-2300型蛋白自动分析仪,丹麦福斯分析仪器公司;THZ-C型台式恒温振荡器,太仓华美生化仪器厂;ALpha1-4型冷冻干燥机,德国Christ公司;AvantiJ26XP型高速离心机,美国贝克曼库尔特公司;LC-20AD高效液相色谱仪、IRAffinity-1型傅里叶变换红外光谱仪,日本岛津公司;电感耦合等离子体质谱,美国安捷伦公司;SU1510 型扫描电子显微镜,日本日立公司;Dimension-Icon 原子力显微镜,德国布鲁克公司。
1.3 实验方法
1.3.1 胶原蛋白肽制备
根据ZHANG等[12]方法略做修改。将罗非鱼皮切成1 cm×1 cm的小片,用2 g/L NaOH溶液(1∶10,g∶mL)溶液浸泡30 min以除去杂蛋白和色素,随后用蒸馏水冲洗直至pH=7。然后用2 g/L HCl 溶液浸泡15 min使其发生溶胀,并用蒸馏水冲洗直至pH=7。最后,将其在恒温水浴锅内40 ℃振荡5 h进行热提,经4 900×g离心20 min,上清液即为胶原蛋白溶液。
将获得的胶原蛋白溶液,分别用碱性蛋白酶,复合蛋白酶和胰蛋白酶在最适温度和pH下进行酶解,料液比1∶10,加酶量为0.5%(质量分数),结束后放沸水浴15 min 终止反应。经冷冻干燥,得到胶原蛋白肽的冻干粉。
1.3.2 水解度的测定
原料中总氮含量M1(g)均采用半微量凯氏定氮法测定;胶原蛋白肽的氨基态氮含量M2(g)采用甲醛电位滴定法测定。水解度计算如公式(1)所示:
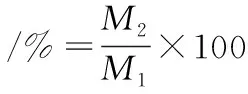
(1)
1.3.3 锌离子螯合率的测定
根据ZHANG等[13]的方法并作适当修改。5 mg/mL胶原蛋白肽与5 mmol/L ZnSO4溶于20 mmol/L的磷酸缓冲溶液(pH 5.0),在37 ℃螯合反应30 min。用分子质量100 Da的截留袋透析去除未螯合的锌离子,采用电感耦合等离子体质谱检测螯合锌含量。
1.3.4 分子质量分布的测定
使用凝胶色谱法在TSKgel G2000 SWXL色谱柱(300 mm×7.8 mm,5 μm)对碱性蛋白酶酶解6 h下的胶原蛋白肽进行分子质量分布的测定。将样品配制成2 mg/mL,经0.2 μm微孔滤膜过滤,装入棕色液相小瓶并装载到液相,液相条件:流动相A:含有0.1%(体积分数)三氟乙酸的超纯水;流动相B:含有0.1%(体积分数)三氟乙酸的乙腈;等度洗脱:20% B;流速:0.5 mL/min;紫外检测波长:214 nm。选取5种标准品:谷胱甘肽还原(307.3 Da),L-谷胱甘肽氧化(612.63 Da),杆菌肽(1 422.69 Da),抑肽酶(6 511.44 Da)和细胞色素C(12 400 Da),以保留时间为X轴,lg(MW)为Y轴,得到标准曲线y=-0.221x+6.879 4 (R2=0.995 6)。
1.3.5 螯合物的制备
将胶原蛋白肽与ZnSO4溶于20 mmol/L的磷酸缓冲溶液(pH 5.0),在37 ℃螯合反应30 min。用分子质量100 Da的截留袋透析去除未螯合的锌离子,将截留溶液冷冻干燥,得到螯合物白色粉末,备用。
1.3.6 螯合物的结构表征
1.3.6.1 紫外光谱
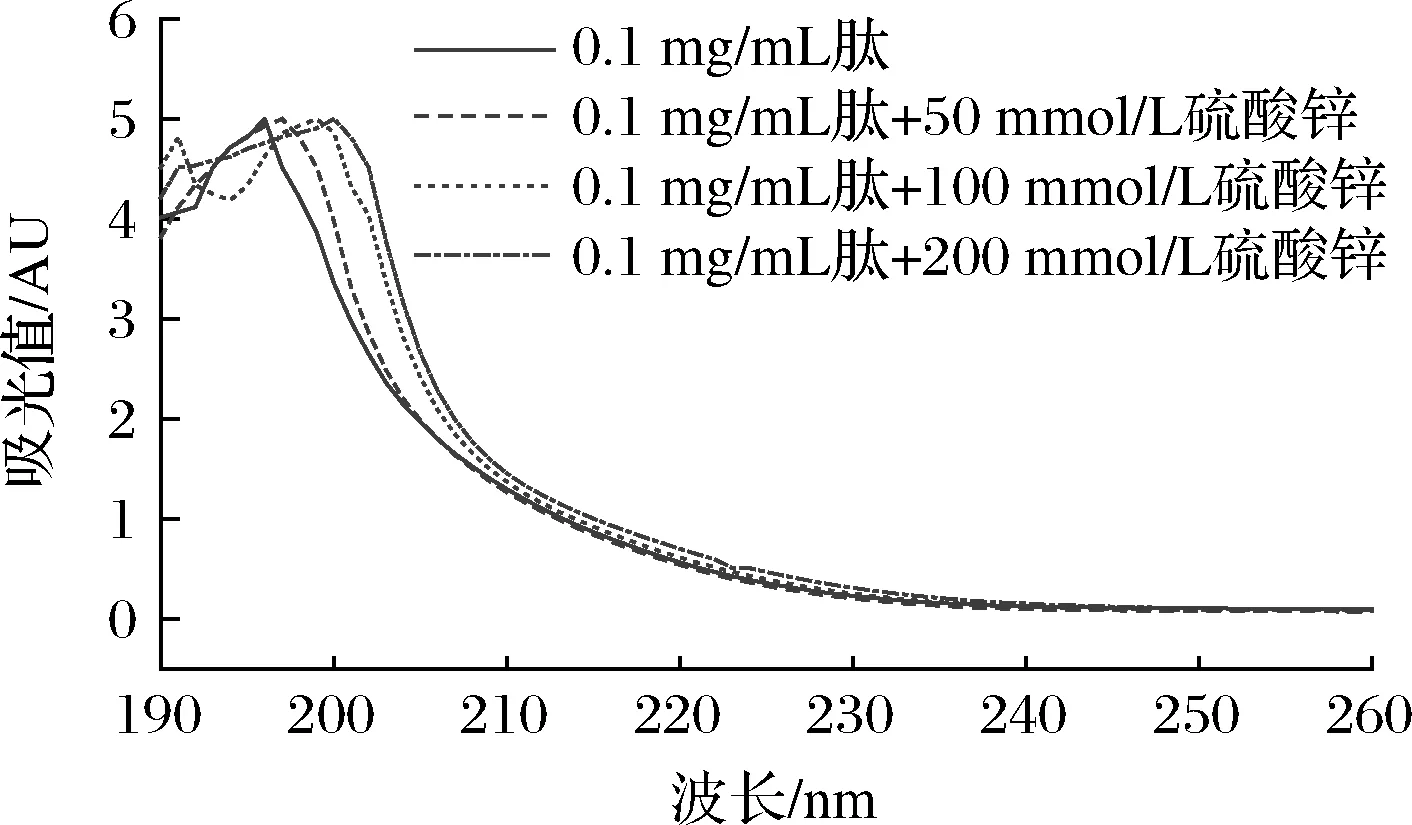
将胶原蛋白肽溶解于去离子水(0.1 mg/mL),然后加入不同浓度的ZnSO4溶液(0、50、100、200 mmol/L)进行螯合。以去离子水完成空白校准,紫外分光光度计的检测扫描波长范围为190~260 nm。
1.3.6.2 傅里叶变换红外光谱
将1 mg的肽和螯合物冻干粉分别与100 mg 干燥的KBr在玛瑙研钵中混合均匀,充分研磨至颗粒达到约2 μm,将混合物均匀放置在固体压膜模具,在8 T/cm2左右压力下保持1~2 min,得到透明的锭片。取出锭片,进行IRAffinity-1型傅里叶变换红外光谱检测,通过软件进行数据分析。
1.3.6.3 扫描电镜
将肽和螯合物冻干粉配制成溶液,均匀涂在样品架的玻璃片上并进行喷金处理,通过扫描电镜对肽和螯合物进行表面形态分析。
1.3.6.4 原子力显微镜
将肽和螯合物冻干粉用超纯水配制成0.5 mg/mL,在室温下用氮气将样品铺展在云母片表面上。采用轻敲模式,利用原子力显微镜分析肽和螯合物的表面形态。
1.3.7 模拟体外胃肠道消化
根据WANG等[14]方法略做修改。用0.1 mol/L HCl(pH 2.0)将肽-锌螯合物和ZnSO4配制质量浓度为5 mg/mL,加入胃蛋白酶(酶与底物的质量比为1∶50)模拟胃部环境,将混合物于37 ℃水浴振荡2 h。模拟胃消化后,添加1 mol/L NaOH溶液将pH调至7.5使胃蛋白酶失活。随后,向溶液中加入胰蛋白酶(酶与底物的质量比为1∶25)模拟肠道环境,并在37 ℃水浴振荡2 h。模拟胃肠道消化结束,消化液在沸水浴加热15 min以终止酶解。
肽-锌螯合物的稳定性评估:使用液相色谱法在Althena C18-WP色谱柱(250 mm×4.6 mm,5 μm,CNW Technologies)上对胃部消化、肠液消化后的消化液进行检测,评估肽-锌螯合物的稳定性。将消化液在12 000 r/min离心10 min,然后取上清液经0.2 μm微孔滤膜过滤,装入棕色液相小瓶并装载到液相。液相条件设置如下:流动相A:含有0.1%(体积分数)三氟乙酸的超纯水;流动相B:含有0.1%(体积分数)三氟乙酸的乙腈;洗脱梯度:90%~50% B,0~10 min;50%~10% B,10~18 min;10%~90% B,18~20 min;流速:0.5 mL/min;紫外检测波长:214 nm。
溶解率测定:分别取胃部消化、肠液消化后的消化液测定肽-锌螯合物和ZnSO4的溶解率。将溶液在12 000 r/min离心10 min。利用ICP-MS分别测定上清液中锌离子和溶液中总锌浓度。锌离子溶解率计算如公式(2)所示:
(2)
式中:ρ1为上清液中锌离子的质量浓度,μg/L;ρ2为等体积溶液中锌离子的质量浓度,μg/L。
1.3.8 数据处理
所有实验均重复3次,数据通过Excel软件整理,Origin 2018软件作图,SPSS 19.0软件Duncan′s Multiple-Range Test方法进行多重比较分析,P<0.05为统计学上显著差异。
2 结果与分析
2.1 胶原蛋白肽的水解度
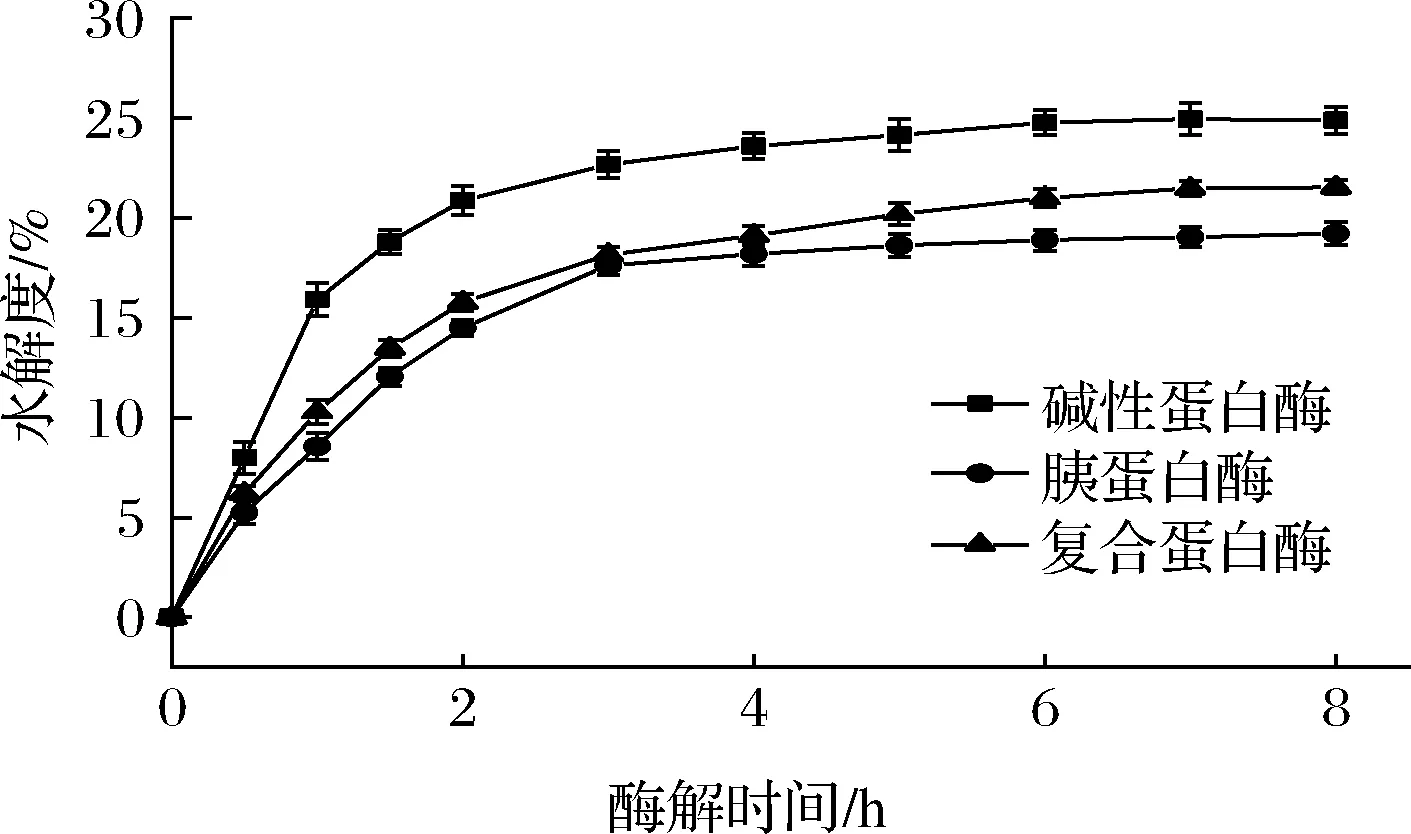
由图1可知,随着时间推移,酶解反应进行得越充分,水解程度越高。在0~4 h,水解度呈现快速上升趋势,可能与此时酶活力较高和酶切位点较多有关。4 h之后,随着底物浓度的限制和酶切位点减少,水解度变化趋于平缓。碱性蛋白酶酶解的胶原蛋白肽水解度在7 h达到最高24.95%,同样,复合蛋白酶酶解的胶原蛋白肽水解度在8 h达到最高21.54%。相比而言,胰蛋白酶酶解的胶原蛋白肽水解度较低。研究表明[8],相比于高分子质量肽,低分子质量肽往往具有更好的生物活性。碱性蛋白酶由地衣芽孢杆菌发酵制备,作为一种丝氨酸型的内切蛋白酶,对蛋白水解效果显著[15]。复合蛋白酶由米曲霉菌株发酵生成,同时具有内切蛋白酶和外切蛋白酶2种酶的活性,水解蛋白效果显著[16]。每种蛋白酶具有不同的酶切特异性,对肽键的破坏程度不同,导致水解度的差异[17]。综上所述,碱性蛋白酶对胶原蛋白的水解程度较高,一定程度表明碱性蛋白酶更有助于产生更多的生物活性肽。
2.2 胶原蛋白肽的锌离子螯合率
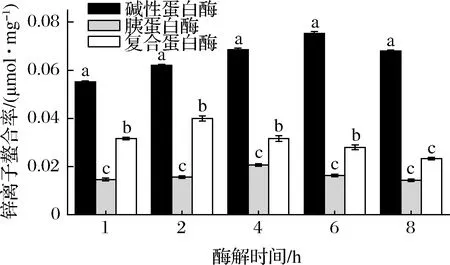
由图2可知,胶原蛋白肽的锌离子螯合活性均呈现先上升后下降的趋势,但是三者之间存在显著性差异,其中经碱性蛋白酶酶解制备的胶原蛋白肽-锌离子螯合率最佳,显著高于复合蛋白酶和胰蛋白酶(P<0.05)。经碱性蛋白酶酶解6 h制备的胶原蛋白肽螯合率最高,达到0.075 μmol/mg。碱性蛋白酶由多种不同的蛋白酶组成,能产生更多的活性位点[18];经复合蛋白酶酶解2 h获得的胶原蛋白肽螯合率最佳,达到0.040 μmol/mg;而经胰蛋白酶酶解4 h 获得的胶原蛋白肽螯合率最佳,达到0.020 μmol/mg。HOU等[19]发现太平洋鳕鱼骨肽钙离子螯合率最高达到0.040 μmol/mg。综合水解度指标和锌离子螯合率的检测结果,发现碱性蛋白酶酶解6 h获得的胶原蛋白肽具有最佳锌离子螯合活性,且酶解程度充分,故将该样品作为后续螯合物的原料。
2.3 胶原蛋白肽的分子质量分布
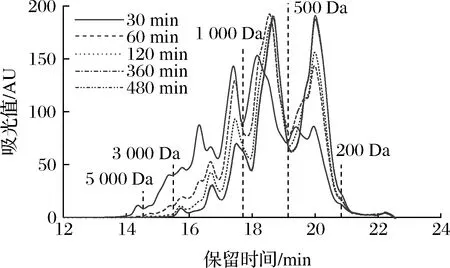
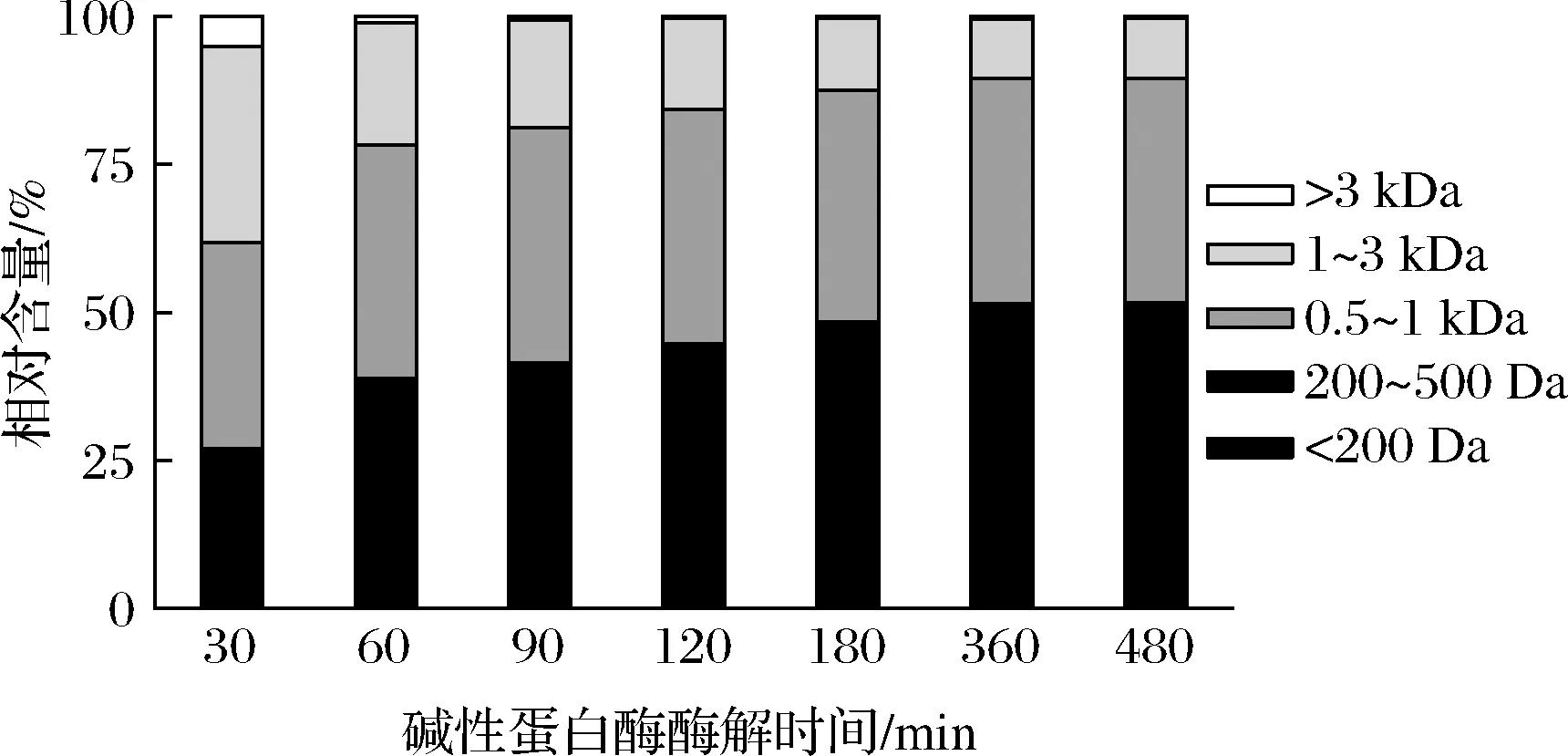
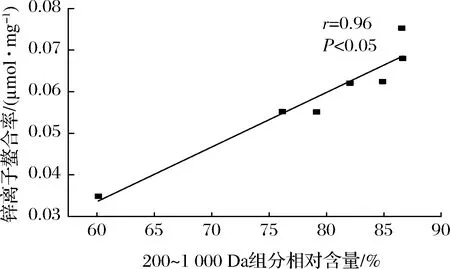
根据前人的报道,分子质量与锌离子螯合率的关系是不确定的。WANG等[8]报道称从芝麻酶解物分离出的低分子质量肽(<500 Da)锌离子螯合活性优于高分子质量肽(>500 Da)。另外,CHEN等[20]研究发现从牡蛎酶解物获得的高分子质量肽更易与锌离子发生螯合反应。因此,本研究对碱性蛋白酶不同酶解时间制备的胶原蛋白肽分子质量分布进行测定,并与锌离子螯合率进行线性拟合。由图3可知,随着酶解过程的进行,胶原蛋白肽的高分子质量组分向低分子质量的转化。酶解前期(0~120 min)分子质量分布变化明显,酶解后期(360~480 min)时,其分子质量分布情况基本保持不变。该发现与前面水解度的结果保持一致,酶解前期水解度大,会发生更多向低分子质量肽的转化。由图4可知,胶原蛋白肽200~500 Da的组分在逐步上升,从25.22%增长到48.69%,而1 000~3 000 Da的组分在明显下降,从33.10%下降到10.14%。由图5可知,线性拟合分析发现200~1 000 Da的组分与锌离子螯合率呈正相关性(r=0.96,P<0.05)。综上,这些结果表明罗非鱼皮胶原蛋白肽的分子质量对锌离子螯合活性有显著影响,且低分子质量肽更易与锌离子发生螯合反应。
2.4 肽-锌螯合物的结构表征
2.4.1 紫外扫描分析

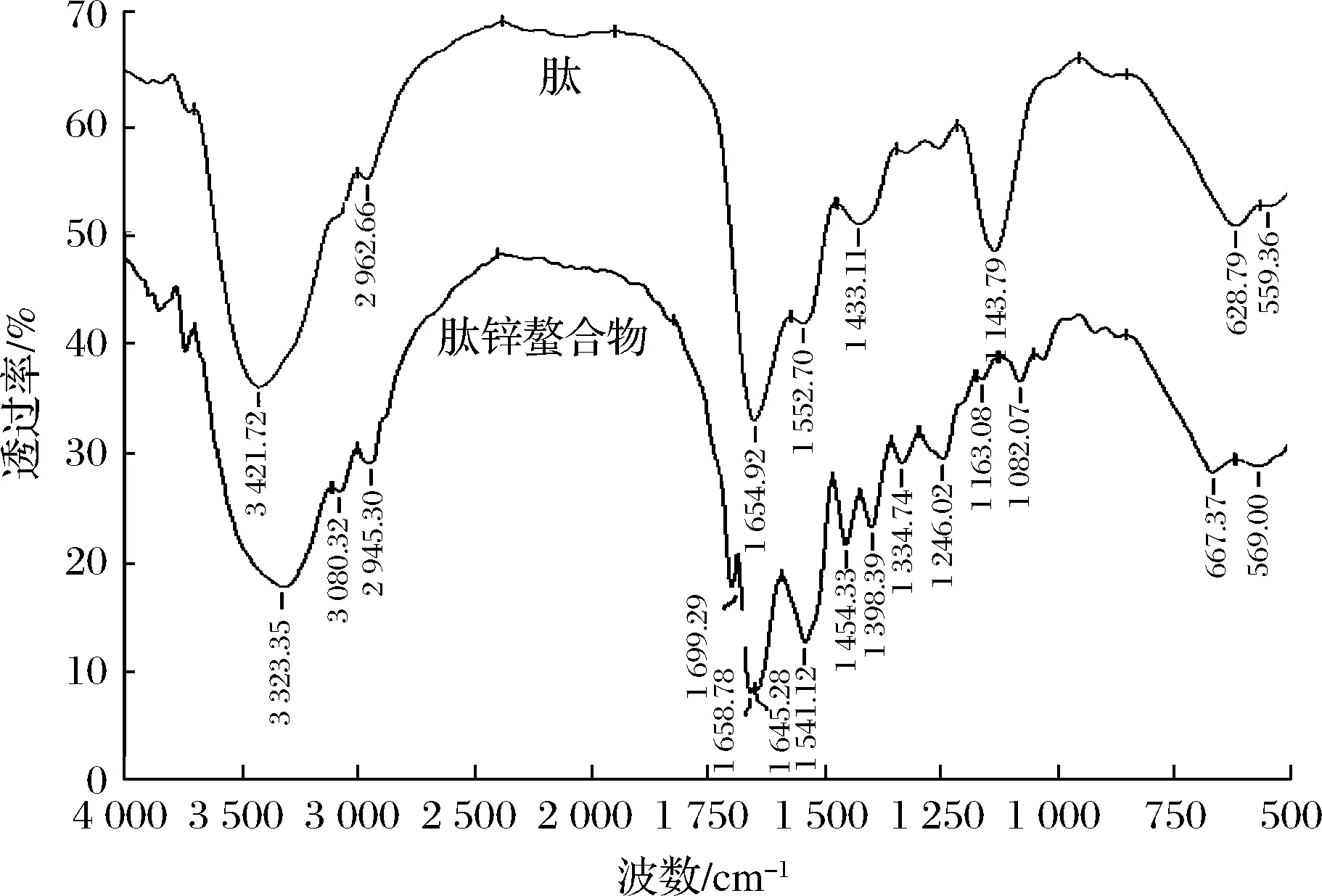
2.4.2 傅里叶变换红外光谱分析

2.4.3 电镜分析
由图8可知,胶原蛋白肽和肽-锌螯合物电镜图有明显区别,胶原蛋白肽的表面光滑,呈现片状结构。与锌离子螯合之后,胶原蛋白肽和锌形成桥连,螯合物呈现粗糙的球状颗粒聚集体形态。螯合物表面附着白色晶体,这应该是吸附在胶原蛋白肽上的锌晶体。该发现与原洪等[24],刘闪等[25]发现螯合物表面附着白色晶体的结论一致。扫描电镜结果从微观表面形态的角度同样证明螯合物的产生。

2.4.4 原子力显微镜分析
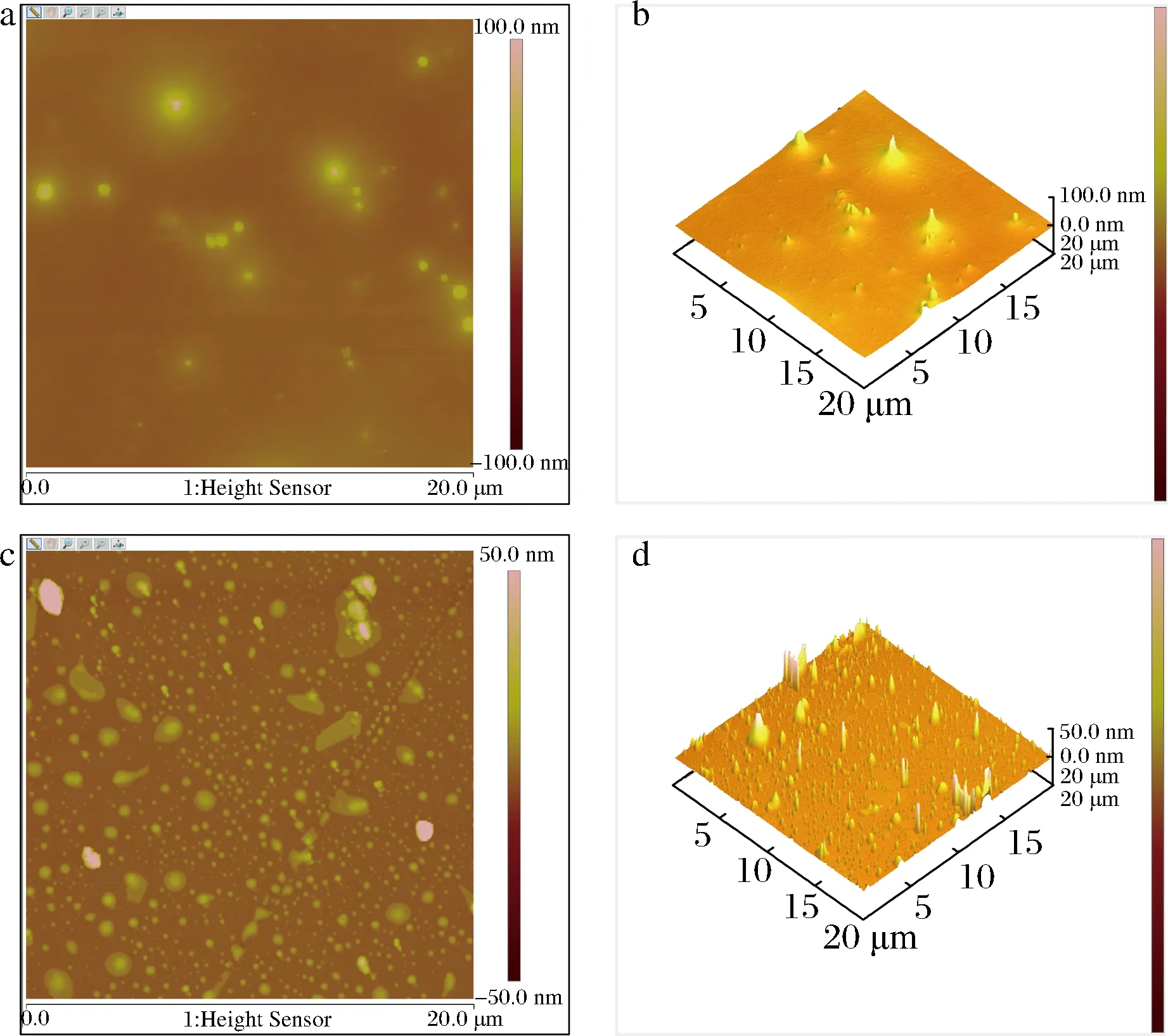
由图9可知,胶原蛋白肽与肽-锌螯合物的分子表面形态和纳米分辨率级别的粗糙度。胶原蛋白肽平均粗糙度9.67 nm,而肽-锌螯合物平均粗糙度 3.12 nm。胶原蛋白肽的表面图像显示相对均匀的纳米级颗粒(图9-a),其中单个分散体3D图像(图9-b)更加直观的显示该特性。与锌离子螯合之后,螯合物显示不同形状的簇,其3D图像也可以明显看出,可能由多肽与锌离子螯合导致。螯合物呈现不同聚集体的发现与电镜结果一致。该结果与CUI等[26]发现海参卵肽结合钙离子之后表面形态发生变化的结果类似。这与上述实验得到的结果达成一致。
2.5 肽-锌螯合物生物利用率分析
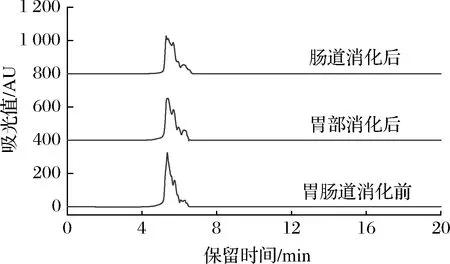
由图10可知,肽-锌螯合物经过胃肠道消化后,液相色谱图出峰时间均在4~8 min,没有发生明显变化。该结果表明,肽-锌螯合物保持了一定的稳定性。观察胃部消化,肠道消化后,肽-锌螯合物吸收峰形变化,胃部消化后峰形相对稳定,最大吸收峰吸光值略微降低,而肠道消化后,峰形变化更加明显,且最大吸收峰吸光值下降更多。根据该结果,推测肽-锌螯合物在胃部消化后能够保持良好的稳定性,而在肠道消化后会发生部分分解。该结果表明螯合物的螯合结构几乎不受胃蛋白酶的影响,而胰蛋白酶对结构具有部分破坏作用。类似的结果发生在芝麻肽-锌螯合物能够抵抗胃部分解,但在肠道会发生部分分解[27]。
由图11可知,肽-锌螯合物经过胃部消化和肠道消化后的溶解率分别为96.10%,68.03%,而ZnSO4经过胃肠道消化为88.31%,39.93%,结果表明在整个胃肠道消化阶段螯合物的锌离子溶解率均显著高于无机锌(P<0.05)。螯合物在胃部表现出良好的锌离子溶解率,主要原因是螯合结构没有发生破坏(图10),锌离子与多肽作为一个整体存在。螯合物在肠道的溶解率明显下降,可能是螯合结构在肠道阶段发生部分分解(图10),被分解锌离子在肠道的碱性环境下易形成沉淀[28]。综上,相比于无机盐,螯合物在胃肠道消化阶段能够一定程度保持其完整的螯合结构,避免了无机锌在胃肠道易于形成沉淀的问题,有效地提高了锌离子的生物利用率。

3 结论
本文对胶原蛋白肽的分子质量分布与锌离子螯合活性的关系进行探究,并对螯合前后的结构进行表征,随后通过模拟胃肠道模型探究螯合物的生物利用率。结果表明,低分子质量的胶原蛋白肽更易与锌离子发生螯合作用;锌离子螯合后,胶原蛋白肽的表面形态发生变化,其螯合位点为酰胺键,氨基的氮原子和羧基的氧原子;相比于无机盐,螯合物在胃肠道消化阶段能够一定程度保持其完整的螯合结构,避免了无机锌在胃肠道易于形成沉淀的问题,有效地提高了锌离子的生物利用率。