不同结构的乌鳢螯合肽对抗氧化活性的影响
2019-11-12汪婧瑜张业辉张友胜刘学铭程镜蓉陈智毅王旭苹黄利华
汪婧瑜 张业辉* 张友胜 刘学铭 程镜蓉 陈智毅 王旭苹 黄利华
(1 广东省农业科学院蚕业与农产品加工研究所 农业农村部功能食品重点实验室广东省农产品加工重点实验室 广州 510610
2 广州城市职业学院食品系 广州 510405)
乌鳢(Channa argus)是我国主要的淡水经济鱼类[1],广泛分布于我国各水域,其蛋白质含量高于鸡肉、牛肉,具有很高的食用价值和经济价值[2]。乌鳢肉质鲜美,口感细嫩,主要以鲜食为主。在乌鳢饲养过程中,部分乌鳢难以长大,影响乌鳢的售价,还造成饲料的浪费。将这部分营养丰富的乌鳢高值化加工利用,显得尤为重要。
微量元素需求量虽小但与人体健康息息相关[3]。随着社会的进步,人们越来越注重对营养和健康的追求。然而,食品的精深加工及日常膳食中草酸和植酸等的摄入都会影响微量元素的吸收,导致微量元素缺乏。相较于其它类型的微量元素补充剂,短肽螯合肽能借助短肽的吸收机制及螯合肽稳定的结构提高无机态微量元素的吸收率,增强其生物利用率。有研究表明[4-6],微量元素与具有特殊生物活性的短肽螯合后,仍具有抗氧化,抗菌,免疫调节,降血脂,降血糖等生物活性。本研究以营养丰富的乌鳢为原料,在之前研究的基础上,探究不同结构乌鳢短肽螯合肽对抗氧化活性的影响,以期为乌鳢高值化加工利用提供理论依据。
1 材料与方法
1.1 材料与仪器
钙、铁、锌乌鳢螯合肽,实验室自制;胰蛋白酶(牛胰,250 U/mg),DPPH,铁氰化钾,三氯乙酸,邻苯三酚,VC,氯化高铁,三氟乙酸等试剂,均为分析纯级;混合标准品:细胞色素C(12 500 u)、杆菌肽(1 450 u)、Gly-Gly-Tyr-Arg(451 u)、Gly-Gly-Gly(189 u)均为NT级,中国计量科学研究院。
高速冷冻离心机,美国Thermo Fisher公司;FTIR红外光谱仪,美国Nicolet公司;Leo-1530vp场发射电子扫描显微镜,德国LEO公司;Zeta电位分析仪,英国马尔文公司;JME-2100高分辨透射电子显微镜,日本电子株式会社。
1.2 试验方法
1.2.1 不同螯合肽制备 取一定量乌鳢蛋白[7],按35 000 U/g的比例加入胰蛋白酶酶解3 h。在90℃条件下钝酶10 min。称取一定量乌鳢短肽溶于去离子水中,质量分数为2%。再按一定质量比加入金属离子(短肽∶无水氯化钙为5∶1,短肽∶氯化亚铁为3∶1,短肽∶硫酸锌为2∶1),搅拌均匀,调pH(6.0,6.0,7.0),于不同温度(40,25,70 ℃)和时间(30,30,60 min)下反应,加入 4 倍体积无水乙醇醇沉1 h,10 000 r/min下离心10 min,取沉淀,60℃条件下鼓风干燥得到乌鳢短肽螯合肽成品。
1.2.2 乌鳢鱼肉蛋白肽分子质量分布测定 样品的处理:用流动相配制标准品;先用质量分数15%的TCA与短肽溶液等体积混合除去杂蛋白,再用双倍的流动相与上述溶液混合,0.22 μm滤头过滤制备1 mL样品。
色谱条件:色谱柱为TSK gel G2000SWXL(300 mm×7.8 mm),流动相:乙腈、水、三氟乙酸之比为10∶90∶0.1(体积比),流速:0.5 mL/min,检测波长:UV 220 nm,柱温:30 ℃,进样体积:20 μL。
1.2.3 螯合率的测定方法 钙、锌离子螯合率的测定:采用EDTA滴定法[8]测定;铁离子螯合率的测定:采用邻菲罗啉法[9]测定。
1.2.4 螯合肽粒径分布 将短肽与螯合肽配制成质量浓度为0.5 mg/mL的溶液,分散3 h后,采用WJL-628激光粒度仪测定其粒径分布。
1.2.5 螯合肽Zeta电位分析 将短肽和螯合肽配制成质量浓度为0.2 mg/mL,总体积15 mL,在Zeta电位分析仪上进行自动电位滴定。
1.2.6 螯合肽氨基酸分析 称取相同量的短肽和3种螯合肽,采用GB/T5009.124-2003法测定。
1.2.7 螯合肽结构光谱分析 紫外光谱扫描测定:取一定量短肽和螯合肽用蒸馏水溶解,测定其在190~400 nm波长范围内的紫外吸收光谱,以蒸馏水为空白对照。
红外光谱扫描测定:将经溴化钾压片法处理的短肽及螯合肽,在400~4 000 cm-1下测定其红外吸收光谱。
1.2.8 螯合肽微观结构分析 扫描电镜分析:将短肽与螯合肽粉末样品均匀地涂在样盘双面胶上,喷金镀膜处理后,利用Leo-1530vp场发射型电子扫描显微镜观察。
透射电镜分析:将短肽和螯合肽配制成质量浓度为1 mg/mL的溶液,吸取1 μL样品滴加到载有碳膜的铜网上,常温下自然晾干。采用JME-2100高分辨透射电子显微镜观察。
1.2.9 螯合肽抗氧化活性的测定 DPPH清除率测定:参照Chen等[10]的方法。
H2O2清除率测定:参照Oktay等[11]的方法。
超氧阴离子清除率测定:参照胡振珠等[12]的方法。
还原力测定:参照Pan等[13]的方法。
1.3 统计方法
使用SPSS 17.0数据分析,采用ANOVA中的Duncan对各组数据进行差异分析,P<0.05为显著差异。数据用平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 乌鳢鱼肉蛋白肽分子质量分布
从图1可以看出,混合标准品中,细胞色素C的保留时间为16.079 min,杆菌肽的保留时间为20.117 min,Gly-Gly-Tyr-Arg的保留时间为21.594 min,Gly-Gly-Gly的保留时间为22.919 min。乌鳢鱼肉蛋白肽主要由3部分组成,其保留时间分别为20.388,22.803,23.444 min,通过与标准品比较分析,组分1的分子质量为628 u,组分2的分子质量为171 u,组分3的分子质量为124 u,基本以小分子短肽为主。

图1 混合标准品及乌鳢蛋白肽的分子质量分布图Fig.1 The molecular weight distribution of mixed standard and protein peptide
2.2 螯合对乌鳢短肽螯合率、粒径分布和Zeta电位的影响
不同螯合肽的螯合率见表1。螯合钙、螯合铁和螯合锌3种螯合肽的螯合率差异显著(P<0.05),其中螯合铁的螯合率最高。3种螯合肽的平均粒径存在显著差异(P<0.05),螯合肽平均粒径与短肽相比都发生变化,其中螯合钙与螯合铁平均粒径相近,螯合锌与短肽平均粒径相近。螯合钙、螯合铁和螯合锌3种螯合肽的Zeta电位存在显著差异(P<0.05),螯合铁和螯合钙的电位绝对值较螯合锌和短肽高。

表1 不同螯合肽的螯合率、粒径及Zeta电位Table1 The chelating rate,particle size and zeta potential of different chelating complex
2.3 螯合对乌鳢短肽氨基酸组成的影响
短肽与螯合肽的氨基酸含量发生变化(表2)。短肽中Glu含量最高为3.35 mg/g,Asp含量次之为2.95 mg/g。而在螯合钙和螯合铁中Asp含量最高且显著增加,其中螯合钙为7.39 mg/g,螯合铁为5.28 mg/g,Glu含量也增加;在螯合锌中Glu含量最高为5.23 mg/g,Asp含量次之为5.23 mg/g,说明呈酸性的氨基酸含量增加。与短肽相比,螯合肽中 Met,Try,Lys,His含量增加,分别占总氨基酸的17.66%,21.00%,19.15%,这与螯合率的趋势一致。另外,螯合肽中Thr,Glu,Ala等亲水性氨基酸含量也增加。
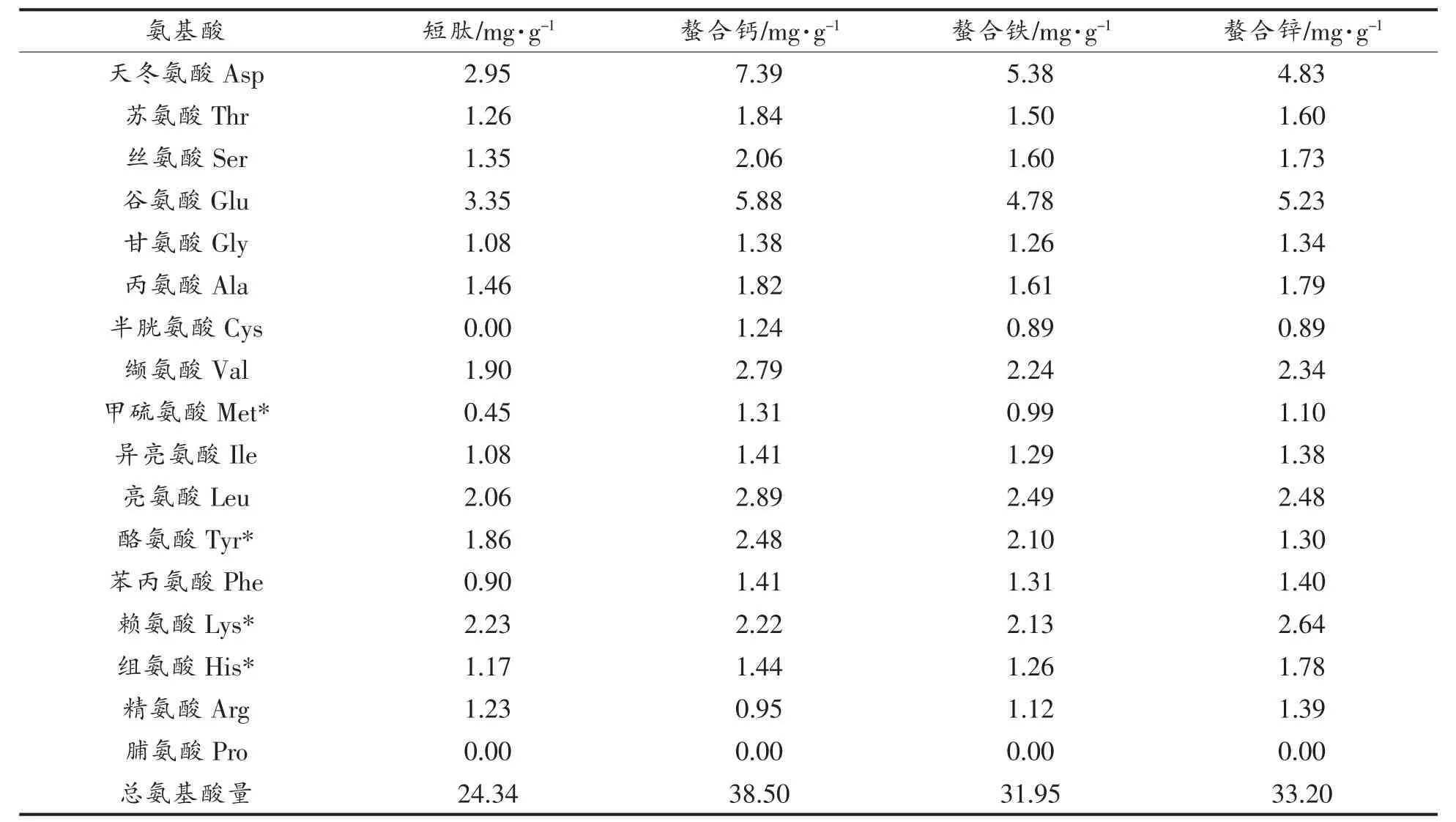
表2 短肽和螯合肽的氨基酸组成Table2 Proportion of amino acids in oligopeptide and chelating complex
2.4 螯合对乌鳢短肽结构的影响
短肽和螯合肽的紫外扫描光谱图(图2)中可以发现,短肽与螯合肽的最大吸收峰的吸收强度和位置不同。短肽的最大吸收峰为273.8 nm,螯合钙、螯合铁、螯合锌的最大吸收峰分别为259.0,332.2,271.8 nm。另外,螯合肽的吸收强度较短肽增强。
短肽与螯合肽的红外光谱图(图3)中发现,短肽与螯合肽的特征吸收峰强度和位置发生变化。短肽红外光谱图中,特征区,由于N-H的伸缩振动,-NH2在3 298.16 cm-1处具有吸收峰;指纹区,C=O的伸缩振动使得C=O在1 653.90 cm-1处具有吸收峰,-COO-的吸收峰在1 549.75 cm-1处;在1 072.38 cm-1处出现由NH3+变角振动引起的吸收峰;在651.92 cm-1处是由N-H的面外变形振动产生的吸收峰。螯合钙、螯合铁、螯合锌的特征吸收峰发生改变,其中特征区氨基的吸收峰为3 274.07,3 318.42,3 285.63 cm-1;指纹区 C=O的吸收峰为1 646.19,1 655.83,1 652.91 cm-1,-COO-的吸收峰为1 550.72,1 534.32,1 537.21 cm-1;NH3+变角振动引起的吸收峰为1 074.39,1 068.53,1 062.74 cm-1处;N-H的面外变形振动产生的吸收峰为576.70,603.70,602.73 cm-1。
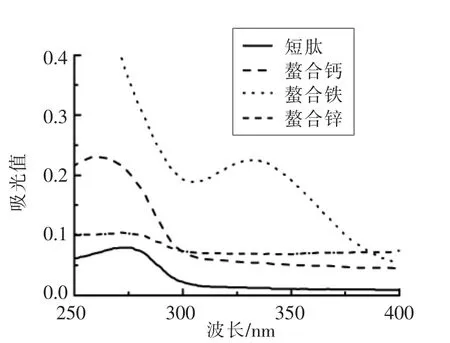
图2 紫外扫描光谱图Fig.2 UV-VIS spectra
2.5 螯合对乌鳢短肽微观结构的影响
扫描电镜(图4)分析发现短肽表面光滑,有均匀分布的裂痕;螯合肽中表面粗糙,有空隙和空洞存在,像有“晶体”镶嵌在表层。其中,螯合铁表面的“晶体”较多,螯合锌次之,螯合钙最少,这与螯合率的趋势一致。透射电镜(图5)分析发现短肽与螯合肽有不同形态,短肽呈圆球状,排布均匀;螯合钙呈絮状,团成一团;螯合铁呈不规则圆球形,像铁离子被包裹在里面;螯合锌呈椭圆形,周围带絮状。

图3 傅里叶红外光谱图Fig.3 FT-IR spectrum

图4 短肽与螯合肽扫描电镜图Fig.4 SEM of short peptide and chelating complex

图5 短肽与螯合肽透射电镜图Fig.5 TEM of short peptide and chelating complex
2.6 螯合对乌鳢短肽抗氧化性的影响
由图6发现,随着样品浓度升高,样品对DPPH自由基的清除率逐渐增加。与短肽相比,螯合肽对DPPH自由基有较强的清除能力,且效果都比VC强。另外,螯合铁对DPPH自由基的清除率变化范围最广。由图7发现,随着样品浓度升高,样品对H2O2清除率逐渐增加。短肽与螯合肽对H2O2自由基有一定的清除力。与VC相比,VC清除H2O2的能力优于短肽和螯合肽。另外,VC对H2O2的清除率变化范围最广。由图8发现,不同样品的超氧阴离子自由基抑制能力与其浓度呈正相关,都随浓度的增加呈上升趋势。短肽与螯合肽均对超氧阴离子自由基有一定的抑制作用,与短肽相比,螯合肽的抑制作用较强。不同溶度下,螯合铁的超氧阴离子自由基抑制能力最强。由图9发现,不同样品的还原力与浓度呈正相关,随着浓度的增加而上升。短肽和螯合肽都具有还原力,效果都低于VC。

图6 样品的DPPH清除率Fig.6 DPPH clearance of the sample

图8 样品的超氧阴离子自由基抑制能力Fig.8 SAFR free radical inhibition activities of samples
3 讨论
乌鳢短肽与钙、铁、锌分别螯合后,相同条件下其螯合率、粒径及Zeta电位都存在显著差异(P<0.05),其中螯合铁的螯合率最高(84.46%±0.75%),螯合锌次之(64.85%±1.44%),螯合钙最低(59.59%±0.14%),可能与不同离子与乌鳢短肽的氨基和羧基等化学键交联程度不同有关。螯合铁和螯合钙的粒径相近,其电位绝对值也接近。有研究表明,Zeta电位与微粒的稳定性有关,其绝对值越高,溶剂体系内微粒稳定性越好[14]。螯合铁电位绝对值最高,螯合铁的稳定性好,这可能与螯合肽的结构有关。
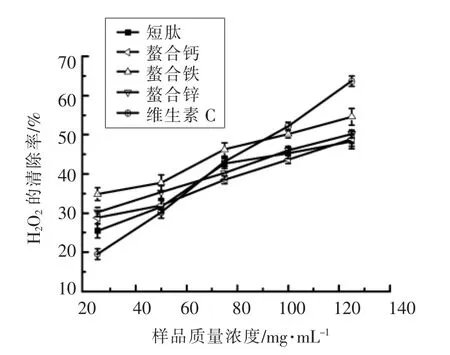
图7 样品的H2O2的清除率Fig.7 H2O2clearance of the sample
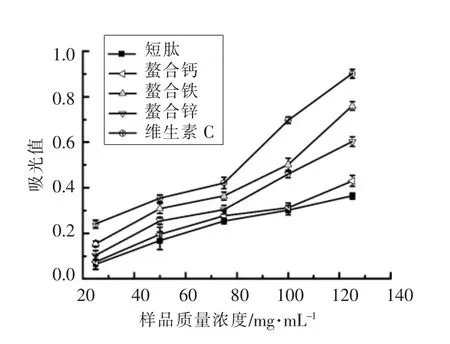
图9 样品还原力的测定Fig.9 Determination of reduction power of samples
短肽中氨基酸侧链基团和极性的差异会对金属离子有不同的亲和能力,亲和能力强的氨基酸更易与金属离子结合[15]。螯合肽中Asp和Glu含量增加,这与高菲等[16]的研究结果相似,说明亲水性氨基酸Asp和Glu对微量元素的螯合能力较强。螯合肽中Thr,Gly,Ala等亲水性氨基酸含量增加,说明螯合肽具有较好的水溶性,这与霍思聪等[17]的结果相似。有研究表明,Met、Try、Lys、His具有抗氧化活性[18],螯合肽中这些氨基酸含量增加,分别占总氨基酸的17.66%,21.00%,19.15%,说明螯合铁的抗氧化活性可能比螯合钙、螯合锌高。
螯合肽和短肽的紫外最大吸收峰不同,螯合钙和螯合锌发生紫移,这与付文雯[19]和王旭等[20]的结果相似;螯合铁发生红移,这与陆剑锋等[21]的结果相似。红外光谱图中发现,螯合肽中-NH2和C=O的特征吸收峰发生变化,螯合钙与螯合锌在特征区-NH2吸收峰和指纹区C=O吸收峰发生红移,螯合铁发生紫移;螯合铁和螯合锌在指纹区的-COO-吸收峰与NH3+吸收峰发生红移,螯合钙发生紫移;螯合肽由N-H的面外变形振动产生的吸收峰都发生红移。说明不同金属离子与短肽中氨基和羧基结合能力不同,其中螯合铁的变化最大,可能与螯合铁的螯合率较高有关。
螯合肽和短肽表面结构明显不同,通过扫面电镜观察发现金属离子与短肽之间还存在吸附作用,像有“晶体”镶嵌在表层[22],螯合铁与乌鳢短肽相比,差异显著,这与螯合铁的螯合率较高有关。透射电镜结果显示螯合肽和短肽结构不同,螯合肽与离子的螯合率不同,其结构也有区别,其中螯合铁的结构更稳定。
螯合肽和短肽都具有抗氧化活性,且与短肽相比,螯合肽的抗氧化活性较强,并且螯合肽的抗氧化活性与离子-短肽的螯合率成正相关关系,即螯合率高的螯合肽其抗氧化活性也高。这可能是因为离子与短肽结合后形成新的物质,改变了具有抗氧活性氨基酸的含量,从而使得螯合肽的抗氧化活性更强。另外,不同的金属离子本身可能也有抑制自由基形成和清除活性[23]。通过对螯合肽和短肽结构的分析,可以推测螯合肽的结构式,即离子被短肽的NH2和COOH包裹在中央,形成一个环状结构[24]。抗氧化活性的研究揭示了离子与具有特殊生理功能的短肽螯合后,也具有相同的生理功能。
通过研究不同结构乌鳢短肽螯合肽对其抗氧化活性的影响,发现螯合肽因其稳定结构提高了无机态微量元素的吸收率,还能补充具有特殊的生物活性的氨基酸。因此,乌鳢短肽螯合肽作为新型的功能制剂,具有重要的经济和现实意义,对食品、医药以及化妆品行业具有一定的应用价值。
