商品海参溯源分析技术研究进展
2021-07-29蒋冰雪张晓梅何晓霞张九凯张鸿伟李兆杰薛长湖冯婷玉姜晓明
蒋冰雪,张晓梅,何晓霞,张九凯,张鸿伟,*,李兆杰,薛长湖,,冯婷玉,姜晓明,,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛海关技术中心,山东 青岛 266002;3.即墨海关,山东 青岛 266200;4.中国检验检疫科学研究院,北京 100176;5.青岛海洋食品营养与健康创新研究院,山东 青岛 266000)
由于食品安全问题、产品欺诈性贴标行为层出以及消费者获知产地和生产方法的意愿逐渐增强[1],食品产品的溯源正成为全球消费者、海参行业从事者和监管机构的主要关注点。自1950年以来,水产养殖产量一直在稳步增长,其中海参作为重要的海产品,全球产量近22万 t,总产值超过70亿 美元[2]。海参含有多种生物活性化合物,具有抗氧化[3]、抗癌[4]、抗炎[5]、抗血栓[6]、抗糖尿病[7]、抗肥胖[8]等作用,并可以提高学习能力和记忆力[9],因而深受消费者喜爱。在贸易产品中,海参通常会经过干制、切片、粉碎等处理,使得消费者、经销商和监管部门难以从外观形态上对其种类、产地和生产方式进行溯源。参种、产地、生产方式(如野生和养殖)不同会导致市面上不同的海参产品价格相差数十倍。为了牟取暴利,不诚信的商家会故意给海参产品贴上错误的标签,如以低值海参冒充高值海参、伪造产地、养殖海参伪装野生海参等[10]。这些欺诈行为除了影响海参行业的公信度之外,还易引发消费者对海参产品安全、卫生和真实性的担忧,也对整体行业及消费者利益造成不可挽回的损害[11]。因此,明确商品海参参种、产地和生产方式信息是保证消费者对海参产品信任的必要条件。
当前,产品溯源体系建设分为监管、控制和检测分析三大部分。溯源监管主要体现在法律法规、政策层面。《中华人民共和国产品质量法》(2018修正)第五条规定禁止伪造或者冒用认证标志等质量标志;禁止伪造产品的产地,伪造或者冒用他人的厂名、厂址;禁止在生产、销售的产品中掺杂、掺假,以假充真,以次充好,并对相应违法行为列有明确的惩罚措施。溯源控制主要体现在流程追溯层面,即采用适当的技术和方法以追踪从原料供应、生产加工到流通消费的全过程,保证这些过程中的环节需要符合相关质量管理体系标准,包括ISO9000认证、危险分析和关键点控制(hazard analysis critical control point,HACCP)、卫生标准操作程序(sanitation standard operation procedures,SSOP)、良好操作规范(good manufacturing practice,GMP)等。在溯源控制过程中,尽管射频识别(radio frequency identification,RFID)[12]和新近的区块链[13-14]技术对流程信息记录和留存提供了高可控性的技术保障,但对于产品的内在本质特征则无法提供相关的数据信息。溯源分析作为监管和控制的技术支撑,为监管和控制提供技术验证,是溯源体系链条中不可或缺的重要部分,溯源分析不仅可以通过技术证据改进和完善监管与控制环节,而且还可以作为监管和控制环节的有效补充和验证,甚至在某些情况下起到推动另外两个环节发展的作用,更为重要的是,溯源分析技术可以在不同水平呈现产品的内在本质特征,可有效补充溯源控制环节的信息沟壑,在相应数据库的构建、积累和完善中与溯源控制技术联合实现全流程、多维度、高容量的产品溯源信息采集体系的建立。
近年来,随着现代生物技术不断发展,目前DNA分析、元素分析、稳定同位素分析和组学分析等技术方法在商品的溯源分析中已经得到了实际应用。本文针对商品海参的掺假现状,综述了相关技术在商品海参溯源分析中的应用情况及最新进展,以期为这一领域的研究提供参考。
1 商品化食用海参的分类分布及生产方式
目前,全球已知的海参种类达到1 200多种,其中大约40 种为食用海参[15]。热带海域海参产量约占总产量的86%,温带海域海参主要分布在太平洋沿岸,主要以加州拟刺参(Parastichopus californicus)和仿刺参(Apostichopus japanicus)为主[16]。我国海参种类超过140 种,具有食用价值的约20 种,具有较高的商品价值的有10多种,其中刺参的营养价值和经济价值被视为最高[17]。目前,主要食用商品海参的生物学分类及地理分布见表1。

表1 主要食用商品海参生物学分类及地理分布[18-20]Table 1 Main commercial edible sea cucumber species and their geographical distribution[18-20]
在海参的生产方式上,早期的商品海参主要源自海捕的方式,但由于野生资源的有限性和消费者对商品选择的趋向性,人工养殖已成为食用海参供应的主要生产方式,自20世纪90年代以来,在我国山东牟平和辽宁大连开始逐渐规模化养殖刺参,刺参养殖已经突破传统海域的限制,实现了“北参南养”和“东参西养”。北方主要养殖模式有池塘养殖、围堰养殖、底播增殖、海底网箱养殖和大棚工厂化养殖等,南方则以浮筏吊笼养殖技术为主。此外,为了实现生态和经济效益的最大化,出现了参鱼、参虾、参贝藻混养等多种养殖模式[21]。
2 商品海参溯源分析技术及研究进展
2.1 DNA分析
由于DNA分析表现出诸多优势,近10 年来其发展迅速,被广泛应用于食品产品溯源分析[22]。利用DNA图谱鉴定食物中的动物物种是理想的技术手段,因为DNA的稳定性强,不受季节、环境和生物体状态影响且相对耐高温。随着现代化仪器和商品化试剂盒的使用,大大缩短了DNA分析的检测时间,使得分子标记方法更加简便快捷,同时,自动化检测能够提高操作的精准度和重复性,防止交叉污染,使检测过程更安全可靠。常见的DNA分析有基于核酸杂交和聚合酶链式反应(polymerase chain reaction,PCR)两种标记技术,其中PCR被认为更快、更准确。DNA分析相关技术的原理和优缺点比较见表2。尽管DNA分析作为物种溯源分析技术应用相当普遍,但如果没有一个集中的公共数据库,很难使用DNA分析作为检测食品替代和判定标签合规性的公认标准方法[23]。
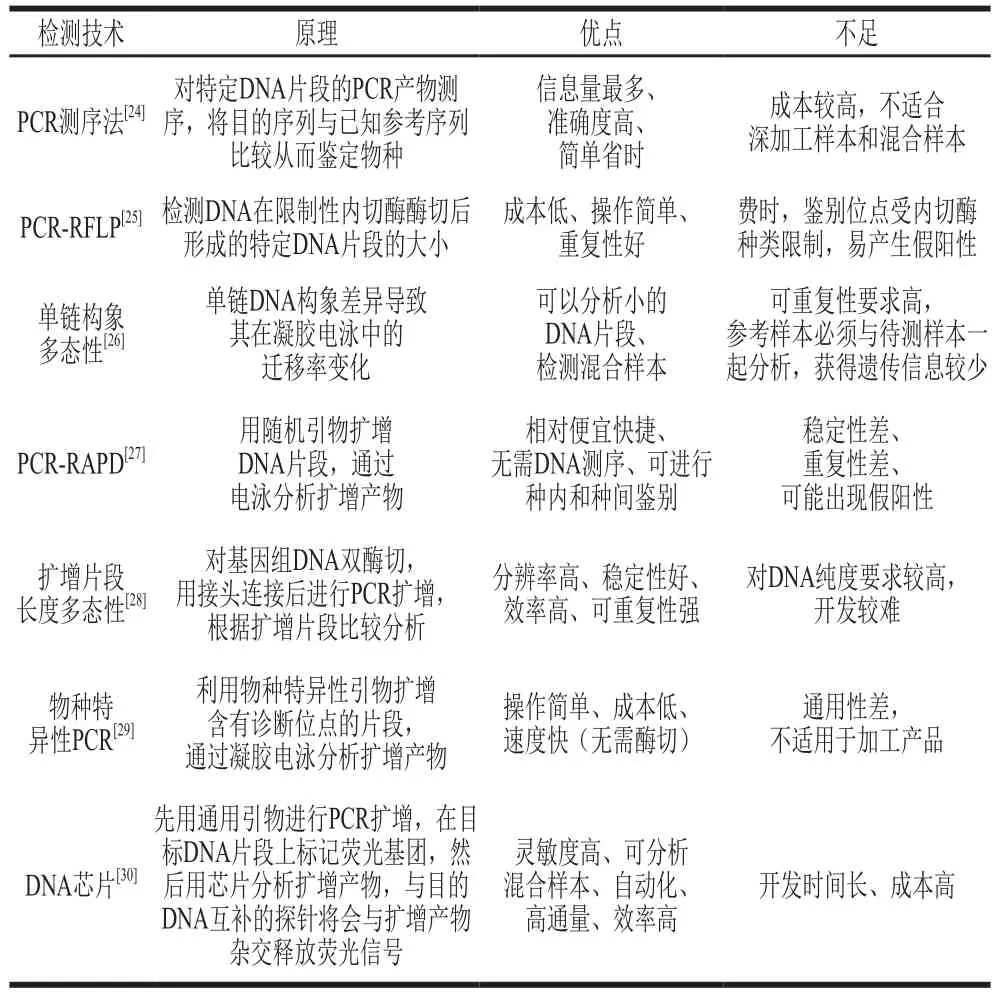
表2 DNA检测技术比较Table 2 Comparison of DNA analysis techniques
用于物种溯源的PCR测序法通常称为法医信息核酸测序,常用的目标片段包括Cytb、COI、16S rRNA等基因[31]。Wen Jing等[32]通过基于COI基因和16S rRNA基因的DNA条形码技术对市售商品海参科样品进行鉴定,发现有7 个样品存在标签错误现象(63.6%)。Wen Jing等[33]建立了一种物种特异性PCR方法来鉴定11 种海参,设计位于16S rRNA基因区大小为269~406 bp的11 个种特异性引物,其中使用引物16Sar和16Sbr,即使从每个参种的冷冻和干燥产品中也可以很容易地扩增出线粒体16S rRNA基因的570 bp片段,最终检测出两种冷冻海参存在参种欺诈情况。之后又使用该技术设计了10 个种特异性PCR引物用以鉴定10 种干制商品海参参种[34]。Lü Yingchun等[35]在692 bp的COI片段中找到限制性酶BamH I、KpnI、PstI、XbaI和Eco31 I的酶切位点,采用PCR-限制性片段长度多态性(PCR-restriction fragment length polymorphism,PCR-RFLP)技术成功鉴别出仿刺参、梅花参、加州拟刺参、大西洋瓜参和子安福冈参5 种商品海参,并在10 种海参混合物中同时检测到两种海参。Zeng Ling等[36]用限制性内切酶DdeI、HaeIII和StyI对16S rRNA线粒体基因的570 bp区域进行酶切,通过所开发的PCR-RFLP方法成功鉴定了冷冻和干燥共19 种的海参产品,其中48%的产品标签有误。线粒体DNA的高丰度使得其与核DNA相比可以进行更有效的PCR扩增,深加工产品中线粒体DNA会比核DNA存活时间长,使扩增变得容易。然而,每个细胞的拷贝数在相同物种中,甚至同一个样本体内的组织之间都会发生变化,这使得线粒体基因不适合量化[37]。因此,在需要定量分析确保溯源分析正确性的情况下,核基因更为适合[38]。
除了区分不同的参种,DNA分析还被应用于海参的产地溯源。Yun Zhenyu等[39]采用PCR-RAPD技术和基因片段测序技术对来自辽宁大连、山东烟台和山东威海3 个产地的仿刺参进行遗传关系和DNA多态性分析,结果表明,不同海域海参的基因差异特征明显,由于威海和烟台的地理位置相近,两地的样本亲缘关系比大连更为密切。利用PCR-RAPD技术进行遗传多样性分析可作为一种快速产地溯源的方法,但同一物种之间遗传变异的确切原因尚未得到详尽的研究,一些研究认为这种变异是适应当地条件造成的,而另一些研究则认为是遗传漂变造成的[40]。
尽管诸如生命条形码数据系统和美国国立生物技术信息中心等数据库不断改进完善以解决一些普遍性问题,可是标准化方法缺失的问题仍然存在[41]。不过,DNA分析仍然是海参参种溯源时最值得推荐的分析方法之一。然而,由于基于DNA的分析技术无法区分来自同一地点海参的养殖样本和野生捕获样本,因此使用DNA分析很难进行海参的生产方式溯源。最近,新兴的基于基因组学的技术被应用于食品溯源分析研究,研究人员试图从特异性、灵敏性和重复性等方面改善传统DNA技术的性能。这些方法包括下一代测序(next-generation sequencing,NGS)[42]、高分辨熔解(high-resolution melt,HRM)[43]、液滴数字PCR(droplet digital PCR,ddPCR)[44]和环介导等温扩增[45]。NGS技术彻底改变了分析DNA的方式,极大地提高了通量,对于未知食品或者深加工食品的溯源有着重要意义[46],已经应用于肉类食品物种溯源[47]。DNA条形码本质上依赖于测序,为了克服这一缺点,另一项研究将实时PCR与HRM分析结合起来,对对虾的物种进行了成功的溯源[48]。具有物种特异性寡核苷酸探针的DNA微阵列可快速进行多物种溯源,这也将是海参DNA溯源分析技术的发展方向之一[49]。目前的研究还倾向于开发便于携带和现场检测的DNA分析技术,结合纳米技术和DNA条形码技术研发的纳米示踪剂简化了DNA分析步骤,不依赖专业实验室的测序就可以实现物种溯源[50],对未来海参溯源分析技术的开发具有一定的启发。
2.2 元素分析
电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)是一种检测微量元素浓度的高精度分析技术,具有精密度高、分析速度快、能够多元素同时检测等优点[51]。ICP-MS已用于食品溯源分析领域,并可区分海参的产地来源[52-53]。海参“沉积食性”的特点决定了其更加容易受到生长环境中水体和海底底泥的影响,对环境中各种无机元素进行富集使得海参体内微量元素呈现地域性差异。Liu Xiaofang等[54]采用ICP-MS技术对来自我国3 个海域(渤海、黄海、东海)的39 个海参样品中15 种元素(Al、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Se、Mo、Cd、Hg和Pb)进行定量分析,并结合主成分分析(principal component analysis,PCA)、聚类分析和线性判别分析建立了分类模型,使用交叉验证程序评估该模型,显示交叉验证率为100%,证实多元素分析用于海参产地溯源分析具有较高可行性。高岳等[55]收集了大连、青岛、烟台、福建4 个产地不同养殖方式(圈养、深海)的仿刺参,采用ICP-MS和原子吸收法测定刺参体壁中6 种元素(Mn、Cr、Cu、Al、P、Zn)含量,发现大连刺参Zn、Mn含量最高,烟台刺参B、Cu含量最高,福建刺参Al、Cr含量最高,并且深海刺参体壁B、Cr和Cu含量均高于圈养刺参。
为了使ICP-MS法成为区分海参产地和生产方式的标准方法,需要确定区分所依赖的元素。虽然ICP-MS技术可以测定大多数元素浓度,但一些研究还在不影响产地溯源分析的前提下尽量减少分析的元素数量,ICP-MS的样品前处理费时费力,因此测定每个样品中元素数目越多,需要的分析时长就越长。此外,还需要构建一个海参产地区域的基本概况数据库,以便对样本进行精细比较,确定食品欺诈行为。
2.3 稳定同位素分析
同位素是具有相同数量质子但不同数量中子的元素,稳定同位素分析(stable isotope analysis,SIA)通过同位素来区分样本。一般来说,用于溯源的同位素有δ13C/δ12C、δ2H/δ1H、δ15N/δ14N、δ18O/δ16O[56]。当稳定同位素在营养链向上移动时,轻重同位素比率通过分流效应被同化到动物组织中[57]。对于海参而言,同位素分馏效应受到产地、生产方式及种间差异等因素影响,由此可以对海参的产地和生产方式进行溯源分析。
周永亮[58]采集大连瓦房店市下辖的红沿河镇、谢屯镇、永宁镇、李官镇和三台象5 个乡镇的刺参并进行分析,结果显示不同地区的刺参之间δ13C、δ15N值存在明显差异,进行判别分析的准确率达到71.5%。Kang Xuming等[59]从中国秦皇岛、大连、东营、青岛和福建5 个地区收集76 只海参,研究分析这些海参中C、H、O、N的稳定同位素比和组成,使用线性判别分析(linear discriminant analysis,LDA)获得了较高的识别率(93.4%),预测能力也高达89.5%。同时,单体稳定同位素分析技术(compound-specific isotope analysis,CSIA)已成为海参产地溯源分析的新工具。刘瑀等[60]测定并分析了黄渤海区域辽宁、山东两地刺参氨基酸相对含量及其δ13C值,发现其中非必需氨基酸δ13C值差异显著性高于必需氨基酸,由此选取Tyr和Ser的δ13C值作为指标区分刺参产地,判别结果明显优于单一的氨基酸谱鉴别。之后,刘瑀等[61]通过此技术分析了大连辖区下的瓦房店、普兰店、长海县等7 个地区刺参的氨基酸δ13C值,结果表明刺参中的丙氨酸、甘氨酸、脯氨酸、丝氨酸、酪氨酸、亮氨酸、异亮氨酸、苯丙氨酸、缬氨酸、谷氨酸的δ13C值表现出显著差异,特别是非必需氨基酸不仅来源于食物,还可以通过自身合成,具有更高的多样性,能表现出更独特的信息特征。张旭峰在对刺参脂肪酸碳稳定同位素组成的地域性差异研究中发现,莱州、担子岛、牟平、瓦房店、皮口、长海岛、獐子岛、乳山、霞浦的刺参大部分脂肪酸的δ13C值表现出显著性差异[62]。Liu Yu等[63]利用脂肪酸CSIA技术对中国沿海莱州、担子岛、牟平、乳山、瓦房店、皮口、长海岛、獐子岛和霞浦9 个地区A. japonicus样品进行产地鉴别,除了长海岛和獐子岛地区外,其他地区的样品都可以得到有效区分,乳山、瓦房店和皮口样品的δ13C值较高,而担子岛、牟平和长海岛样品的值较低。Zhao Xinda等[64]通过氨基酸的CSIA技术成功地鉴别了福建、辽宁、山东3 个省8 个采样点的野生A. japonicus,结果表明,通过氨基酸的δ13C值区分此8 种样品的总准确率和交叉验证率皆为100%,特别是δ13C Ser表现出显著的区分能力。单一的稳定同位素技术在海参溯源中的难度越来越大,研究表明,多种溯源分析技术相结合对溯源准确率有显著提高。
除了产地溯源外,生产方式溯源也同样重要。周永亮[58]对不同环境下生长的刺参进行SIA,研究表明,同一采样点成参δ13C值较人工养殖幼参高约2.5‰,δ15N值低约2.5‰,说明生长环境变化会带来稳定同位素值的明显改变。Zhao Xinda等[64]收集瓦房店、长岛、烟台三地野生和养殖仿刺参,根据氨基酸δ13C值在PCA中可以很好地将野生与养殖海参区分开来,特别是Gly的δ13C值对不同生长方式区分效果显著。然而,大多数研究必须结合其他方法来分析在稳定同位素值无法区分的样品。这些重叠可能是养殖饲料的相似、野生物种越境迁徙和人为污染造成。此外,季节性变化也会导致这些重叠的发生。由于稳定同位素组成受到饲料和环境条件等因素的影响,人为控制这些因素有可能调控同位素组成。虽然考虑到成本,这类欺诈不太可能发生,但仅使用SIA很难发现此类欺诈案件。因此,将SIA与其他溯源分析技术结合有助于区分具有相同同位素特征的样品。
2.4 组学分析
2.4.1 脂质组学分析
脂肪酸可以根据饱和度的不同分为饱和脂肪酸、一价多不饱和脂肪酸和多价多不饱和脂肪酸,多价不饱和脂肪酸又可分为n-6系和n-3系[65]。脂质组学分析通常使用各种色谱或光谱学方法来确定样品的脂肪酸组成[66]。虽然制备分析样品所需时间较长,但它在产地来源和生产方式溯源方面显示出很好的应用前景。在海参产地溯源分析中,脂质组学分析通常与SIA联用[67]。
海参产地的不同会导致海参脂肪酸组成差异。Azad等[68]在马来西亚沙巴海参中并没有检测到二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),其以饱和脂肪酸为主要脂肪酸,这与地中海海参中以多不饱和脂肪酸为主要脂肪酸具有明显差异[69]。这可能由于马来西亚沙巴地处赤道附近,气候温暖和常年的光照导致氧气溶解度下降并且不利于去饱和酶基因表达,进而饱和脂肪酸成为主要脂肪酸[70]。刘瑀等[71]收集整理了不同纬度海参脂肪酸含量数据,总结归纳得出,海参EPA、DHA相对含量随着纬度的降低而降低,C16:0和C18:0相对含量随纬度降低而升高。Budge等[72]利用受饮食影响的脂肪酸分布来对28 种不同海产品进行产地溯源,发现物种内的差异不如物种间的差异大。
脂肪酸还适用于区分不同生产方式的海参。张旭峰[62]采集了莱州、担子岛、牟平、乳山、瓦房店、皮口、长海、獐子岛和霞浦的刺参,研究发现霞浦地区刺参的C18:2n-6、C18:3n-3、C20:1n-9、C22:1n-9含量明显高于其他地区,而C18:1n-9和C20:5n-3含量明显低于其他地区,主要由于霞浦地区刺参的养殖方式为筏式养殖,饲料中添加了大量海带,而底播养殖刺参食物来源主要以底栖硅藻为主;因此,底播刺参的C20:5n-3含量明显高于筏式养殖。同时,不同季节刺参的脂肪酸组成也存在明显差异,主要与刺参的主要食物来源与季节变化有关,来源为春季硅藻类、夏季绿藻类、秋季细菌、冬季褐藻类[73]。脂肪酸在生物新陈代谢中比较稳定,经过生物长期摄食累积后结构基本保持不变,食性差异会反映在海参的脂肪酸组成中[74]。
脂质组学分析也能够与SIA一起用于区分海参的产地来源。Zhang Xufeng等[67]利用脂肪酸分析和碳、氮的SIA来区分中国北部海域7 个地点采集的仿刺参(Apostichopus japonicus)。利用δ13C和δ15N值可以有效区分5 个采集点的样品,但长海岛和担子岛结果部分重叠,可能是因为这两地域海参有相似的食物来源。然而,δ13C与C14:1n-5结合可作为区分担子岛和长海岛海参的指标。通过脂肪酸成分含量差异结合SIA,利用PCA能够有效区分这7 个地点的仿刺参。不同海域生物的脂肪酸组成与盐度直接相关。在高盐度下,多不饱和脂肪酸含量增加,饱和脂肪酸含量减少,主要是为了维持细胞膜的双层结构和提高细胞的迁移率[75]。Liu Yu等[63]建立了一种新的脂肪酸CSIA方法,结合PCA和判别分析对中国沿海9 个地区仿刺参产地进行溯源,结果表明:除瓦房店和皮口,春季刺参脂肪含量明显高于秋季刺参,其中对A. japonicus产地起源鉴定贡献最大的脂肪酸为C22:6n-3、C16:1n-7、C20:5n-3、C18:0和C23:1n-9。
脂质组学分析不仅可以区分海参产地来源,而且有助于生产方式溯源[75-76]。然而,海参脂肪酸组成的季节性变化需要进一步研究,以避免得到的产地来源和生产方式之间可能存在的重叠,并且海参的脂肪酸成分可能会通过控制饮食进行调控。此外,为了确定未知样品的实际来源,需要一个包含不同海参物种脂肪酸分布的数据库。一旦这些问题得到解决,脂质组学分析就可以在海参溯源分析中发挥重要作用。
2.4.2 蛋白质组学分析
蛋白质是海参的主要组成成分,蛋白质的差异可以指示海参相关特性,利用蛋白质技术可以鉴定并筛选有关蛋白作为生物标记物,建立海参的溯源分析技术。传统的蛋白质检测分析技术有酶联免疫分析、电泳法和色谱分析法等。然而,这些检测技术都存在一定的缺点,酶联免疫法对于亲缘关系较近的物种易产生假阳性结果,单克隆抗体虽然能显著提高检测特异性,但其检测成本高、操作繁琐,目前尚无商品化的水产品溯源酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒面世[77]。蛋白质电泳法不适用于深加工样品的分析。色谱分析法也存在操作复杂、定性能力较弱、不适合分离疏水性蛋白等问题。基因组计划加快了质谱技术作为鉴定和探查蛋白质技术的趋势,基于质谱的蛋白质组学作为后基因时代的组学分析核心为食品真实性溯源分析提供了新的技术思路[78],并已在水产品[79]、肉类[80-81]、乳制品[82]等食品的溯源分析中获得了实际应用。常见的蛋白质定量技术包括同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantification,iTRAQ)、细胞培养氨基酸稳定同位素标记(stable isotope labeling with amino acid in cell culture,SILAC)、串联质谱标记(tandem mass tag,TMT)、非标记技术[83]。非标记定量技术有数据依赖性采集(data-dependent acquisition,DDA)和数据非依赖性采集(data-independent acquisition,DIA)两种方式,其中DIA的连续窗口所有理论碎片离子采集技术(sequential window acquisition of all the theoretical fragment ion,SWATH)是近年来被广泛应用的技术[84]。Piovesana等[85]分别采用二甲基标记及非标记鸟枪法蛋白质组学方法表征养殖和野生的金头鲷(Sparus aurata)的肌肉组织,结果表明二甲基标记的结果与非标记结果一致,但使用非标记方法可以获得更全面的蛋白质鉴定结果、更好地分析重现性和样品通量,且费用低廉。Zhang Hongwei等[86]基于SWATH-MS技术的蛋白质组学,检测分析了中国霞浦、胶南、威海、烟台和大连5 个不同产地来源的干制商品海参,17 种蛋白质被鉴定为可进行产地溯源的生物标记物组,在验证测试和实际样品分析中达到了100%的预测准确性。
基于质谱技术的蛋白质组学具有高稳定性、高灵敏度以及高通量的特点,有着其他分析方法没有的优势,例如可以获得足够的反映食品真实性特质的分子信息,且可以进行数据采集后的回溯分析,对加工贮藏过程中的特征标记肽段、氨基酸序列的修饰进行监控,利用热稳定蛋白对标记物进行筛选等[87]。与DNA分子相比,蛋白的一级结构或多肽序列在某些加工中具有更好的分析稳定性,但其在食品溯源分析研究中仍存在某些制约因素。首先是蛋白质提取及富集方法的标准化,用以解决丰度低的标记蛋白及复杂基质蛋白质提取困难的问题;其次,由于海参存在自溶现象以及加工造成蛋白质溶解度降低,将依赖高分辨质谱技术先期进行深度的数据挖掘。最后,生物信息学工具的丰富和组学数据库改进完善还有需要提升的空间,这两者是进行蛋白质组学有效分析的关键。但未来随着更多生物基因组测序的完成,蛋白质数据将进一步得到完善,加之数据挖掘工具的进一步改进,将为在更深更广的范围内阐述蛋白质组学数据提供强有力的支持。
2.4.3 糖组学分析
糖类成分在生物体中主要以复合糖的形式存在,包括糖蛋白、蛋白聚糖和糖脂。同时,糖组学研究也分为聚糖组和糖链组[88]。海参体壁主要有两类活性多糖,一类是海参硫酸软骨素(sea cucumber chondroitin sulfate,SC-CHS),由D-N-乙酰氨基半乳糖、D-葡萄糖醛酸和L-岩藻糖组成;另一类是海参岩藻聚糖硫酸酯(sea cucumber fucoidan,SC-FUC),由L-岩藻糖构成。海参多糖之间存在的硫酸化程度、相对分子质量、微观结构以及残基数量的差异决定了其结构分析的复杂性[89]。陈士国等[90]采用高温氢核磁共振(1H-nuclear magnetic resonance,1H-NMR)技术分析了阿拉斯加刺参、海地瓜、墨西哥刺参、冰岛刺参、日本刺参、明秃参、北极海参和八刺参8 种海参的SC-CHS,通过比较SC-CHS中硫酸酯化岩藻糖支链上的异头氢信号确定硫酸基的取代类型,结果表明SC-CHS的指纹图谱可作为海参物种的溯源工具。Wu Nian等[91]利用傅里叶变换红外光谱分析仪和高温1H-NMR技术测定印度太平洋的Pearsonothuria graeffei、挪威海岸的Holothuria vagabunda、西印度洋的Stichopus tremulu和西大西洋的Isostichopus badionotu4 种海参的SC-FUC化学性质,根据SC-FUC异头氢信号可建立不同海域海参的指纹图谱。
糖组学分析可以从生物小分子的角度更全面地发现用于食品溯源分析的分子标识物,为后续的营养功能与调控机制的研究积累基础数据。相比于蛋白质组学和脂质组学的分析,糖组学分析更具有挑战性。由单糖组成的寡糖和多糖结构十分复杂,需要专门的生物信息学软件来分析复杂的糖基化位点和聚糖成分的质谱图,并且糖类较高的极性也对样品分离提出了较高的要求[92]。但随着超高分辨质谱在糖组学分析领域的应用及数据库与分析软件的不断完善,糖组学的研究也将更广泛地应用于食品溯源分析领域。
2.5 常见海参溯源分析技术的比较
表3对6 种分析技术在海参溯源应用中的优势和劣势进行了对比,可以发现,在目前已有的报道中,没有一种检测技术可以独立完成物种、产地和生产方式3 个方面的溯源分析。根据溯源目的以及适用条件可选择最佳的检测方法,并且多种技术联合分析的手段将成为溯源检测的发展趋势。

表3 海参不同溯源分析技术的优势和局限性Table 3 Advantages and limitations of different analytical techniques for the traceability of sea cucumber
2.6 溯源分析技术展望
目前还有一些技术开始在海产品的溯源分析中得到应用,这将为海参溯源分析技术的发展提供参考。Itrax X射线荧光光谱法(X ray fluorescence,XRF)是一种可以提供元素组成的方法,常用于沉积物岩芯扫描[93]。这种技术虽然只能输出半定量分析的结果,但具有快速、无损、高精度的优势,并且可以检测到多达31 种不同元素的存在[94]。Gadd等[95]在2018年将该技术的应用拓展到了软生物组织样品,并认为基于Itrax的XRF技术有可能成为食品质量或安全性方面的有效工具。已有报道将Itrax XRF技术和SIA结合进行了有效的黑虎虾生产方式和产地溯源分析[96]。基于该技术的方法还用于建立亚洲鲈鱼(Lates calcarifer)的种源模型,研究表明组合模型中没有错误预测的样本[97]。这些研究结果表明,虽然可能无法提供元素的量化值,但基于Itrax的XRF通过分析样品的元素组成对样品进行溯源是可行的。目前,由于尚不清楚是否会因被扫描的组织类型不同而对结果产生影响,该方法在海参和海参不同组织部位的溯源分析应用方面还需要进一步探究。
3 结 语
目前对于海参物种、产地来源和生产方式3 个方面的溯源分析,上述不同的技术都有其各自的优势。市面上海参深加工产品的不断推出,加之海参养殖模式的演变导致养殖海域及方式的不定,都将给海参溯源分析带来新的挑战。与单一方法相比,使用多种溯源分析技术组合具有更高的辨识精度。同时,还需进一步完善相应的海参溯源分析数据库,探究最佳的化学计量学统计方法,建立不同物种、不同产地、不同生产方式海参的溯源分析判别模型。
海参溯源分析对发现和预防食品欺诈有着重大意义,未来的发展趋势主要包括如下3 个方面:1)深加工产品以及混合样品的定性定量检测;2)快速的现场溯源分析技术;3)构建无损的溯源分析技术体系。随着大数据时代的到来,基因组学、代谢组学、蛋白质组学、脂质组学和糖组学等组学技术的发展为海参溯源分析技术的进一步发展提供了新的机遇。基于多组学分析手段、交叉生物信息学和化学计量学的食品组学分析技术将成为未来海参溯源分析的发展趋势。
