氟苯尼考在鸡蛋和蛋鸡组织中的残留规律及预测模型建立
2021-07-29赵立军
柏 雪,陈 宇,赵立军,张 静
(1.西南民族大学畜牧兽医学院,四川 成都 610041;2.农业农村部畜禽产品质量安全风险评估实验室(成都),四川 成都 610041)
氟苯尼考又称氟甲砜霉素,是氯霉素类广谱抗菌药的一种,广泛应用于猪、鸡、鱼的疾病治疗,主要经由肾脏排出,少量经粪便排出[1]。氟苯尼考胺是氟苯尼考的代谢产物之一,其在动物肝脏中的存留时间相较于氟苯尼考的其他代谢产物更长,常作为动物源食品中氟苯尼考的标示性残留物[2]。氟苯尼考与氯霉素和甲砜霉素相比较,毒性较低、环境污染较小,但长期食用残留有氟苯尼考的食物会导致微生物耐药性的产生,同时对免疫有一定的抑制作用,也会对胚胎造成负面影响[3-7]。Hu Dongfang[6]和El-Ela[7]等发现氟苯尼考会引起小鼠脾和胸腺发育不全和萎缩,诱导脾细胞凋亡,降低淋巴细胞的增殖和存活能力,抑制体液免疫和细胞免疫。氟苯尼考对动物机体的抗氧化系统也有明显的破坏作用,可以抑制微粒体酶的表达或直接诱导微粒体酶发生氧化。Ren Xianyun等[8]发现氟苯尼考显著抑制了肝胰腺抗氧化系统的功能,氟苯尼考诱导I期和II期解毒基因的转录表达,并改变其相应酶(红霉素N-脱甲基酶和谷胱甘肽S-转移酶)的表达。氟苯尼考还可抑制线粒体蛋白质合成,使线粒体形态受损,通过AMP活化蛋白激酶/哺乳动物雷帕霉素靶蛋白/p70S6K(AMPK/mTOR/p70S6K)途径抑制p70S6K的磷酸化,从而抑制细胞生长和增殖[9]。
为保障食品安全,各国对氟苯尼考残留限量有明确的规定。GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》中规定,氟苯尼考最高残留限量为氟苯尼考与氟苯尼考胺之和,家禽肌肉、皮肤+脂肪、肝脏和肾脏中残留限量分别为100、200、2 500 μg/kg和750 μg/kg[10],与欧盟和美国的限量相当[11],但并未对鸡蛋中残留限量进行规定,仅规定家禽产蛋期禁用氟苯尼考[10]。近几年相关部门对市场抽样检测发现鸡蛋中氟苯尼考残留问题层出不穷,国家市场监管总局通报的鸡蛋氟苯尼考残留事件就有2017年上海、广东、山西、陕西、海南等地的15 批次;2018年上海、天津、山东等地的62 批次;2019年广东、广西等地的12 批次;2020年2月福建的2 批次等。鸡蛋中的氟苯尼考可能来源于以下几个方面:1)饲养期间药物超剂量使用;2)生产中对产蛋期定义理解有歧义;3)休药期制定不合理。禽类在产蛋开始前,卵巢中就已有很多卵母细胞,卵母细胞通过自身分泌合成营养物质和吸收外源细胞(如肝脏细胞)供给的物质(如卵黄前体)逐步形成小卵黄,按照相关规定,该阶段可以对鸡使用氟苯尼考,此时卵黄中必然会有药物残留。经过8~14 d,卵黄逐步发育成熟,最大的卵黄脱离卵巢到达输卵管,膨大部被蛋清包裹,再于输卵管后部经18~20 h形成蛋壳产出体外[12],卵黄的名称则变为蛋黄,此时产蛋期开启。一般认为生产中商品蛋鸡群体产蛋率达到5%为正式开产。因此研究氟苯尼考在家禽体内的清除规律,确定氟苯尼考的休药期对保障动物性食品质量安全有重要意义。但目前关于氟苯尼考残留清除规律的研究主要集中在水产方面[13-14],鸡蛋和鸡肉中的研究报道较少,卵黄中氟苯尼考及氟苯尼考胺的清除规律研究鲜见报道。综合上述因素,本实验以蛋鸡为模型,通过投喂蛋鸡不同剂量的氟苯尼考,研究其对蛋鸡生产性能及健康的影响,确定其在鸡蛋、卵黄、肌肉、肝脏中的清除规律,建立残留数学模型,为氟苯尼考相关标准的制定及风险评估提供科学依据,为畜产品安全保障提供数据支持,以确保食品质量安全。
1 材料与方法
1.1 动物与试剂
所选用的罗曼粉壳蛋鸡为350 日龄、体质量(1.97±0.07)kg,处于产蛋高峰期。
氟苯尼考(纯度98.8%) 杭州爱力迈动物药业有限公司提供;氟苯尼考、氟苯尼考胺、D5-氯霉素(均为标准品) 德国Sigma公司;乙腈(色谱纯)、正己烷(色谱纯) 德国Merck公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
1290/6460液相色谱-质谱/质谱联用仪 美国Agilent公司。
1.3 方法
1.3.1 鸡的饲养管理
实验在铁骑力士集团花荄试验基地进行。将处于产蛋高峰期的罗曼粉壳蛋鸡250 只分为5 个处理组,每组5 个重复,每个重复10 只鸡。实验鸡均单笼饲养,每个处理组均匀分布在上下两层,每天喂食2 次(7∶00、15∶00),自由饮水,给药期为5 d,给药时间为上午6∶00~7∶00,各处理组给药剂量分别为0、30、60、120、240 mg/(kgmb·d)。收蛋时间为16∶00~17∶00;休药期为28 d。保持动物房洁净,温度(20±2)℃、相对湿度(55±5)%,光照:14 h光照/10 h黑暗,定期清理粪便,定期消毒。自给药日起至休药期结束,每日记录各个重复组蛋鸡产蛋数和每个鸡蛋的平均质量(蛋质量),并按式(1)计算不同周期的日均产蛋率。

1.3.2 鸡蛋及组织样品中氟苯尼考、氟苯尼考胺清除规律分析
1.3.2.1 取样
休药第1~28天,每天在各处理组各重复组均随机挑选2 个鸡蛋,人工分离蛋清、蛋黄后,将相同重复组的蛋清和蛋黄分别混合制成混样,即每个处理组具有5 个重复混样,于-20 ℃保存待测。
在休药第1、3、5、7、10、14、21、28天在各处理组的每个重复组分别随机屠宰1 只鸡,即每个处理组5 只鸡,采集卵黄、左侧胸肌、肝脏,于-20 ℃保存待测。
1.3.2.2 氟苯尼考及氟苯尼考胺残留含量的测定
标准液配制:准确称取适量的氟苯尼考和氟苯尼考胺标准物质,用甲醇配成100 μg/mL的标准储备溶液,4 ℃保存。准确吸取100 μL D5-氯霉素标准溶液(100 μg/mL)于10 mL容量瓶中,用甲醇配成1 μg/mL的内标标准储备液。
样品前处理:称取5 g样品,置于50 mL聚丙烯离心管中,加入内标储备液(D5-氯霉素)100 μL、25 mL乙酸乙酯、0.75 mL氨水、3 g无水硫酸钠,匀浆提取30 s,8 000 r/min离心5 min,上清液转移至50 mL聚丙烯离心管;另取一支50 mL聚丙烯离心管,用20 mL上述上清液洗涤匀浆机刀头10 s,洗涤液移入第一支离心管中与第一次上清液合并,漩涡振荡1 min,超声波振荡提取5 min,8 000 r/min离心5 min,取上清液,乙酸乙酯定容至50 mL得到提取液。摇匀,移取10 mL提取液于离心管中45 ℃恒温氮吹至干,离心管中残渣用2 mL超纯水溶解,漩涡振荡,超声5 min,加入5 mL正己烷,漩涡振荡30 s,静置分层,弃掉上层正己烷,再加入5 mL正己烷,漩涡振荡30 s,8000 r/min离心10 min,经0.22 μm滤膜过滤后,待测[12]。
色谱条件:色谱柱:C18柱(100 mm×2.1 mm,1.7 µm);柱温40 ℃;流动相:乙腈+体积分数0.1%甲酸溶液;流速0.3 mL/min;进样量5 µL。
质谱条件:离子源:电喷雾离子源(electrospray ionization,ESI);氟苯尼考负离子扫描,氟苯尼考胺正离子扫描;检测方式:多反应选择离子检测(multiple reaction monitoring,MRM);雾化气、气帘气、辅助加热气、碰撞气:高纯氮气;雾化气温度:300 ℃。氟苯尼考定性定量离子对:356.0/336.0、356.0/185.0;氟苯尼考胺定性定量离子对:248.3/230/2、248.3/130/2;D5-氯霉素定量离子对:326.1/157.1。
采用内标法定量计算样品中氟苯尼考的残留含量,外标法定量计算样品中氟苯尼考胺的残留含量。
1.4 数据处理与分析
用SPSS 18.0软件对药物残留数据进行两因素重复测量数据方差分析,并以休药时间/d为自变量X1、给药剂量/(mg/(kgmb·d))为自变量X2,残留含量为因变量Y(Y1为氟苯尼考含量,Y2为氟苯尼考胺含量,单位均为μg/kg),对其进行回归分析,建立数学模型;P<0.05为差异显著,结果用平均值±标准差表示。
2 结果与分析
2.1 投喂不同剂量氟苯尼考对产蛋鸡生产性能的影响
由表1、2可知,休药1~3 d,240 mg/(kgmb·d)剂量组蛋鸡产蛋率显著低于其他剂量组(P<0.05),其余各处理组蛋鸡产蛋率和平均蛋质量差异均不显著(P>0.05)。随着休药时间延长,高剂量组的产蛋率也逐步恢复到对照组水平(P>0.05)。

表1 氟苯尼考给药期和休药期蛋鸡的产蛋率Table 1 Egg laying rates of laying hens during and after administration with florfenicol%

表2 氟苯尼考给药期和休药期蛋鸡产蛋的平均质量Table 2 Average mass of eggs from laying hens during and after administration with florfenicol g
2.2 氟苯尼考及氟苯尼考胺在鸡蛋中的清除规律及预测模型建立
2.2.1 休药期间蛋清中氟苯尼考及氟苯尼考胺残留含量
由表3可知,各剂量组蛋清中的氟苯尼考含量均在休药第1天达到峰值,给药剂量为60 mg/(kgmb·d)时,休药第8天蛋清中未检出氟苯尼考;给药剂量为30、120、240 mg/(kgmb·d)时,休药第8天均只有1 个样品检出氟苯尼考,含量分别为0.74、1.19、3.55 μg/kg,休药第9天所有剂量组均未检出。由表4可知,氟苯尼考胺的残留清除规律与氟苯尼考类似,未检出所需休药时间比氟苯尼考少1 d。

表3 休药期间蛋清中的氟苯尼考残留含量(n=5)Table 3 Residual amounts of florfenicol in egg white at different times after administration (n= 5)μg/kg

表4 休药期间蛋清中的氟苯尼考胺残留含量(n=5)Table 4 Residual amounts of florfenicol amine in egg white at different times after administration (n= 5)μg/kg
氟苯尼考的剂量和休药时间对蛋清中氟苯尼考及氟苯尼考胺含量的影响高度显著(P<0.001),且剂量与休药时间存在高度显著的互作效应(P<0.001),氟苯尼考(P<0.001,R2=0.590)、氟苯尼考胺(P<0.001,R2=0.672)残留含量回归拟合方程分别如公式(2)、(3)所示。

2.2.2 休药期间蛋黄中氟苯尼考及氟苯尼考胺残留含量
由表5可知,给药剂量为30、60 mg/(kgmb·d)时,休药第12天蛋黄中未检出氟苯尼考;给药剂量为120、240 mg/(kgmb·d)时,氟苯尼考含量分别于休药第2、3天达到峰值,休药第14天未检出。由表6可知,30、60、120、240 mg/(kgmb·d)剂量组氟苯尼考胺含量均在休药第2天达到峰值,分别为(1 126.02±113.10)、(3 180.88±532.25)、(8 530.48±2 346.55)、(25 789.22±1 679.94)μg/kg,所有组药物未检出所需休药时间比氟苯尼考多1 d。
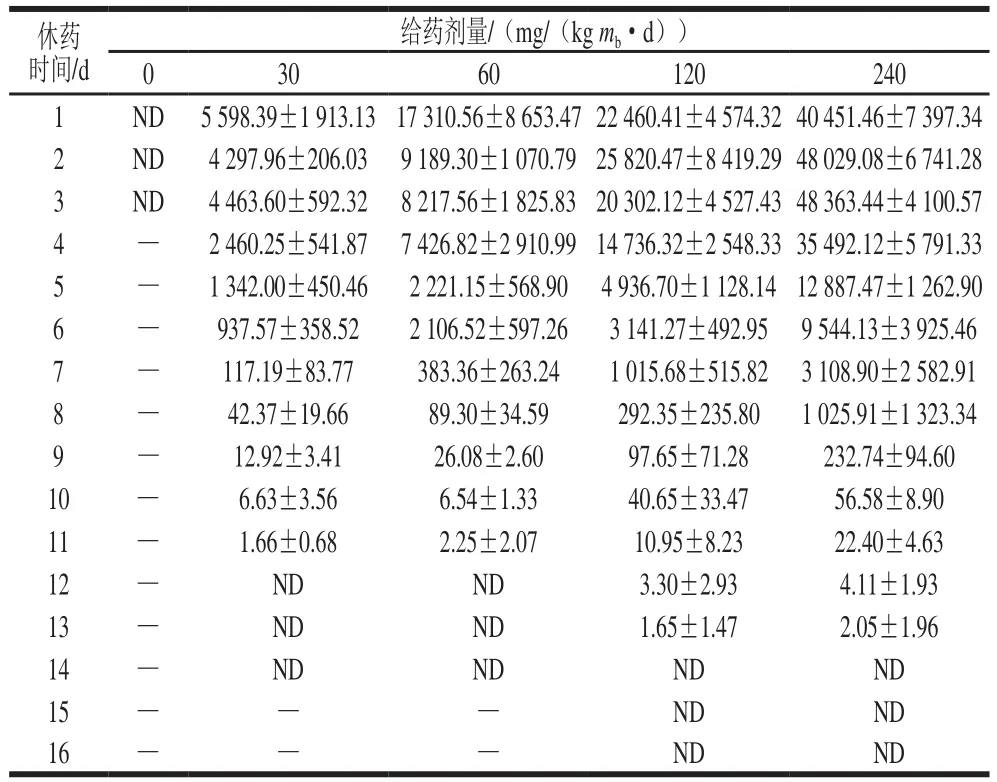
表5 休药期间蛋黄中的氟苯尼考残留含量(n=5)Table 5 Residual amounts of florfenicol in egg yolk at different times after administration (n= 5)μg/kg

表6 休药期间蛋黄中的氟苯尼考胺残留含量(n=5)Table 6 Residual amounts of florfenicol amine in egg yolk at different times after administration (n= 5)μg/kg
投喂氟苯尼考的给药剂量和休药时间对蛋黄中氟苯尼考及氟苯尼考胺含量影响均高度显著(P<0.001),且给药剂量与休药时间互作效应高度显著(P<0.001),氟苯尼考(P<0.001,R2=0.846)、氟苯尼考胺(P<0.001,R2=0.838)残留含量回归拟合方程分别如公式(4)、(5)所示。

2.2.3 休药期间卵黄中氟苯尼考及氟苯尼考胺残留含量
由表7可知,给药剂量为30 mg/(kgmb·d)时,休药第14天卵黄中未检出氟苯尼考;给药剂量为60、120、240 mg/(kgmb·d)时,则需休药21 d才不能在卵黄中检测出氟苯尼考。由表8可知,给药剂量为30、60 mg/(kgmb·d)时,休药第14天卵黄中未检出氟苯尼考胺;给药剂量为120、240 mg/(kgmb·d)组,则需休药21 d才不能在卵黄中检测出氟苯尼考胺。卵黄消除氟苯尼考和氟苯尼考胺所需的的休药时间均长于蛋黄。

表7 休药期间卵黄中的氟苯尼考残留含量(n=5)Table 7 Residual amounts of florfenicol in yolk at different times after administration (n= 5)μg/kg
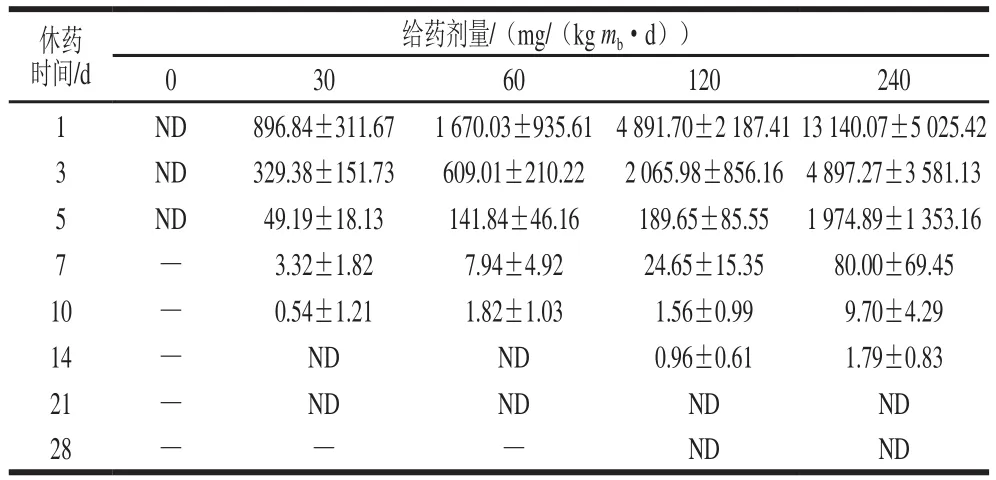
表8 休药期间卵黄中的氟苯尼考胺残留含量(n=5)Table 8 Residual amounts of florfenicol amine in yolk at different times after administration (n= 5)μg/kg
与蛋清、蛋黄相同,给药剂量和休药时间对卵黄残留含量的影响高度显著(P<0.001),且互作效应高度显著(P<0.001),氟苯尼考(P<0.001,R2=0.630)、氟苯尼考胺(P<0.001,R2=0.578)残留含量回归拟合方程分别如公式(6)、(7)所示。

2.3 氟苯尼考及氟苯尼考胺在肌肉中的清除规律及预测模型建立
由表9可知,给药剂量为30、60、120 mg/(kgmb·d)时,休药第14天时肌肉中未检出氟苯尼考;给药剂量为240 mg/(kgmb·d)时,休药第21天肌肉中未检出氟苯尼考;各剂量组(30、60、120、240 mg/(kgmb·d))肌肉氟苯尼考含量在休药第1天达到峰值,分别为(6.91±2.73)、(24.67±11.56)、(45.31±12.27)μg/kg和(115.94±48.14)μg/kg。由表10可知,给药剂量为30、60 mg/(kg·d)时,休药第7天均只有1 份样品检出氟苯尼考胺,其含量分别为0.71、0.37 μg/kg,休药第10天未检出;给药剂量为120、240 mg/(kgmb·d)时,休药第10天肌肉中未检出氟苯尼考胺。
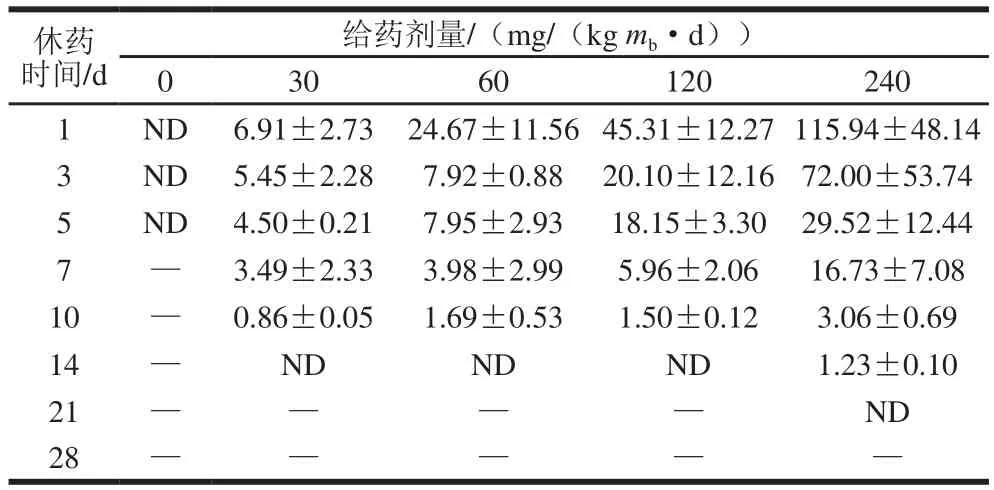
表9 休药期间肌肉中的氟苯尼考残留含量(n=5)Table 9 Residual amounts of florfenicol in muscle at different times after administration (n = 5)μg/kg
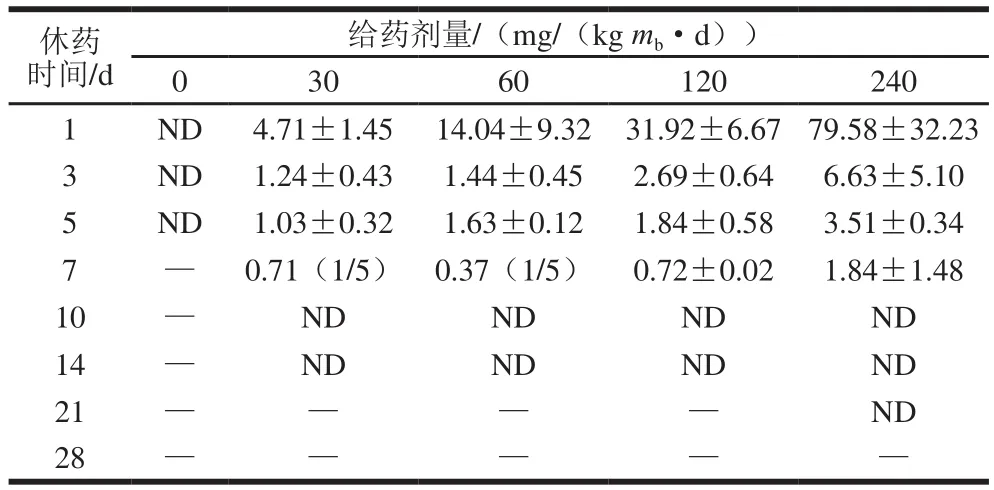
表10 休药期间肌肉中的氟苯尼考胺残留含量(n=5)Table 10 Residual amounts of florfenicol amine in muscle at different times after administration (n= 5)μg/kg
肌肉中氟苯尼考(P<0.001,R2=0.130)、氟苯尼考胺(P<0.001,R2=0.440)残留含量回归拟合方程分别如公式(8)、(9)所示。由于方程的决定系数较低,采用给药剂量与休药时间推测肌肉中的残留含量还需进一步研究。

2.4 氟苯尼考及氟苯尼考胺在肝脏中的清除规律及预测模型建立
由表11可知,给药剂量为30 mg/(kgmb·d)时,休药第5天肝脏中未检出氟苯尼考;给药剂量为60 mg/(kgmb·d)时,休药第5天肝脏仅有1 份样品检出氟苯尼考,其含量为1.80 μg/kg;给药剂量为120、240 mg/(kgmb·d)时,休药第7天肝脏中未检出氟苯尼考。由表12可知,休药第7天各剂量组肝脏未检出氟苯尼考胺。与肌肉相比,肝脏中氟苯尼考和氟苯尼考胺完全消除所需的休药时间更短。氟苯尼考(P<0.001,R2=0.672)、氟苯尼考胺(P<0.001,R2=0.664)残留含量回归拟合方程分别如公式(10)、(11)所示。

表11 休药期间肝脏中的氟苯尼考残留含量(n=5)Table 11 Residual amounts of florfenicol in liver at different times after administration (n= 5)μg/kg

表12 休药期间肝脏中的氟苯尼考胺残留含量(n=5)Table 12 Residues of florfenicol amine in liver at different times after administration (n= 5)μg/kg

3 讨 论
3.1 氟苯尼考对产蛋鸡生产性能的影响
氟苯尼考是治疗用药,主要用于猪、鸡、鱼呼吸道疾病的治疗,低剂量下有一定的促生长效果[15]。但高剂量或长期使用氟苯尼考会降低动物采食量,影响机体健康[16-17]。在禽类动物产蛋性能方面,研究发现氟苯尼考可以导致蛋壳厚度下降,畸形蛋数量增多,种蛋受精率和孵化率下降[18-19]。本实验也发现240 mg/(kgmb·d)剂量组在休药期的1~3 d蛋鸡产蛋率显著低于对照组,也说明过量使用氟苯尼考对禽类动物产蛋性能有负面影响。
3.2 氟苯尼考在产蛋鸡和鸡蛋各部位的残留含量
口服氟苯尼考后,氟苯尼考直接进入胃肠道,一部分吸收进入肝脏,一部分随着血液循环到达其他部位,进入肝脏的氟苯尼考在肝药酶的作用下代谢分解成氟苯尼考胺等代谢产物,到达肾脏的氟苯尼考则以原形式随尿液排出[20-23]。本实验发现在蛋鸡的肝脏和肌肉组织与蛋清、蛋黄中均检测出氟苯尼考及氟苯尼考胺,且相同时间时氟苯尼考残留含量均高于其代谢产物氟苯尼考胺;组织中氟苯尼考及氟苯尼考胺残留含量在休药第1天达到峰值,鸡蛋中残留含量在休药第1~3天达到峰值,然后进入快速消除期,随后消除速度减慢,这和氟苯尼考半衰期时间吻合,研究表明在鱼、鸡、马、牛体内半衰期分别为12.2、2.9、1.8、2.6 h[1]。也与Xie Kaizhou[23]、Filazi[24]等的研究结果相似。
一些研究者发现氟苯尼考及氟苯尼考胺在动物组织中氟苯尼考残留含量从高到低的部位依次为肾脏>肝脏>皮脂>肌肉,氟苯尼考胺残留含量从高到低的部位依次为肝脏>肾脏>肌肉>皮脂[25-28]。本实验结果与上述研究大致相似。从氟苯尼考和氟苯尼考胺含量分布来看:蛋黄>卵黄>蛋清>肝脏>肌肉,鸡蛋是残留的主要部位,其中蛋黄中的残留含量高于蛋清;从残留消除所需休药时间来看:肝脏<肌肉<蛋清<蛋黄<卵黄,组织中完全消除所需休药时间更短。这和氟苯尼考及氟苯尼考胺的亲脂特性密切相关,脂质含量在蛋黄和卵黄中高于蛋清,在肝脏中高于肌肉。另一方面,这可能还与鸡蛋的形成过程相关。禽类在产蛋开始前,卵巢中就有很多小卵黄形成,经过8~14 d的快速生长期,小卵黄逐个成熟,第一个卵黄(即次日形成鸡蛋的蛋黄)直径可达25 mm。卵黄发育成熟后,脱离卵巢到达输卵管膨大部,经3~4 h被蛋清包裹,再在输卵管峡部经1~1.5 h形成蛋膜,此时即为包裹蛋膜的软蛋,软蛋再于输卵管后部经18~20 h形成完整蛋壳,此时完整的鸡蛋形成[29]。蛋黄中氟苯尼考的残留消除时间为12~14 d,氟苯尼考胺的消除时间为13~15 d,这和卵黄的形成时间8~15 d吻合。鸡蛋形成过程中不断地通过血液循环快速沉积营养物质,而氟苯尼考半衰期较短,代谢及排泄速度快,故而氟苯尼考沉积在鸡蛋中的含量高于组织中,所需休药时间也长于组织。
GB 31650—2019[10]规定产蛋期禁用氟苯尼考。生产中一般认为产蛋率达到5%时,该群蛋鸡即进入产蛋期。而层出不穷的鸡蛋检出氟苯尼考案例可能与贩售产蛋前期鸡蛋有关。美国食品和药物管理局则规定禽类禁用氟苯尼考。为保障食品安全,氟苯尼考的使用和休药可能需要进一步的研究和修订。
3.3 残留预测模型
目前大部分细菌对氟苯尼考仍然敏感,但长期使用会导致耐药基因如ffexA、fexB、cfr、optrA、floR和pexA的产生[30]。抗生素在鸡蛋及可食用组织的残留严重影响食品质量安全,长期摄入残留有氟苯尼考及其代谢产物的食品会使人体产生一定的耐药性。
研究发现休药时间、给药剂量对各部位残留含量有高度显著的影响(P<0.001),且休药时间及给药剂量之间的互作效应高度显著(P<0.001),本实验以休药时间、给药剂量为自变量,残留含量为因变量,建立了残留消除数学模型,其中蛋黄中氟苯尼考及氟苯尼考胺残留模型准确度最高,R2分别为0.846、0.838;蛋清、卵黄、肝脏残留模型准确度低于蛋黄,R2在0.578~0.672之间;而肌肉残留模型准确度较低,其中肌肉氟苯尼考残留模型R2仅为0.130。这可能是因为氟苯尼考及氟苯尼考胺在鸡蛋中残留含量更为稳定,而肌肉中的残留含量还需更多的实验数据支持。建立残留预测数学模型后,可根据药物使用剂量和休药时间预估畜产品残留含量,也可根据药物使用剂量和国家规定的残留限量倒推休药时间,减少实际生产中的检测成本,保障食品安全。根据模型预测,为达到《中国兽药典(2015年版)》规定的氟苯尼考给药剂量范围(40~60 mg/(kgmb·d))[31],肌肉、肝脏等组织需休药1 d,蛋清、蛋黄需休药13 d,卵黄需休药21 d。
4 结 论
氟苯尼考及其代谢产物氟苯尼考胺在产蛋鸡组织中残留含量分布为蛋黄>卵黄>蛋清>肝脏>肌肉,给药剂量与休药时间之间存在高度显著的互作效应,给药剂量、休药时间与残留含量之间呈二元二次回归关系。卵黄所需休药时间最长,蛋清蛋黄次之,但均比肌肉所需休药时间长,提示应重点关注蛋鸡养殖过程中氟苯尼考的使用,加强禽蛋的质量监测,保障食品安全。
