姜黄素对H2O2诱导血小板凋亡的抑制作用及分子机制
2021-07-29牙甫礼XINYu张春梅陈彬林李玮琪马永洁
牙甫礼,XIN Yu,张春梅,陈彬林,李玮琪,马永洁
(1.大理大学公共卫生学院,预防医学研究所,云南 大理 671000;2.大理大学代谢性疾病转化医学研究院,云南 大理 671000;3.大理大学基础医学院,云南 大理 671000;4.河口海关,云南 河口 661300;5.广西壮族自治区妇幼保健院营养科,广西 南宁 530000)
心血管疾病(cardiovascular diseases,CVDs)的发病率和死亡率逐年上升,严重威胁人民的健康,动脉粥样硬化和血栓形成是CVDs致死的主要原因[1-2]。动脉粥样硬化和血栓形成的机制错综复杂,近年来大量报道证明了血小板凋亡在其中发挥着极为关键的作用[3-4]。在某些CVDs患者的外周血中,机体高水平的氧化应激(如活性氧(reactive oxygen species,ROS)和超氧化物水平)等因素可促使血小板发生线粒体凋亡[5-6]。在血小板发生线粒体凋亡的过程中,Bcl-2家族的抗凋亡蛋白(Bcl-2和Bcl-xL等)和促凋亡蛋白(Bax和Bak等)在线粒体和细胞质中重新分布,能够引起血小板线粒体膜电位(ΔΨm)发生去极化和线粒体通透转换孔的形成,继而导致细胞色素c释放增多,并激活Caspase-9和Caspase-3,引起细胞表面磷脂酰丝氨酸(phosphatidylserine,PS)暴露,最终导致细胞凋亡[7]。鉴于血小板凋亡在CVDs中的重要作用,抑制血小板凋亡极有可能成为防治CVDs的重要途径之一。
营养膳食干预在CVDs的早期防治中一直起着重要的作用[8-9]。姜黄素(curcumin,Cur)是存在于姜科植物根茎中的一种多酚类化合物,也是香料姜黄中最重要的组成成分[10-11]。研究表明,Cur具有多种生物学活性,如在CVDs防治方面,Cur可改善糖脂代谢紊乱、抑制动脉斑块和血栓形成等[12-13]。体外实验研究发现,Cur可抑制激动剂诱导的血小板聚集和活化[14]。对于Cur调控细胞凋亡方面,大部分的研究主要集中在探讨其对肿瘤细胞凋亡的影响[15-16],但是Cur对H2O2诱导的血小板凋亡是否起调控作用尚鲜见报道。因此,鉴于血小板凋亡在CVDs发生发展中的重要作用,本研究主要通过体外实验来探讨Cur对H2O2诱导的健康人血小板凋亡的影响及其可能的作用机制。
1 材料与方法
1.1 材料与试剂
ROS检测试剂盒、超氧化物检测试剂盒 英国Abcam公司;Cur粉末、H2O2美国Sigma-Aldrich公司;一抗Bax、Bak、细胞色素c、β-actin以及相应的二抗 美国CST公司;5,5’,6,6’-四氯-1,1’,3,3’-四乙基苯并咪唑羰花青碘化物(JC-1) 美国Enzo Life Sciences公司;Caspase-3和Caspase-9活力检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒上海碧云天生物技术有限公司;PE-Annexin V检测试剂盒 美国eBioscience公司。
1.2 仪器与设备
CytoFlex流式细胞仪 美国Beckman Coulter公司;BCD-4.8.5低温冰箱 中国青岛海尔有限公司;POLARstar OPTIMA多功能酶标仪 德国BMG Labtech公司;低温高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 研究对象筛选
从大理大学校内招募到15 名符合条件的健康志愿者(25~40 岁)。在志愿者筛选的过程中,志愿者出现以下至少一种情况将给予排除:现在或曾经患有CVDs、免疫缺陷、恶性肿瘤等疾病;酗酒、吸烟、滥用药物半年以上;在至少两周内未服用任何抗血小板的药物,且近半年内未服用维生素等膳食营养补充剂[17]。
1.3.2 健康人血样及纯化血小板的制备
本研究完全按照《赫尔辛基宣言》人体医学研究的伦理准则进行,在实施前,每个志愿者均已签署知情同意书,且该研究已通过大理大学伦理委员会的批准。在清晨空腹状态下,抽取健康志愿者静脉血15 mL,注入含枸橼酸钠的真空抗凝管中,然后在22 ℃、300×g离心7 min,小心吸取上清液,可得到富血小板血浆,并将其保存在37 ℃恒温孵育箱中备用。纯化血小板的制备过程采用本实验室成熟的分离方法,具体方法参照文献[17-18]。
1.3.3 Cur对血小板细胞毒性的影响
采用LDH细胞毒性检测试剂盒进行Cur对血小板细胞毒性影响的测定。用不同浓度(1、5、10、20、40、80、100、120、150、200 μmol/L)的Cur、溶剂对照(体积分数为0.05%的DMSO,即对照组)、质量分数10%十二烷基硫酸钠(sodium dodecyl sulphate,SDS)分别与健康人纯化血小板共同孵育30 min,然后22 ℃、12 000×g离心5 min,利用酶标仪于490 nm波长处测定上清液的吸光度,并以吸光度表征LDH的含量。实验过程中,将质量分数为10%的SDS作为阳性组,用来刺激血小板释放全部LDH(即血小板LDH总量)。血小板LDH漏出率按下式计算[17]。

1.3.4 实验分组
血小板功能调控实验分组包括静息组:不经任何处理(既不经H2O2激活,也不经DMSO处理)的血小板悬液;对照组:即溶剂对照组,因为在本实验中,Cur粉末用DMSO溶解,所以对照组血小板中仅加入体积分数0.05%的DMSO;Cur组:分为3 个浓度梯度,分别为Cur(1 μmol/L)、Cur(10 μmol/L)和Cur(100 μmol/L);其中对照组和Cur组均经H2O2(100 μmol/L)刺激。
1.3.5 流式细胞术检测血小板线粒体膜电位
用不同浓度(1、10、100 μmol/L)的Cur与纯化血小板在体外共同孵育30 min后,12 000×g离心5 min,弃上清液,重悬血小板,加入H2O2(100 μmol/L)继续孵育60 min,孵育完成后,将纯化血小板悬液(1×106个/mL)加入流式上样管中,并加入终质量浓度为1 μg/mL的JC-1工作液,并迅速弹匀,在室温下避光孵育20 min后加入磷酸盐缓冲液,立即使用CytoFLEX流式细胞仪检测血小板ΔΨm水平[18]。用JC-1单体相对含量来表示血小板ΔΨm去极化水平,以此衡量细胞凋亡程度。
1.3.6 流式细胞术检测血小板表面PS暴露水平
将经不同浓度的Cur(1、10、100 μmol/L)和H2O2(100 μmol/L)干预的血小板悬液(1×106个/mL)以每管50 μL的体积加入流式上样管中,同时避光加入终质量浓度为1 mmol/L的CaCl2溶液以及2.5 μL的Annexin V抗体,混匀后避光孵育15 min,加入终止液,在30 min内用CytoFLEX流式细胞仪检测血小板表面PS的暴露水平,并使用CytExpert 2.0软件分析结果[18]。
1.3.7 血小板Caspase-3和Caspase-9活化水平的测定
血小板Caspase-3和Caspase-9的活化水平按照试剂盒说明书进行测定。将不同浓度的Cur或溶剂对照与健康成人纯化血小板在体外共同孵育30 min后,12 000×g离心5 min,弃上清液,重悬血小板,加入H2O2(100 μmol/L)继续孵育60 min,孵育完成后,加入相应的底物,室温下避光孵育30 min后,在激发波长为485 nm和发射波长为515 nm的条件下读取荧光值,用来反映细胞内Caspase-3的活化水平。检测Caspase-9的活化水平时,将处理好的纯化血小板在4 ℃、12 000×g下离心5 min,对血小板沉淀进行冰浴裂解15 min后,收取上清液,测定蛋白浓度后加入Ac-LEHD-pNA,并于37 ℃孵育60 min,然后在405 nm波长处进行吸光度的测定,用来反映Caspase-9的活化水平。
1.3.8 血小板总ROS和超氧化物生成水平的测定
将不同浓度的Cur或溶剂对照与健康人纯化血小板(1×106个/mL)共同孵育30 min,12 000×g离心5 min,弃上清液后,重悬血小板,加入H2O2(100 μmol/L)继续孵育60 min,各个组吸取80 μL的血小板悬液至新的离心管中,然后加入10 μL的氧化应激检测液(20 μmol/L)和10 μL的超氧化物检测试剂液(20 μmol/L),避光孵育,然后在4 ℃、12 000×g离心5 min,弃上清后重悬血小板,再次在4 ℃、12 000×g离心5 min,然后用磷酸盐缓冲液(pH 7.0)润洗血小板3 次,最后在激发波长490 nm和发射波长525 nm条件下读取荧光强度,以反映胞内总ROS水平,在激发波长550 nm和发射波长620 nm条件下读取荧光强度,以反映超氧化物水平[17]。
1.3.9 Western blot蛋白免疫印迹分析
经Cur和H2O2处理后,将纯化血小板悬液4 ℃、10 000×g离心15 min,收集血小板沉淀,冰上裂解30 min,再次4 ℃、10 000×g离心15 min后收集上清得到血小板蛋白,并进行SDS-聚丙烯酰胺凝胶电泳,转膜并分别加入一抗(Bax、Bak、细胞色素c和β-actin)和相应的二抗后,对条带进行曝光,其灰度则用Quantity One分析软件进行计算分析[17-19]。
1.4 数据处理与分析
实验结果用平均值±标准误差表示。采用GraphPad Prism 5.0软件作图。采用SPSS 20.0统计软件进行多组间两两比较,采用单因素方差分析,双侧P<0.05代表差异具有统计学意义。
2 结果与分析
2.1 Cur对血小板细胞毒性的影响
如图1所示,用不同浓度的Cur干预血小板后,与对照组(体积分数0.05% DMSO)相比,Cur浓度在1~120 μmol/L范围内,各组LDH漏出率无统计学差异(P>0.05),但均显著低于10% SDS组(P<0.05);而Cur浓度为150、200 μmol/L时,其LDH漏出率显著高于对照组(P<0.05),因此可以认为在1~120 μmol/L的浓度范围内,Cur对健康人纯化血小板无明显的细胞毒性作用。另外,结合其他文献报道中所用的Cur浓度[20],本实验最终选择1、10 μmol/L和100 μmol/L进行后续实验。

图1 Cur对血小板细胞毒性的影响Fig. 1 Cytotoxic effect of Cur on platelets
2.2 Cur对H2O2诱导的血小板ΔΨm去极化和PS暴露水平的影响
流式细胞术结果表明,H2O2刺激后,与静息组血小板相比,血小板JC-1单体相对含量明显提高,如图2A所示。说明H2O2可促进血小板ΔΨm去极化,血小板发生凋亡。而经不同浓度的Cur干预后,Cur组与对照组相比,JC-1单体相对含量显著降低(P<0.05),但是不同浓度Cur组之间相比差异无统计学意义(P>0.05),说明Cur可显著抑制H2O2诱导的血小板ΔΨm去极化;同时,如图2B所示,10 μmol/L和100 μmol/L的Cur可显著降低H2O2诱导的血小板表面PS暴露水平(P<0.05),相对于1 μmol/L的Cur,100 μmol/L组对PS暴露的降低作用更显著(P<0.05)。以上实验结果表明,一定浓度的Cur可显著抑制H2O2诱导的血小板凋亡。

图2 Cur对H2O2诱导的血小板ΔΨm去极化(A)和PS暴露水平(B)的影响Fig. 2 Effect of Cur on H2O2-induced platelet ΔΨm depolarization (A)and PS exposure (B)
2.3 Cur对H2O2诱导的血小板Caspase-9和Caspase-3活化的影响
如图3所示,与对照组相比,10 μmol/L和100 μmol/L的Cur均可显著抑制H2O2诱导的血小板Caspase-9和Caspase-3活化(P<0.05),但是低浓度(1 μmol/L)的Cur并不能显著抑制H2O2诱导的血小板Caspase-9和Caspase-3活化(P>0.05);此外,100 μmol/L的Cur相对于1 μmol/L的Cur,对血小板Caspase-9和Caspase-3活化的抑制作用更为显著(P<0.05)。
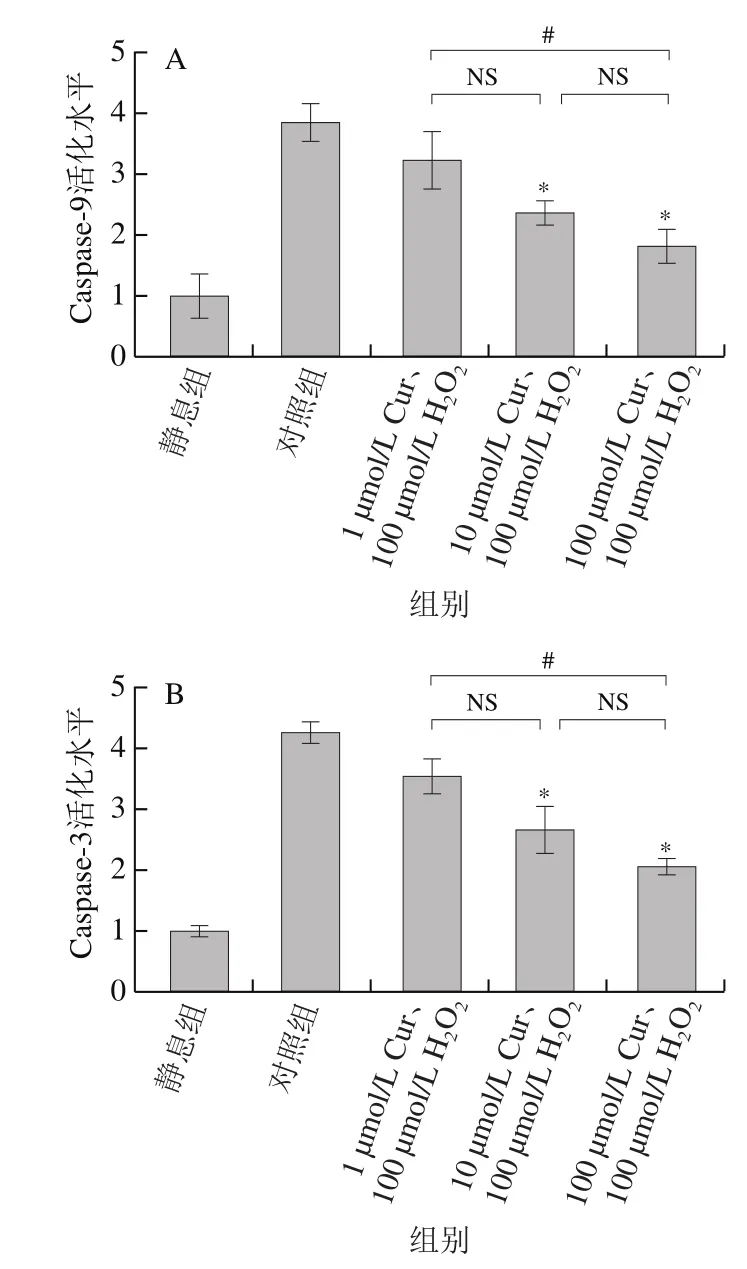
图3 Cur对H2O2诱导的血小板Caspase-9(A)和Caspase-3(B)活化水平的影响Fig. 3 Effect of Cur on H2O2-induced platelet caspase-9 (A) and caspase-3 (B) activation level
2.4 Cur对H2O2诱导的血小板凋亡相关蛋白表达的影响
如图4A、B所示,H2O2可明显上调血小板Bax和Bak的相对表达量,10 μmol/L和100 μmol/L的Cur可显著抑制H2O2诱导的Bax相对表达量提升(P<0.05),各Cur组间相比,100 μmol/L相对于1 μmol/L的Cur对Bax表达的抑制作用更为显著(P<0.05)。只有100 μmol/L的Cur可显著抑制Bak的相对表达量(P<0.05);10 μmol/L和100 μmol/L两组间相比,对Bak表达的抑制作用也存在显著差异(P<0.05)。如图4C所示,Western blot分析结果表明,H2O2诱导的细胞色素c蛋白相对表达量可被10 μmol/L和100 μmol/L的Cur显著下调(P<0.05),各Cur组间的比较结果与Bak比较结果一致。

图4 Cur对H2O2诱导的血小板Bax(A)、Bak(B)和细胞色素c(C)表达的影响Fig. 4 Effect of Cur on the expression of Bax (A), Bak (B) and cytochrome c (C) in H2O2-induced platelets
2.5 Cur对H2O2诱导的血小板氧化应激水平的影响
如图5A、B所示,H2O2刺激血小板后,胞内总ROS水平和超氧化物水平较静息组血小板明显升高,经不同浓度的Cur干预后,10 μmol/L和100 μmol/L的Cur可显著抑制H2O2诱导的血小板内ROS水平和超氧化物生成(P<0.05),通过对各Cur组间进行比较,发现各组间无显著剂量依赖关系。以上结果说明,Cur可显著降低H2O2诱导的血小板氧化应激水平。

图5 Cur对H2O2诱导的血小板总ROS水平(A)和超氧化物生成水平(B)的影响Fig. 5 Effect of Cur on total ROS (A) and superoxide generation (B) in H2O2-induced platelets
3 讨 论
大量的研究表明,血小板凋亡参与多种CVDs的发生和发展过程,例如在高脂血症、糖尿病、心肌梗死等疾病中,高水平的氧化应激可诱导血小板发生凋亡,进而加速血栓的形成[5]。血小板凋亡后可释放大量的血小板微粒(platelet-derived microparticles,PMPs),近年来大量的研究已经证实了循环中的PMPs是促进动脉粥样硬化以及血栓形成进而加速CVDs发生发展最重要的因素之一[21-23]。主要原因是PMPs表面的PS具有很强的促凝血功能,通过增加促凝活性,进而促进凝血酶的生成与释放,从而加速血栓的形成和发展[22,24]。本实验结果表明,Cur可显著抑制H2O2诱导的血小板凋亡,更重要的是,可抑制血小板表面PS的暴露水平,这很有可能是Cur防治CVDs中血栓形成和发展的一个重要机制。然而,在动物实验中,膳食补充Cur对血小板凋亡以及PMPs产生是否有影响则需要进一步证实。另外,大量的研究表明,血小板内源性凋亡通路对于介导CVDs中血小板凋亡起主要作用[7]。本研究发现,Cur能够抑制内源性凋亡通路,例如抑制H2O2诱导的血小板Bax、Bak和细胞色素c的表达,并抑制ΔΨm发生去极化,进而抑制Caspase-9和Caspase-3的活化,最终抑制血小板凋亡。但是Cur是否作用于血小板外源性凋亡通路及其具体机制仍需进一步探讨。此外,研究表明,凋亡的血小板在形态上表现为质膜起泡、伪足延伸以及细胞体积收缩等[7],而Cur对血小板凋亡过程中形态学的影响需要更深一步的研究和探讨。
在CVDs中,尽管调控血小板凋亡的机制是错综复杂的,但是大多数研究认为氧化应激对于调控血小板凋亡起关键作用[5,25]。例如在糖尿病患者中,血小板凋亡水平提高,与其细胞内过量的ROS密切相关[26];体外实验也发现,H2O2可直接促进血小板凋亡[27]。本研究发现,Cur可显著抑制H2O2诱导的血小板内总ROS水平和超氧化物生成,这可能是Cur抑制H2O2诱导血小板凋亡的一个重要机制。大量的研究也证实,Cur具有较强的抗氧化能力,这也是Cur发挥防治CVDs的重要机制之一[28-29]。然而,在本研究中,Cur经抑制氧化应激调控血小板凋亡的机制尚不清楚,仍需要进一步探讨。另外,研究表明,在某些CVDs状态下,机体外周血中可检测到的H2O2浓度范围为5~200 μmol/L,因此本研究选择的H2O2浓度为100 μmol/L,与其他文献报道的用于刺激血小板的H2O2浓度相一致[27]。
中药材姜黄中的有效成分很多,其中Cur、去甲氧基姜黄素和二去甲氧基姜黄素对血小板凋亡的作用是不一样的,例如Cur和去甲氧基姜黄素不影响静息的血小板凋亡,而二去甲氧基姜黄素可显著促进静息的血小板凋亡[30]。说明Cur类化合物的生物活性可能具有多样性,而且其中各成分的药理作用可能不尽相同。Cur作为膳食补充剂在CVDs中发挥重要作用[31-33],咖喱中富含Cur,日常生活中经常食用咖喱的人群,Cur日摄入量可达260 mg,并且膳食补充Cur的安全剂量也是相对较高的,研究表明,健康成人每日摄入10 g的Cur也未观察到毒副作用[34]。本研究所用的Cur浓度范围为1~100 μmol/L,与其他报道的体外研究中所使用的Cur浓度相近[20]。值得注意的是,尽管有研究表明Cur具有防治多种慢性病的作用,但是通过膳食补充Cur,其生物利用度很低,这是Cur在临床上使用受限的最主要因素。大量研究表明,膳食摄入Cur后,发挥对健康有益作用的物质极有可能是其肠道代谢物[10]。有研究表明,代谢物四氢姜黄素具有吸收性好、活性强等特点,因此在有些疾病的防治中可能比Cur具有更大的使用价值[34]。目前学者们也不断研发出新的技术以提高Cur的生物利用度和稳定性,如采用纳米粒子或者脂质体与Cur结合可大大提高Cur的生物利用度和生物活性[10]。本研究通过体外实验证实了Cur具有抑制H2O2诱导血小板凋亡的作用,但是膳食补充Cur对血小板凋亡的调控作用仍需体内实验进一步深入探讨。综上,本研究从营养膳食或从功能食品途径为Cur防治CVDs提供了一定的理论依据和应用价值。
