豌豆寡肽对饮食诱导的高血压大鼠血管紧张素转化酶活性及肠道菌群调节效果评价
2021-07-29陈炫宏董雷超南希骏孙婉婷周泉城
陈炫宏,嵇 威,董雷超,南希骏,王 猛,孙婉婷,王 赛,周泉城,*
(1.山东理工大学农业工程与食品科学学院,山东 淄博 255000;2.山东省食品快速分析技术工程实验室,山东 淄博 255049)
高血压(hypertension,HTN)是一种以体循环动脉血压增高为主要特征的临床综合征[1]。1958—2015年间全国HTN抽样调查结果显示,我国成年人HTN总患病率逐年升高趋势明显[2]。并且HTN还可引发其他并发症,其中以脑卒中和心肌梗死最为常见,严重威胁着我国居民的健康[3]。随着对HTN研究的不断深入,已有研究证明血管紧张素转化酶(angiotensin converting enzyme,ACE)与HTN的形成有重要联系[4],ACE的主要作用是催化血管紧张素I(angiotensin I,Ang I)转化为具有强收缩血管作用的Ang II,从而使心肌收缩力增强,造成血压升高[5]。此外,HTN还可能与肠道微生物有关[6],多项对HTN大鼠肠道菌群的研究表明,HTN组大鼠肠道菌群的混乱度、丰富度和多样性等与正常大鼠相比均会发生显著变化[7-9]。
近年来,越来越多的研究表明可食用的植物源蛋白酶解液对HTN具有一定的治疗效果,朱玲[10]研究发现豌豆蛋白酶解液具有抑制ACE活性的作用,其中含有2~4 个氨基酸的寡肽效果最好,但未指明其抑制ACE的寡肽组成及与ACE的作用方式。为探明豌豆寡肽(Val-Glu-Pro-Gln,VGPG)对HTN的调节效果及作用方式,本研究在VGPG与ACE分子对接作用机制研究的基础上,对其调节HTN大鼠的血压、血液中血脂、ACE含量以及肠道菌群相关指标进行测定,分析VGPG在HTN调节过程中与ACE活性、肠道菌群之间的关系,旨在阐明VGPG对饮食引起的HTN的作用规律和机制。
1 材料与方法
1.1 动物、材料与试剂
雄性Wistar大鼠(8 周龄、体质量(200±20)g)由济南金丰实验动物有限公司提供,生产许可证号:SCXK(鲁)2014-0007。配套标准饲料与垫料由济南金丰实验动物有限公司提供。
VGPG 杭州肽佳生物科技有限公司;非洛地平缓释片 合肥立方制药股份有限公司;马尿酰组胺酰亮氨酸(N-hippuryl-His-Leu hydrate,HHL)、ACE美国Sigma公司;食用盐 湖北长舟盐化有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、游离脂肪酸(free fatty acid,FFA)、脂蛋白a(lipoprotein(a),Lp(a))、ACE免疫分析试剂盒 上海酶联生物科技有限公司;乙酸乙酯、D-果糖 上海爱纯生物科技有限公司。
1.2 仪器与设备
ZH-HX-Z型无创尾动脉血压测量分析系统 安徽正华生物仪器设备有限公司;精密分析天平 梅特勒-托利多仪器(上海)有限公司;MULtiskan型酶标仪 北京澎昆博远科贸发展有限公司。
1.3 方法
1.3.1 分子对接
1.3.1.1 受体结构准备
ACE蛋白结构从蛋白质数据库(protein data bank,PDB)中获取,PDB代码为1O8A[11]。对蛋白结构进行加氢处理,并将处理后的结构作为分子对接的初始模型,采用AutoDockTools 1.5.6软件进行处理,保存蛋白原有电荷,并生成pdbqt文件用于对接。
1.3.1.2 配体结构准备
构建多肽分子VGPG的三维结构,多肽N端为缬氨酸,C端为谷氨酰胺。由于实验条件pH值为7.4,因此VGPG的N端被质子化,采用MOPAC程序[12]优化分子结构,计算PM3原子电荷[13],采用AutoDock Tools 1.5.6软件处理配体结构,生成相应的pdbqt文件用于后续对接。
1.3.1.3 分子对接
分子对接采用AutoDock 4.2.6软件包[14]实现,设定1O8A晶体结构中Zn2+所在的位置为活性位点,将多肽VGPG对接到活性位点,对接盒子的中心坐标设为(36.99,41.25,43.45),XYZ各方向的格点数设为80×60×60 个,格点间距为0.375 Å,对接次数为100 次,其余参数采用默认值。
1.3.1.4 分子对接结果优化
分子对接的结果在空间结构上可能存在不合理的原子接触,可以采用能量优化的方法对这些作用力进行释放,使其更趋于稳定结构。能量优化采用Amber14力场[15],优化过程分两步进行:先进行5 000 步的最陡下降法优化,再用5 000 步的共轭梯度法对结构进一步优化,将最终的结果作为后续分析的模型。
1.3.2 体外ACE抑制率及酶促动力学分析
体外ACE抑制率实验参考吴建平等[16]的方法并稍作修改,样品采用不同纯度(70%、85%、98%)、不同质量浓度(0.85、1.7、3.4、6.8、12.8 mg/mL)的VGPG。实验在1.5 mL的离心管中进行,每次测定体系的总体积为0.2 mL:含50 mmol/L pH 8.3磷酸盐缓冲液、300 mmol/L NaCl、5 mmol/L HHL、20 μL 0.2 mg/mL的样品。在37 ℃恒温水浴保温5 min,然后加入酶液(0.1 U溶于1 mL相同缓冲液中)启动反应,恒温保持30 min后,加入0.2 mL 1 mol/L HCl溶液终止反应,再加入1.0 mL冷冻后的乙酸乙酯,均匀混合15 s,3 500 r/min离心5 min,取出0.8 mL乙酸乙酯层转入另一试管中,在90 ℃的烘箱中烘干1 h,再将其重新溶于0.8 mL去离子水中,在228 nm波长处测定光密度值。单位酶活力定义为在37 ℃、1 min内催化HHL形成1 μmol马尿酸所用酶量。抑制率按公式(1)进行计算。

式中:OD1为不存在抑制剂时的光密度值;OD2为抑制剂与酶共同存在时的光密度值;OD0为抑制剂与酶都不存在时的光密度值。
酶促动力学实验参考Chen Jiali等[17]的实验方法并稍作修改,固定ACE质量浓度(0.5 mg/mL)不变,分别以不同浓度(0.81、1.62、2.44、3.24、6.48 mmol/L)HHL为底物,并分别添加质量浓度为0.85、3.4、12.8 mg/mL的VGPG(纯度均为98%),同时设空白对照组(不添加VGPG),37 ℃保温准确反应10 min。测定ACE的酶促反应速率(V),平行测定3 次,通过Lineweaver-Burk双倒数法,以1/V-1/[S]作图,并按米氏双倒数方程(公式(2))计算最大酶促反应速率(Vmax)和米氏常数(Km),根据其结果判断VGPG对ACE的抑制作用类型。
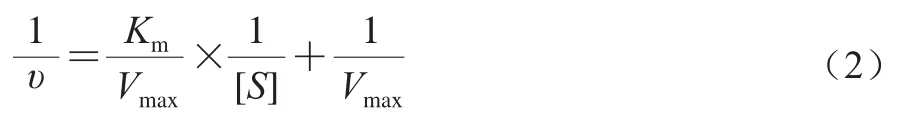
式中:υ为产物生成速率/(μg/min);Km为米氏常数/(mmol/L);[S]为底物浓度/(mmol/L);Vmax为最大反应速率/(μg/min)。
1.3.3 高盐、高糖诱导Wistar大鼠HTN模型的建立与分组
本研究模拟自然人群HTN形成过程[18-19],对大鼠给予含质量分数5% NaCl的高盐饮食和含质量分数20%果糖的高糖饮水。采用大鼠血压心率测定仪每天测压,并进行持续1 周的尾部预温和环境适应训练(将大鼠固定好后等待20 min,使大鼠心率稳定后进行测定),至连续3 d血压收缩压大于140 mmHg并稳定,则视为建模成功。
对建模成功HTN大鼠进行分组,分别为模型组(标记M,生理盐水质量浓度9 g/L)、对照组(标记C,非洛地平缓释片质量浓度0.5 mg/mL)、VGPG高剂量组(质量浓度50 mg/mL)、VGPG中剂量组(质量浓度25 mg/mL)、VGPG低剂量组(质量浓度12.5 mg/mL),同时设立正常组(标记Z,生理盐水质量浓度9 g/L),每组6 只,灌胃剂量5 mL/kgmb,每隔3 d测血压、称质量,灌胃实验持续3 周。
1.3.4 大鼠血清中ACE活性、血脂指标浓度以及脏器指数的测定
血清中ACE活力、血脂指标浓度测定:各组经3 周灌胃实验后,采用眼眶取血法采血,室温静置1 h自然凝固,平衡后3 000 r/min离心10 min,取上清液参照试剂盒说明书测定ACE活力及其他血脂指标(TC、TG、LDL-C、HDL-C、LP(a)、FFA)浓度。
脏器指数测定:灌胃实验结束后解剖大鼠,取出脾脏、肾脏,用滤纸吸干残血后,分别称其质量作为相应脏器指数。
1.3.5 大鼠肠道菌群相关指标测定
3 周灌胃实验结束后处死大鼠并将其解剖,之后在无菌环境下取大鼠肠道粪便贮于灭菌EP管中并密封保存,置于液氮中备用。后将样品送至上海美吉生物医药科技有限公司进行肠道菌群α-多样性分析、菌群群落分析、Heatmap分析。
1.4 数据处理与分析
采用SPSS 17.0软件进行数据分析,Origin 2018软件作图,实验数据用平均值±标准差表示,显著性分析采用单因素方差分析法,差异性显著水平P<0.05。
2 结果与分析
2.1 VGPG与ACE的结合模式分析
通过将VGPG对接到ACE的活性位点,可以深入研究二者的结合模式。分子对接得到的结合能为-26.03 kJ/mol,对接结果如图1所示,可以看出多肽分子VGPG能够结合在ACE的活性位点,并且由于VGPG结构中具有较多的氢键供体和受体,与ACE活性位点的氨基酸残基形成了较强的亲水相互作用。因此,分子对接结果初步表明,VGPG能够与ACE结合并具有较强的亲和力,其中氢键相互作用可能对于二者的结合具有重要的贡献。
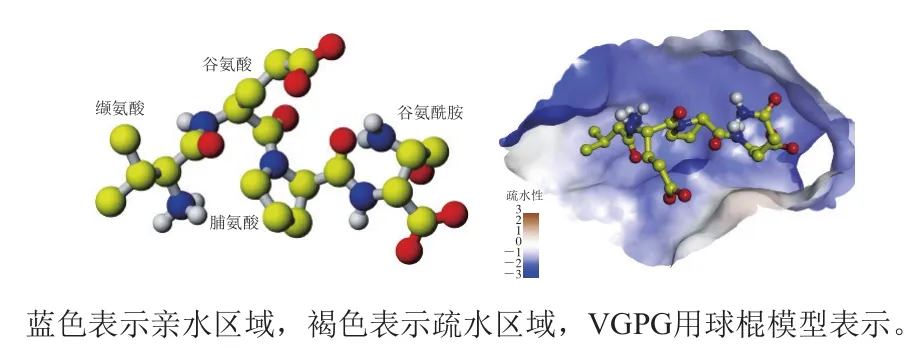
图1 VGPG分子结构(A)及VGPG与ACE活性位点的结合(B)Fig. 1 Molecular structure of VGPG (A) and binding of VGPG to the active site of ACE (B)
VGPG与ACE结合模式如图2所示。参与二者结合的氨基酸残基主要有Ala356、Pro407、Val518、Arg522、Tyr523以及Zn2+,其中VGPG与Ala356和Arg522能够形成氢键,而VGPG的C末端羧基与Zn2+形成了金属配位键,从而起到抑制ACE作用,这与Cheung等[20]的研究结果一致。表明VGPG主要通过氢键作用以及与Zn2+的配位作用与ACE的活性位点结合,对ACE起竞争性抑制作用,从而抑制ACE的活性。
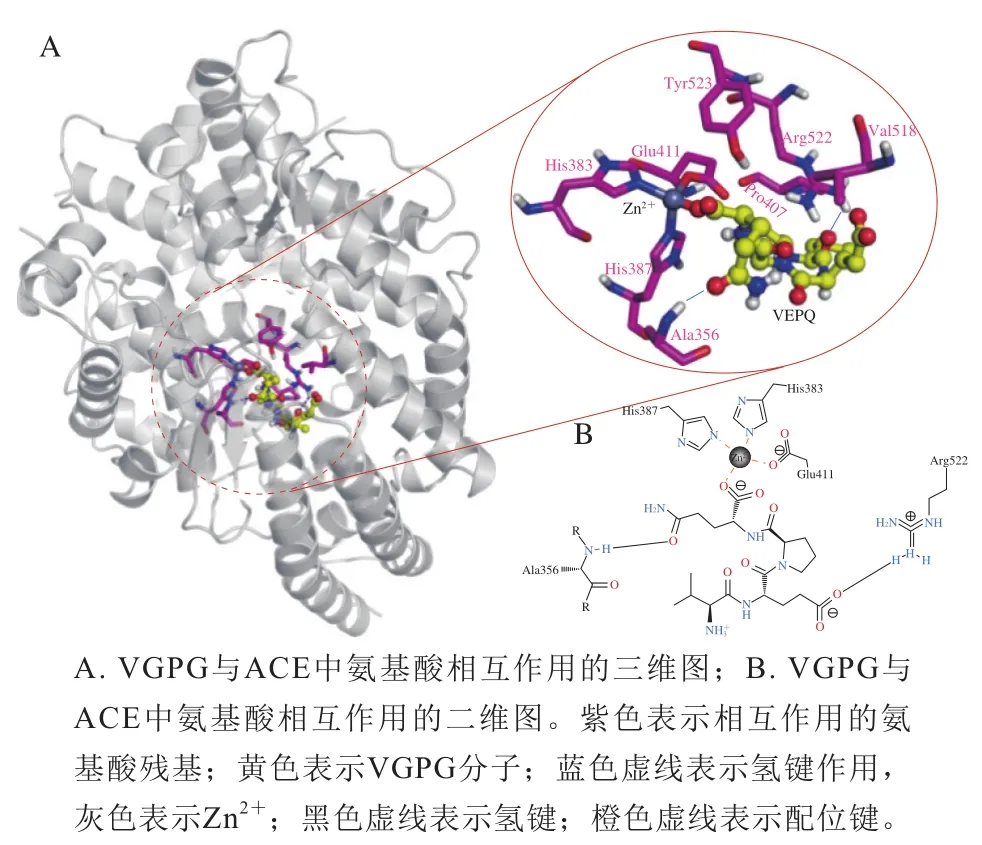
图2 VGPG与ACE的结合模式Fig. 2 Binding pattern of VGPG to ACE
2.2 VGPG对ACE抑制率及酶促动力学分析结果
由图3A及表1可知,VGPG在不同质量浓度下的Lineweaver-Burk倒数图为近似相交于Y轴的一组直线,其中截距1/Vmax约为1.58 min/μg,Km随着VGPG质量浓度的增大而增大,表明其对ACE的抑制模式为竞争性抑制。
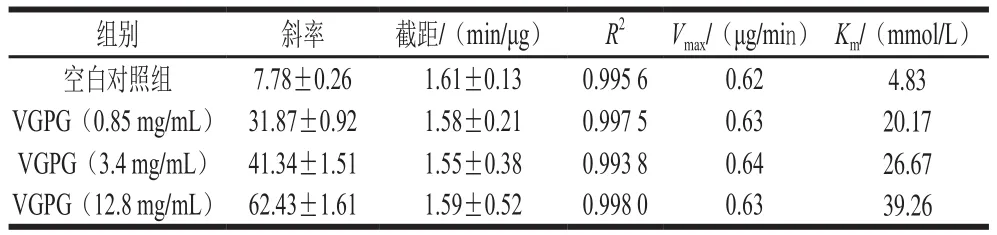
表1 VGPG对ACE抑制作用的Lineweaver-Burk曲线方程Table 1 Lineweaver-Burk curve equations of VGPG at different concentrations for ACE inhibition
由图3B VGPG对ACE体外抑制实验结果可知,不同纯度VGPG对ACE的抑制率具有明显差异。VGPG纯度70%、85%、98%的半抑制质量浓度分别为2.30、1.15、0.75 mg/mL,表明VGPG的纯度越高对ACE的抑制效果越好,两者呈正相关关系。此外,在相同纯度下,随着VGPG质量浓度的增加,其对ACE的抑制率呈现先上升后下降的趋势,且当VGPG纯度为98%、质量浓度为3.4 mg/mL时抑制率最大,达到77.4%,与Nawaz等[21]所制备的酶解豌豆肽研究结果相似。这是由于当VGPG质量浓度较低时,随着浓度升高,VGPG竞争结合ACE活性位点能力提高,从而对ACE抑制效果显著提升;而当VGPG质量浓度较高时,由于ACE活性位点处结合的VGPG达到饱和,VGPG的竞争结合ACE活性位点能力降低,并且由于VGPG的结构中含有较多的氢键供体和受体,其在高质量浓度下会通过静电作用相互影响,从而表现出对ACE抑制效果增长缓慢甚至是下降现象。这与前文VGPG对ACE分子结合模式为竞争性抑制作用的结论一致。

图3 VGPG的酶促动力学(A)和不同纯度VGPG对ACE抑制率(B)Fig. 3 Enzymatic kinetics of VGPG (A) and inhibitory rates of ACE by VGPG of different purities (B)
2.3 VGPG对HTN大鼠血压和体质量的影响
如图4所示,在HTN模型建立期间,Z组大鼠血压维持在100~120 mm Hg之间,其余实验组大鼠的血压明显上升并维持在140 mm Hg以上,证明HTN模型建造成功。同时,Z组大鼠在持续灌胃期间血压稳定,表明实验室饲养环境对大鼠血压无明显影响。药物干预后,灌胃实验结束时C组大鼠血压明显降低,与治疗前相比血压降低了19.0%;VGPG各剂量组血压也有不同程度的下降,其中VGPG中剂量组下降程度最大,达到15.8%,低剂量组与高剂量组分别下降11.6%和9.3%。说明中剂量的VGPG降压效果最好,与图3B体外模拟抑制实验结果相印证,表明降压效果不是单纯地随着VGPG质量浓度的提高而提升,间接证明VGPG是通过竞争性抑制ACE活性的方式来降低血压。
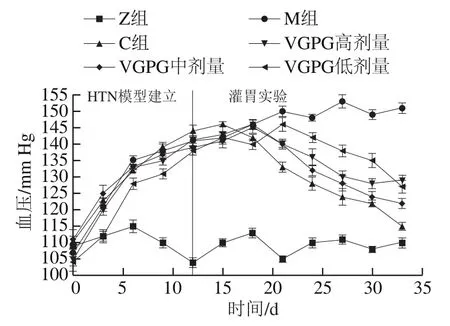
图4 VGPG对HTN大鼠血压的影响Fig. 4 Effect of VGPG on blood pressure of HTN rats
由图5可知,在整个持续灌胃期间M组大鼠体质量持续增加,并且显著高于Z组,C组与VGPG各剂量组同样显著上升,符合高盐高糖饮食所致HTN患者的生理特征[22],间接证明了实验建模成功。在给予非洛地平缓释片与VGPG后,与灌胃实验开始时相比,C组与VGPG各剂量组大鼠体质量在灌胃期间均呈现不同程度的下降,灌胃结束时下降幅度为VGPG中剂量组最高,达到10.3%;C组次之,达到5.4%。这与对应各组大鼠血压变化趋势相似,表明HTN对体质量具有一定的影响,且VGPG有助于缓解由于高盐高糖饮食所导致的肥胖,对降低血压具有积极作用。
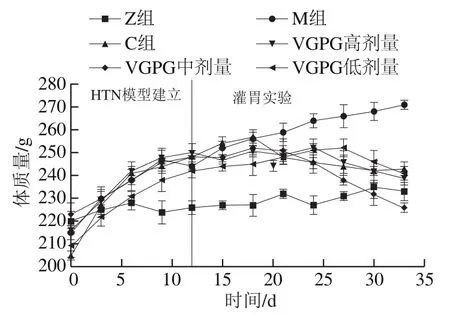
图5 VGPG对HTN大鼠体质量的影响Fig. 5 Effect of VGPG on body mass of HTN rats
2.4 VGPG对HTN大鼠血清ACE活力的影响
如图6所示,M组HTN大鼠血清中ACE活力最高,达到897 mU/mg,而Z组大鼠血清中ACE活力为511 mU/mg,两者之间具有显著差异(P<0.05),表明血清中ACE活力显著增加是诱发HTN的一个重要因素[23]。与Z组相比,C组大鼠血清中ACE活力无显著差异(P>0.05),同时VGPG各剂量组大鼠血清中ACE活力与Z、M组相比具有显著差异(P<0.05),其中VGPG中剂量组与正常大鼠ACE活力最为接近,证明通过抑制大鼠血清中ACE活力是VGPG降压的一条途径,且中剂量的VGPG抑制效果最好。
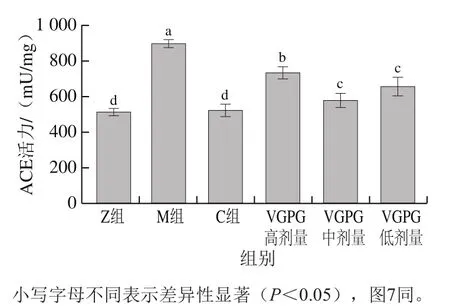
图6 VGPG对HTN大鼠血清ACE活力的影响Fig. 6 Effect of VGPG on ACE activity in serum of HTN rats
2.5 VGPG对HTN大鼠血清中血脂的影响
由表2可知,M组较Z组血脂中各项指标均发生不同程度的变化,6 项血脂浓度均低于Z组;C组大鼠血脂中HDL-C、LP(a)、LDL-C浓度与Z组之间无显著差异(P>0.05),TG浓度显著低于Z组而高于M组,TC、FFA浓度高于Z组(P<0.05),表明药物对血脂变化有积极作用,这与文献[24]报道一致;与Z组相比,VGPG中、低剂量组大鼠血脂中TG、FFA浓度具有显著差异(P<0.05),VGPG中剂量组大鼠血脂中其余成分与Z组相比无显著差异(P>0.05),其变化趋势与C组相似,表明VGPG与HTN药物对血脂成分的影响作用效果相似。值得注意的是,VGPG各剂量组中VGPG中剂量组的血脂各项指标浓度相较于其他两组与Z组更为接近,因此,中剂量的VGPG对大鼠HTN调节具有更好的效果,而且VGPG对于大鼠HTN的作用效果并不是单纯随着浓度的升高而增加,这与前文的研究结果相同。

表2 HTN大鼠血脂组成成分浓度Table 2 Blood lipid levels in HTN rats
2.6 VGPG对HTN大鼠脏器指数的影响
由表3可知,M组HTN大鼠的脾脏指数显著高于Z组(P<0.05),VGPG低、高剂量组脾脏指数与M组无显著差异,C组、VGPG中剂量组脾脏指数与Z组无显著差异(P>0.05);对肾脏指数而言,各组相对Z组均显著降低(P<0.05),但其中VGPG中剂量组肾脏指数与Z组最为接近。结果表明,HTN会对肾脏、脾脏器官产生一定的影响,而VGPG对此具有一定的治疗和调节作用,且中剂量的VGPG效果最好,与文献[25]报道一致。
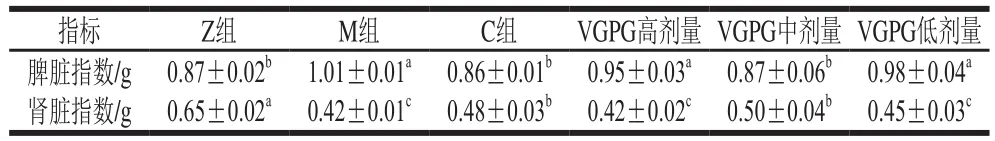
表3 VGPG对HTN大鼠脏器指数的影响Table 3 Effect of VGPG on spleen and kidney indices in HTN rats
2.7 VGPG对大鼠肠道菌群的影响
2.7.1α-多样性分析结果
对大鼠肠道菌群进行物种α-多样性分析,结果如图7所示。M组Sobs指数较Z组显著降低,表明由高盐高糖引发的HTN会降低肠道菌群的多样性,这与文献[26]研究结果一致;对大鼠给予非洛地平缓释片与VGPG治疗后,C组菌群丰富度有显著提升,说明药物对肠道菌群的多样性具有显著影响;VGPG低、中剂量组菌群丰富度显著高于M组,分别高出122.7%、51.1%,且菌群丰富度随着VGPG质量浓度的增加而呈现明显下降趋势,说明较低质量浓度的VGPG有利于菌群生长,但质量浓度太高则会选择性地导致某些肠道菌群减少或消失,且这种作用随VGPG质量浓度增加而增强。需要注意的是,尽管VGPG低剂量组粪便菌群丰富度最高,但VGPG中剂量组丰富度与Z组最为接近,表明中剂量的VGPG具有改善因HTN而造成的菌群丰富度与多样性下降的能力,从而使肠道菌群微环境维持在正常范围之内,进而起到降压的效果。
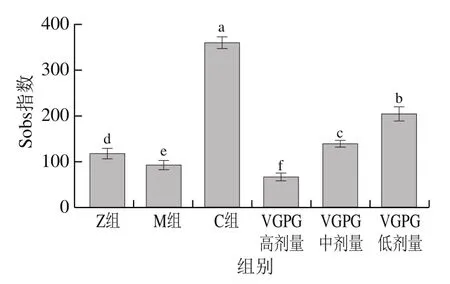
图7 大鼠肠道菌群Sobs指数Fig. 7 Sobs index of intestinal flora in rats
如图8A所示,Sobs稀释曲线趋于平缓,说明测序数据达到饱和,能够覆盖大鼠肠道微生物组群落的绝大部分物种。且Sobs指数中C组最高,之后依次为VGPG低剂量组、VGPG中剂量组、Z组,M组与VGPG高剂量组Sob指数均低于正常大鼠,VGPG中剂量组与Z组最接近,表明其与正常大鼠的菌群丰富度最相似。

图8 大鼠肠道菌群稀释曲线(A)和Shannon曲线(B)Fig. 8 Rarefaction curve (A) and Shannon (B) curves of intestinal flora in rats
Shannon指数能够反映菌群的多样性[27],由图8B可知,M组相较于Z组,多样指数明显降低,说明HTN会降低肠道菌群的多样性;C组与Z组相近,说明药物基本不会影响肠道菌群的多样性;VGPG低剂量组与中剂量组HTN大鼠肠道菌群的多样性与Z组接近,而高剂量组明显低于Z组。表明由高盐高糖所引发的HTN会明显改变生物肠道中菌群的丰富度与多样性,低、中剂量的VGPG对HTN患者肠道菌群有一定的改善作用。
2.7.2 门水平上大鼠肠道菌群群落分析结果
目前已有研究表明厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)之比(F/B)可以反映肠道菌群紊乱程度[8]。由图9可知,Z组、M组、C组、VGPG高剂量组、VGPG中剂量组、VGPG低剂量组F/B分别为3.27、0.65、5.89、4.54、4.88、6.24。M组肠道菌群的紊乱程度最低,而VGPG低剂量组最高。其原因可能是由于通过高糖高盐饮食所引发的HTN会使肠道中菌群的丰富度降低,从而使HTN大鼠肠道菌群的紊乱程度相对降低,同时也表明药物会增加肠道菌群的紊乱程度,对其造成不良影响。结合Heatmap图(图10)进行样本聚类分析,在门水平上大鼠肠道各菌群分布M组与Z组差别最大,VGPG剂量组中1组与Z组最为接近,证明VGPG对HTN大鼠肠道菌群具有改善效果。

图9 门水平大鼠肠道菌群群落分析Fig. 9 Intestinal flora community analysis of rats at the phylum level

图10 门水平大鼠肠道菌群Heatmap图Fig. 10 Heatmap of the intestinal flora of rats at the phylum level
2.7.3 科水平上大鼠肠道菌群群落分析结果
如图11、12所示,在科水平上,与Z组相比,M组中产短链脂肪酸菌科(Prevotellaceae)所占比例明显上升,产乙酸、丁酸等菌科(Lachnospiraceae)所占比例明显下降,存在肠道菌群失衡现象。表明HTN大鼠肠道菌群中产短链脂肪酸细菌数量增加,而产乙酸、丁酸细菌数量减少,这与文献[8]的研究结果相同。肠道菌群与血脂成分分析结果表明,肠道微生物影响血压的机制之一可能是通过其分泌物(如短链脂肪酸等)影响大鼠血脂成分,进而对血压产生一定的影响,这与Felizardo等[28]的研究结果一致。使用非洛地平缓释片和VGPG干预后,C组与VGPG各剂量组Prevotellaceae与Lachnospiraceae占比接近正常大鼠,但C组中螺旋体科(Spirochaetaceae)比例上升,其所属菌属(如密螺旋体属、疏螺旋体属以及钩端螺旋体属等)均具有较强的致病性,并且已有多项研究表明,Spirochaetaceae会导致疾病的发生和传播[29-30]。本实验中C组的Spirochaetaceae比例上升,尽管未表现出明显的疾病症状,但仍增加了大鼠患病的潜在风险;VGPG各剂量组中Lactobacillaceae比例明显上升,此菌类与糖类物质代谢分解有关,其所属绝大多数菌属(如乳酸菌、植物乳杆菌等)均具有较强的分解糖类物质的能力,可以将葡萄糖、果糖等物质分解为乳酸,属益生菌[31]。因此,VGPG各剂量组中Lactobacillaceae比例明显上升,使得大鼠肠道对诱发HTN病因之一——果糖的分解能力大大提高,从而对缓解、治疗HTN疾病产生良好的作用。大鼠肠道菌群分析结果表明,对照组药物可能在治疗HTN的过程中对肠道菌群产生一定的副作用,而VGPG对菌群无明显副作用,并且对改善肠道菌群具有积极作用。

图11 科水平大鼠肠道菌群群落分析Fig. 11 Intestinal flora community analysis of rats at the family level

图12 科水平大鼠肠道菌群Heatmap图Fig. 12 Heatmap of the intestinal flora of rats at the family level
3 结 论
本研究表明VGPG对HTN疾病具有显著的治疗效果,在21 d的HTN大鼠灌胃干预实验中,纯度为98%、质量浓度为25 mg/mL的VGPG具有最好的降压效果,并且VGPG还可缓解由HTN所引起的肥胖;与常规降压药物相比,VGPG对肾脏、脾脏器官以及肠胃微生态环境无明显副作用。VGPG在体内存在两种降压机制:1)通过与ACE活性位点相结合,对其活性产生竞争性抑制从而达到降压的作用;2)通过调节肠道微环境,使菌群丰富度和多样性维持在正常范围以内,同时提高菌群对糖类物质的分解能力,减少因肠道微生物紊乱而对大鼠血压造成的不良影响。这两种调节方式之间是否存在关系还有待进一步研究。综上所述,本研究从分子对接、体外、体内3 个层面,探索性地研究了VGPG对大鼠HTN的抑制效果和机制,揭示肠道菌群、ACE活性与HTN的关系,结果表明VGPG可被用作治疗HTN的功能性因子,可用于相关功能性食品的制备。
