金雀异黄酮通过调控Ca2+-CaMKIV通路对Aβ25-35诱导海马神经元损伤的保护作用
2021-07-29高华武汪光云
高华武,王 艳,周 鹏,叶 树,宋 航,汪光云,蔡 标,*
(1.安徽中医药大学中西医结合学院,安徽 合肥 230012;2.安徽省中医药科学院中西医结合研究所,中药复方安徽省重点实验室,安徽 合肥 230012)
阿尔茨海默病(Alzheimer’s disease,AD)是一种与年龄相关的慢性、神经退行性疾病,伴随着记忆缺失和认知功能障碍,并最终会导致患者死亡。AD是诱发进行性痴呆的主要病因之一,据估计,目前中国有1 000万AD患者,美国有580万AD患者,到21世纪中叶,全球痴呆患者将达到1.52亿,其中约60%~70%为AD患者[1-2]。AD的发病机制复杂,至今临床上常用的抗AD药物效果不理想,从天然产物及其衍生物中研制抗AD的新型药物已成为研发的重要方向,并且众多研究结果证实天然产物及其衍生物在改善AD进程方面具有很好的疗效[3-4]。
金雀异黄酮(genistein,GS),化学名称为4’,5,7-三羟异黄酮,是大豆异黄酮的主要成分,约占大豆中总异黄酮的60%[5],广泛存在于大豆、玉米、大麦、小麦、黑麦等各种可食用的植物中,在大豆中最为丰富[6]。金雀异黄酮在化学结构上类似于17-β-雌二醇,有研究用金雀异黄酮模拟雌激素与其受体结合,发现其可在靶器官中发挥雌激素作用,但没有雌激素的不良反应[6-8],对更年期症状和更年期相关疾病,如骨质疏松症、肥胖症、糖尿病、焦虑症、抑郁症和乳腺癌等[5,9-10]有很好的疗效。在AD防治方面,金雀异黄酮可以缩短AD模型动物逃避潜伏期和降低错误次数,改善学习记忆能力,改善大脑功能[11-12],其机制可能与减少β淀粉样蛋白(beta amyloid peptide,Aβ)沉积、抑制细胞凋亡、减少氧化应激和神经炎症、诱导自噬等途径等有关[13-15],但是金雀异黄酮的作用机制仍然有待进一步研究。
研究表明,Ca2+-钙调蛋白依赖性蛋白激酶IV(calmodulin-dependent protein kinase IV,CaMKIV)信号通路在AD的发病中起着重要的作用。Aβ在神经元细胞中的沉积导致Ca2+浓度增加,超载的Ca2+和钙调蛋白(calmodulin,CaM)的结合激活了钙-钙调素复合物(Ca2+/CaM)的活性。进入细胞核后,Ca2+/CaM激活钙/钙调蛋白依赖性蛋白激酶激酶(calcium/calmodulin dependent protein kinase kinase,CaMKK)及其底物CaMKIV促使环磷酸腺苷(cyclic adenosine monophosphate,cAMP)反应元件结合蛋白(cAMP response element binding protein,CREB)激酶磷酸化,进而磷酸化Tau,过度磷酸化的Tau蛋白是异常神经原纤维缠结(neurofibrillary tangles,NFTs)的主要组成部分,是AD临床表达的重要因素。因此,通过CaM-CaMKIV信号通路抑制Tau蛋白过磷酸化是预防和治疗AD的重要方法[16-17]。本实验用Aβ25-35诱导海马神经元损伤建立AD细胞模型,以抑制Ca2+超载和介导Ca2+-CaMKIV信号通路为切入点,观察金雀异黄酮对海马神经元损伤的保护作用,探讨金雀异黄酮对海马神经元保护的作用机制。
1 材料与方法
1.1 材料与试剂
SPF级24 h内新生SD乳鼠(生产许可证号:SCXK(皖)2017-001),雌雄各半,购自安徽省动物实验中心。动物饲养于安徽省中医药科学院中西医结合研究所,控制室温18~25 ℃、相对湿度40%~70%。实验过程中对动物的处置已通过安徽中医药大学动物伦理委员会批准。
金雀异黄酮(纯度≥98%,批号:C1431028) 上海Aladdin公司;戊酸雌二醇(estradiol valerate,EV)片(批号:185A) 法国DELPHARM Lille S.A.S公司;Aβ25-35(批号:095M4775V) 美国Sigma公司;Hoechst 33258 上海百豪生物科技有限公司;抗MAP-2的小鼠抗体(1∶200)、Cy3标记的山羊抗小鼠免疫球蛋白(immunoglobulins,Ig)G抗体(1∶200) 北京Bioss公司;Hoechst 33258(5 µg/mL) 上海Beyotime公司;CaM、CaMKK抗体 英国Abcam公司;CaMKIV、tau抗体 美国Cell Signaling technology公司。
1.2 仪器与设备
BD C6流式细胞仪 美国Becton Dickinson公司;FluorChem M凝胶成像系统 美国ProteinSimple公司;042BR12088电泳仪 美国Bio-Rad公司;IX81倒置荧光显微镜 日本Olympus公司;AE2000倒置显微镜 厦门Motic公司;多功能酶标仪 上海沛欧分析仪器有限公司。
1.3 方法
1.3.1 海马神经元的原代培养
取新生SD乳鼠,体积分数75%乙醇溶液中浸泡20 s消毒后颈椎脱臼处死,剥离海马组织,用0.125%(体积分数,下同)胰酶消化20 min,加入含10%胎牛血清的DMEM/F12培养液终止消化,反复吹打形成细胞悬液,200 目筛过滤后,1 500 r/min离心5 min,弃去上清液,在沉淀中加入含20%胎牛血清的DMEM/F12培养基,吹打均匀后,调整细胞密度至1×106cells/mL,然后接种至由多聚赖氨酸覆盖的细胞板中,放入37 ℃、5% CO2培养箱培养。培养基在24 h后更换为神经元培养液(100 mL neurobasal-A+2 mL B27+252 μL 0.2 mol/LL-谷氨酰胺),之后每隔3 d换1/2体积培养液。在培养期间,使用倒置显微镜观察细胞形态学变化。
1.3.2 神经元的免疫荧光法鉴定
细胞爬片用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L pH 7.4,下同)浸洗2 次,加入4%质量分数多聚甲醛固定30 min,PBS浸洗3 次,每次5 min。加3%山羊血清温育30 min阻断非特异性反应性,加入兔抗MAP-2(1∶200),并放入湿盒,在4 ℃孵育过夜。PBS洗涤3 次后,加Cy3标记山羊抗小鼠IgG(1∶200),湿盒中37 ℃孵育1 h,PBS洗涤3 次,加入Hoechst 33258染色液,染色10 min,用PBS洗涤3 次。利用抗猝灭封片液封片,随后在倒置荧光显微镜下观察拍照。
1.3.3 实验分组、造模和干预
根据本课题组海马神经元损伤模型方法[18]及预实验结果,乳鼠原代海马神经元细胞按1×106cells/mL浓度加入96 孔板中,按照实验设计将细胞分为4 组:空白对照组、模型组、GS组和阳性对照EV组,除空白对照组外,其他组神经元加入含有Aβ25-35的培养基(30 μmol/L)孵育24 h,建立海马神经元损伤模型;在造模前,GS和EV组分别用50 μmol/L金雀异黄酮和10 μmol/L EV预处理3 h,空白对照组加入新鲜神经元培养液100 μL。
1.3.4 指标测定
1.3.4.1 MTT法检测海马神经元存活率
神经元经过造模和干预后,于培养箱内孵育24 h,弃去培养液,加PBS润洗2 遍,每孔加入20 μL 5 mg/mL的四甲基偶氮唑蓝(methylthiazolyl tetrazolium,MTT),孵育4 h后弃去培养液,加入150 μL二甲基亚砜,低速振荡10 min,用酶标仪在490 nm波长处检测每孔OD值。实验重复3 次。按下式计算神经元存活率。
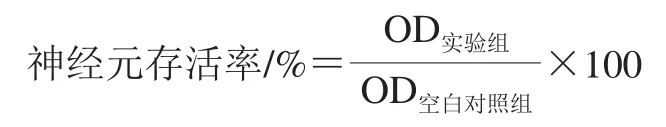
1.3.4.2 荧光探针检测海马神经元Ca2+荧光强度
荧光探针fluo-3 AM用无Ca2+细胞外液(135 mmol/L NaCl、2 mmol/L KCl、2 mmol/L MgCl2、10 mmol/L羟乙基哌嗪乙硫磺酸、4 g/L葡萄糖)稀释成工作浓度5 μmol/L。神经元经过造模和干预后,孵育24 h,每孔加入1 mmol/L fluo-3 AM 5 μL,37 ℃孵育30 min,PBS洗涤3 次,流式细胞仪检测细胞内Ca2+荧光强度(以发出荧光细胞的比例计)。
1.3.4.3 Western blot测定海马神经元相关蛋白的表达
神经元经过造模和干预后,孵育24 h,弃上清液,收集细胞,提取细胞总蛋白,BCA法检测总蛋白质量浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,湿法转膜,5%脱脂奶粉封闭2 h,加入一抗(CaM、CAMKK(1∶1 000)、p-CAMKIV(1∶800)、p-Tau(1∶600)),4 ℃过夜,Tris-HCl缓冲液(含1% Tween 20)洗涤3 次,加入山羊抗兔IgG(1∶20 000),室温下孵育1.5 h,TBST洗涤3 次。使用电化学发光剂,凝胶成像仪拍照和半定量分析。实验重复3 次。以β-actin作为内参。
1.4 数据统计与处理
选用SPSS 24.0软件进行数据统计分析,结果以平均值±标准差表示。多组间比较采用单因素方差分析,组内两两比较,方差齐采用最小显著性差异(least significance difference,LSD)法,方差不齐采用Dunnett’s检验,P<0.01表示差异极显著。
2 结果与分析
2.1 原代海马神经元的鉴定结果
免疫荧光法鉴定海马神经元。微管相关蛋白-2(microtubule-associated protein,MAP-2)是一种神经系统的细胞骨架蛋白,在成熟和未成熟的神经元中都有表达,主要在树突和细胞体中。MAP-2可以用来识别神经元。海马神经元培养7 d后,置于倒置荧光显微镜下观察,图1A红色荧光为MAP-2,图1B显示蓝色荧光是被Hoechst 33258标记的细胞核,图1C为图1A和图1B的叠加效果。检测结果表明MAP-2蛋白阳性表达率为90%以上,海马神经元细胞分离成功。

图1 原代海马神经元的鉴定结果Fig. 1 Identification of primary hippocampal neurons
2.2 金雀异黄酮对神经元损伤模型中神经元存活率的影响
MTT法检测各组神经元存活率,结果见图2。神经元经Aβ25-35处理后,模型组神经元存活率为50.4%,与空白对照组相比极显著降低(P<0.01),表明造模成功;GS组、阳性对照EV组神经元存活率分别为92.4%、73.1%,与模型组相比神经元存活率极显著提高(P<0.01)。
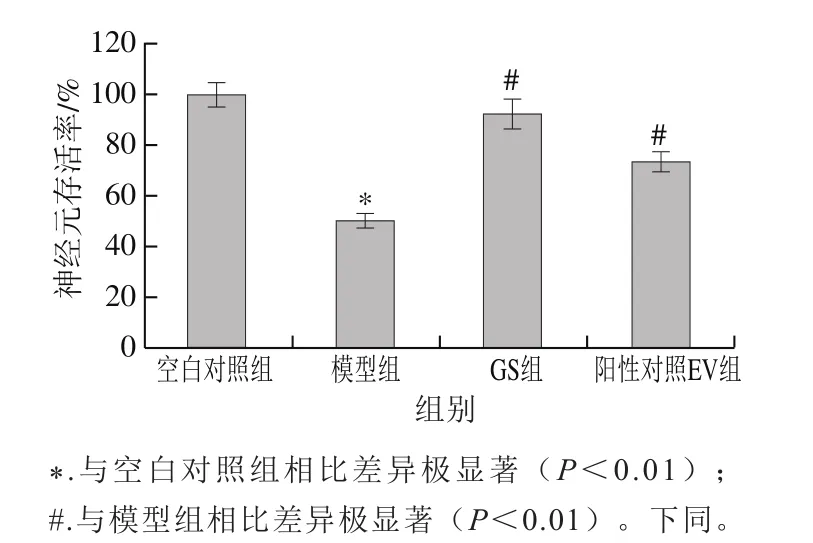
图2 金雀异黄酮对神经元损伤模型中神经元存活率的影响Fig. 2 Effect of genistein on neuron survival rate in neuron injury model
2.3 金雀异黄酮对神经元损伤模型中细胞Ca2+荧光强度的影响
荧光探针技术检测细胞内Ca2+荧光强度。图3结果显示,与空白对照组比较,模型组神经元的Ca2+绿色荧光强度极显著提高(P<0.01);与模型组相比,GS组神经元Ca2+绿色荧光强度极显著降低(P<0.01),阳性对照EV组神经元Ca2+绿色荧光强度有一定程度降低,但差异无统计学意义。

图3 金雀异黄酮对神经元损伤模型中细胞Ca2+荧光强度的影响Fig. 3 Effect of genistein on intracellular Ca2+ fluorescence intensity in neuron injury model
2.4 金雀异黄酮对神经元损伤模型中细胞CaM、CaMKK、p-CaMKIV蛋白表达的影响
Western blot法检测得到的Ca2+-CaMKIV通路相关蛋白表达结果见图4。与空白对照组比较,模型组神经元CaM、CaMKK、p-CaMKIV蛋白表达极显著升高;与模型组比较,GS和阳性对照EV组CaM、CaMKK、p-CaMKIV蛋白表达极显著降低(P<0.01)。
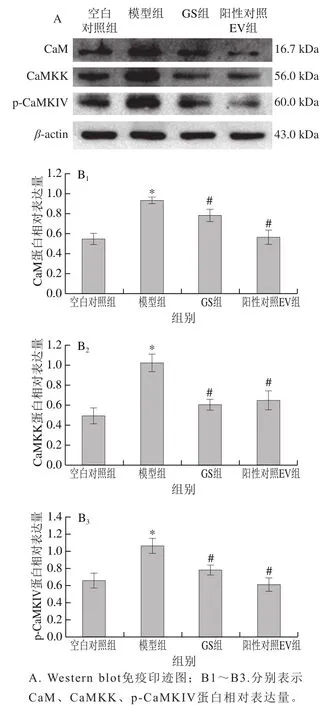
图4 金雀异黄酮对神经元损伤模型中细胞相关蛋白表达的影响Fig. 4 Effect of genistein on the expression of cell-related proteins in neuronal injury model
2.5 金雀异黄酮对神经元损伤模型中p-Tau蛋白表达的影响
Western blot法检测p-Tau蛋白的表达结果见图5。与空白对照组比较,模型组神经元p-Tau蛋白相对表达量极显著升高(P<0.01);与模型组比较,GS和EV组p-Tau蛋白相对表达量极显著降低(P<0.01)。

图5 金雀异黄酮对神经元损伤模型中细胞p-Tau蛋白表达的影响Fig. 5 Effect of genistein on the expression of p-Tau protein in neuronal injury model
3 讨 论
AD是一种神经系统退行性疾病,海马神经元的正常结构和功能受损是AD的一个重要病理基础[19]。海马区Aβ沉积是老年斑形成的关键因素,老年斑引起细胞内钙离子超载和产生大量自由基,进而促进了Tau蛋白过度磷酸化和NFTs,导致海马神经元和神经突触丢失等病理改变[20-21]。金雀异黄酮是一种植物激素,富含于大豆类营养食品,近年来受到广泛关注,具有改善更年期症状、预防骨质疏松、降低乳腺癌发病率等功效,在AD防治方面具有潜力。前期研究发现,金雀异黄酮可能通过下调半胱氨酸蛋白酶-3、Bcl-2相关X蛋白和细胞色素c表达,抑制线粒体凋亡,发挥神经保护作用[22];可能通过抑制蛋白激酶C通路,减少氧化应激,降低细胞内Ca2+水平,减少Aβ25-35对PC12细胞的神经毒性[23]。Aβ25-35为阿尔茨海默氏淀粉样蛋白β肽链位于第25~35个氨基酸位点的基因片段,是引起神经毒性的主要活性部位,是目前研究体外复制神经元损伤模型的常用方法之一[24-25]。本实验经免疫荧光鉴定结果表明,大鼠海马神经元培养成功。Aβ25-35作用于大鼠原代海马神经元24 h后经MTT检测,结果显示Aβ25-35诱导的海马神经元存活率极显著降低,神经元损伤模型成功建立;预先给予金雀异黄酮干预后,可减轻Aβ25-35所致神经元损伤,提高神经细胞存活率,提示金雀异黄酮对Aβ25-35诱导的海马神经元损伤模型具有很好的神经保护作用。
Ca2+是体内最重要的元素之一,Ca2+稳态对于维持神经细胞的正常生理功能具有重要意义。Ca2+超载出现在AD病程进展中甚至是AD病理改变早期[26],Aβ的沉积和Tau蛋白磷酸化会引起细胞质和细胞核Ca2+超载,进而激活一系列Ca2+依赖性信号级联反应。本实验发现,Aβ25-35诱导的海马神经元损伤模型Ca2+荧光强度极显著升高,金雀异黄酮预处理可极显著降低神经元Ca2+荧光强度,其可能原因是金雀异黄酮抑制了细胞膜上电压依赖的Ca2+通道,Ca2+内流减少[27],也可能是金雀异黄酮增强了Ca2+诱导的Ca2+-突触结合蛋白等途径的胞吐作用[28-29],从而改善Ca2+超载现象。
Ca2+-CaMKIV信号通路在神经元传递、突出可塑性、神经细胞分化、认知功能等方面具有重要作用[30-31]。Ca2+-CaMKIV信号通路涉及Ca2+、CaM、CaMKK和CaMKIV。神经细胞过多的Ca2+与CaM结合形成Ca2+-CaM复合物,进而激活下游底物CaMKK,引起CaMKIV的磷酸化。磷酸化的CaMKIV一方面促进钙依耐性突触蛋白的磷酸化,导致突触间囊泡运输受阻,影响了新的突触形成,损害了突触功能;另一方面,CaMKIV过度磷酸化促使Tau蛋白Thr181、Thr231、Ser396等多个位点激活,促进Tau蛋白发生磷酸化。过度磷酸化的Tau蛋白由于不能与微管结合,容易引起自身聚集,进而形成双股螺旋纤维,最终形成NFTs,导致神经元的死亡[16-17,32-33]。本实验发现,Aβ25-35诱导的海马神经元损伤模型CaM、CaMKK、p-CaMKIV以及p-Tau蛋白的表达均极显著升高,而金雀异黄酮预处理可明显减轻Aβ25-35诱导的海马神经元损伤,降低损伤神经元CaM、CaMKK、p-CaMKIV以及p-Tau蛋白的表达,提示金雀异黄酮可以下调Ca2+-CaMKIV信号通路,减少Tau蛋白磷酸化。
综上所述,金雀异黄酮可以减轻Aβ25-35对大鼠海马神经元的损伤,其机制可能与减少Ca2+超载、抑制Ca2+-CaMKIV信号通路、减少tau蛋白磷酸化有关,但其作用机制仍需进一步深入研究,以为未来植物激素防治AD研究提供选择。
