FCRL5蛋白对肝癌细胞增殖与侵袭迁移能力的作用及机制
2021-07-27孙建海马燕凌魏武杰晏菲方红艳瞿姣
孙建海 马燕凌 魏武杰 晏菲 方红艳 瞿姣
(江汉大学附属湖北省第三人民医院肿瘤科,湖北 武汉 430033)
肝癌是源于肝细胞和肝内胆管上皮细胞的恶性肿瘤〔1〕,是全球最常见的恶性肿瘤,在我国排名恶性肿瘤第二,仅次于肺癌〔2,3〕。我国每年新增约40万肝癌患者,略高于发达国家(1%~2%),其中女性年发病率为6.5%,男性年发病率为7.9%〔4,5〕。Fc受体样5(FCRL5)基因含有长的高度酸性C末端尾,以非序列特异性方式介导DNA结合,调控结肠癌、胃癌、肺癌和肝癌等多种人类癌症的进展,与癌细胞存活、自噬、侵袭转移密切相关〔6,7〕。FCRL5可通过激活蛋白激酶 B信号通路诱导肿瘤内皮细胞增殖和集落形成〔8〕。基质金属蛋白酶(MMP)-9、cyclinD1、血管内皮生长因子(VEGF)是参与肿瘤增殖的重要细胞因子,MMP-9、VEGF与肿瘤的转移密切相关,G1/S-特异性周期蛋白(cyclin)D1是调节肿瘤细胞周期的重要因子〔9〕。目前尚无关于FCRL5与肝癌细胞增殖与侵袭迁移机制的相关研究。因此本研究拟探讨FCRL5蛋白对肝癌细胞增殖与侵袭迁移能力的作用及机制,为肝癌的临床治疗提供理论和实践依据。
1 资料与方法
1.1临床资料 选取江汉大学附属湖北省第三人民医院肝胆外科2010~2013年确诊的年龄≥60岁的肝细胞癌患者104例作为研究对象,患者均符合原发性肝癌诊疗规范(2011年版)中诊断标准〔10〕,患者自愿提供肝癌及癌旁组织标本用作分析。本研究经医院医学伦理协会批准,并获取患者及家属知情同意书。收集每例患者的癌组织及癌旁组织(距离癌灶5 m以上)标本。
1.2肝癌组织及癌旁正常组织FCRL5表达水平测定 肝癌组织取肿瘤病灶边缘约2 cm处,癌旁正常组织为距离癌灶5 m以上。取0.2 g肝癌组织及癌旁正常组织,制成肝癌组织及癌旁组织匀浆后,酶联免疫吸附试验(ELISA)检测FCRL5表达量。
Western印迹检测FCRL5表达量:用含有PMSF的裂解缓冲液(Beyotime)裂解肝癌组织及癌旁正常组织。将裂解物在15 000 r/min,4℃下离心10 min,收集上清液并保存在-80℃下以备后用。使用二喹啉甲酸(BCA)蛋白质测定试剂盒(Beyotime)测定蛋白质浓度。对蛋白质进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并根据制造商的方案(Bio-Rad,Richmond,CA,USA)使用转移装置转移至聚偏氟乙烯(PVDF)膜(Millipore)。用含有0.1%Tween-20的TBST缓冲液(10 mmol/L Tris-HCl,pH8.0和150 mmol/L NaCl)中的脱脂奶粉封闭膜,在相同缓冲液中洗涤并用以下抗体探测:抗-FCRL5(Abcam)和抗β-肌动蛋白抗体(Cell Signaling Technology)在4℃过夜。然后将膜在TBST缓冲液中洗涤并与各自的第二抗体一起温育。使用Odyssey红外成像系统(Li-Cor Bioscience)获得红外荧光图像,进行半定量比较分析。
免疫组化方法测定FCRL5的表达水平,进行标准抗生物素蛋白-生物素复合物过氧化物酶免疫组织化学染色。在二甲苯和梯度醇脱蜡后,通过水浴釜加热30 min,在柠檬酸盐缓冲液(10 mmol/L pH6.0)中进行加热的抗原修复。内源性过氧化物酶在0.3%过氧化氢中封闭10 min。通过在10%正常动物血清中孵育10 min来阻断非特异性结合。将切片在4℃下与一抗孵育24 h,所述一抗为抗FCRL5的多克隆抗体(HPA021030,Sigma-Aldrich)。将生物素化的第二抗体(IgG)和辣根过氧化物酶标记的抗生物素蛋白与样品一起温育。使用二氨基联苯胺(DAB)显色。
1.3细胞来源、仪器与试剂 SMMC-7721肝癌细胞株(中国科学院典型培养物保藏中心昆明细胞库)、FCRL5-模拟物(mimics)、FCRL5抑制剂(inhibitor)(上海伯豪生物技术有限公司)、Trizol试剂(美国Invitrogen公司)、FCRL5转录子第一链cDNA合成试剂盒(美国Thermo公司)、逆转录试剂盒及实时荧光定量PCR试剂盒(碧云天生物技术公司产品)、实时荧光定量PCR仪(美国热电公司)、NanoDrop2000c 型蛋白核酸检测仪(美国Thermo公司)、BD BiocoatTMMatrigelTM基质(上海伟进生物科技有限公司)、聚碳酸脂微孔滤膜(上海正晃商贸有限公司)、FCRL5、MMP-9、cyclinD1、VEGF蛋白ELISA试剂盒(上海伯豪生物技术有限公司)、MK3酶标仪(美国 Thermo公司)。
1.4分组设计及转染 分组设计:对照组:取10 ml人肝癌SMMC-7721细胞液(细胞浓度为5×106/ml)于10%胎牛血清的DMEM培养液中,置于CO2培养箱(37℃、5% CO2、20% O2);FCRL5转染组、FCRL15 inhibitor组:分别取10 ml转染FCRL5-mimics、FCRL5 inhibitor的人肝癌HCCLM3细胞液(细胞浓度为5×106/ml)于10%胎牛血清的DMEM培养液中,置于CO2培养箱(37℃、5% CO2、2% O2、93%N2)。以上各组每孔设6个平行样,培养120 h。
人肝癌SMMC-7721细胞株FCRL5-mimicss、FCRL5 inhibitor:转染:取11 ml人肝癌SMMC-7721细胞液(细胞浓度为5×106/ml)接种于6孔板,取 100 pmol的FCRL5-mimics、FCRL5 inhibitor于200 μl DMEM培养基中,取4 μl lipofectamine2000于200 μl DMEM培养基中,混匀lipofectamine2000和miRNA液,室温培育30 min,无菌磷酸盐缓冲液(PBS)洗涤细胞,将混合液加入细胞孔内,6 h 后弃混合液,加入胎牛血清的DMEM培养基培养,流式细胞仪检测在转染后48 h,测试了不同组中荧光素酶的相对活性,监测其转染效情况。
1.5人肝癌SMMC-7721细胞株细胞活力、癌细胞单克隆形成数目、细胞凋亡检测 分别于24 h、72 h、120 h,每孔加入MTT溶液(5 mg/ml)10 μl,37℃恒温箱孵育4 h,加入150 μl的二甲基亚砜(DMSO),采用酶标仪于490 nm处波长测定吸光度(A)值。转染24 h后,将细胞用胰蛋白酶处理,计数,并在密度为1 000个细胞/孔的6孔板中用完全培养基重新接种8 d。每3 d更换培养基以维持细胞生长。将菌落固定并用0.5%结晶紫(Sigma,St Louis,MO,USA)在室温下染色30 min。培养8 d后,在倒置显微镜下计数菌落数。流式细胞术Annexin V-异硫氰酸荧光素(FITC)结合测定(R&D,Minneapolis,MN,USA,Cat No TA4638)用于测定转染后SMMC-7721细胞中的细胞凋亡。
1.6人肝癌SMMC-7721细胞株FCRL5 mRNA水平测定 人肝癌SMMC-7721细胞培养结束后。取5 ml细胞液,测定FCRL5 mRNA 浓度,用miRNeasy Mini Kit(Qiagen,Hilden,Germany)从培养的SMCC-7721细胞中提取和分离总RNA。用iScripTMcDNA合成试剂盒(Bio-Rad)合成DNA。为了评估FCRL5水平,在CFX96TM实时PCR检测系统(Bio-Rad Laboratories,Inc)中用SYBR Premix Ex TaqTM(Takara Bio,Inc.,Otsu,Japan)扩增cDNA。条件如下:在95℃(5 min)变性,然后在95℃(10 s)变性40个循环,在60℃(30 s)退火/延伸。通过2-ΔΔCt方法计算FCRL5的相对含量。U6用作内部对照。引物如下:FCRL5:正向:GTGCAAGTG TAGATGCCGACAA,反向:GTGCAAGTGTAGATGCCGACAA;U6:正向:CTCGCTTCGGCAGCACA,反向:AACGCTTCACGAA-TTTGCGT。
1.7细胞侵袭迁移实验 转染24 h后,将无血清培养基中的细胞接种到Transwell装置(BD Biosciences)的上室中。用于Matrigel(Sigma-Aldrich,St.Louis,MO,USA)的侵袭测定。下室充满含有10%FBS的培养基。在37℃,5%CO2中培养24 h后,通过膜侵入的细胞用4%多聚甲醛固定,并用0.1%结晶紫染色(Sigma-Aldrich公司)。拍摄下表面上的细胞(Olympus;IX73),并使用共聚焦激光扫描显微镜(Olympus FV1000)计数3个随机视野。进行了6次独立实验。
伤口愈合测定用于检测细胞迁移能力。在转染FCRL5-mimics、FCRL5 inhibitor后24 h,将HepG2细胞以每孔8×105个细胞接种到6孔板中。达到90%汇合后,用20 μl移液管刮擦每个孔的表面。用PBS洗涤孔3次后,在37℃下进一步培养24 h,然后捕获图像。
1.8人肝癌SMMC-7721细胞株FCRL5、MMP-9、cyclinD1、VEGF蛋白水平测定 染毒结束后,5 000 r/min 离心收集各组细胞,制成细胞悬液后,ELISA法测定培养液中FCRL5、MMP-9、cyclinD1、VEGF蛋白水平。
1.9统计分析 采用SPSS19.0软件进行单因素方差分析、t检验、LSD-t检验、χ2检验。
2 结 果
2.1癌旁组织、肝癌组织中FCRL5蛋白水平及半定量水平的表达 肝癌组织FCRL5蛋白表达水平高于癌旁组织(P<0.001)。肝癌组织FCRL5蛋白半定量水平高于癌旁组织(P<0.001)。见表1,图1。

表1 肝癌组织与癌旁组织中FCRL5 蛋白的表达

1、3、5、7分别为4例癌旁组织2、4、6、8分别为4例肝癌组织图1 FCRL5蛋白Western印迹结果
2.2癌旁组织、肝癌组织中FCRL5蛋白表达 肝癌组织中FCRL5蛋白位于胞质,呈黄褐色;肝癌组织FCRL5蛋白阳性率高于癌旁组织〔82例(78.85%)vs 9例(8.65%);χ2=104.107,P=0.000〕。见图2。

图2 FCRL5蛋白在癌旁组织、肝癌组中的表达(DAB,×200)
2.3各组SMMC-7721肝癌细胞存活率比较 FCRL5转染组24 h、72 h、96 h、120 h存活率高于对照组(P<0.001)。FCRL5 inhibitor 组24 h、72 h、96 h、120 h存活率低于对照组和FCRL5转染组(P<0.001)。见表2。
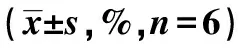
表2 各组培养不同时间SMMC-7721肝癌细胞存活率比较
2.4各组SMMC-7721肝癌细胞单克隆形成数目比较 FCRL5转染组的单克隆形成数目显著高于对照组(P<0.001);FCRL5 inhibitor组单克隆形成数目显著低于对照组和FCRL5转染组(P<0.001)。见表3、图3。
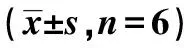
表3 各组SMMC-7721肝癌细胞单克隆形成数目、 凋亡率比较

图3 各组 SMMC-7721 细胞单克隆形成数目(结晶紫染色,×200)
2.5各组SMMC-7721肝癌细胞凋亡率的比较 FCRL5转染组凋亡率显著低于对照组(t=14.036,P<0.001);FCRL5 inhibitor 组凋亡率显著高于对照组和FCRL5转染组(P<0.001)。见表3、图4。

图4 各组 SMMC-7721 细胞凋亡率的表达
2.6各组SMMC-7721肝癌细胞FCRL mRNA、FCRL蛋白表达情况比较 FCRL5转染组FCRL mRNA、FCRL蛋白表达显著高于对照组(P<0.001)。FCRL5 inhibitor组FCRL5 mRNA、FCRL5蛋白表达水平显著低于对照组和FCRL5转染组(P<0.001)。见表4。
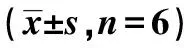
表4 各组SMMC-7721肝癌细胞增FCRL5 mRNA、 FCRL5 蛋白表达情况比较
2.7各组SMMC-7721肝癌细胞侵袭能力比较 FCRL5转染组侵袭距离显著长于对照组(P<0.001)。FCRL5 inhibitor 组侵袭距离显著短于对照组和FCRL5转染组(P<0.001)。见表5和图5。
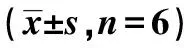
表5 各组SMMC-7721肝癌细胞侵袭迁移能力、穿膜数及MMP-9、cyclinD1、VEGF表达比较

图5 各组 SMMC-7721 细胞伤口愈合分析实验(结晶紫染色,×200)
2.8各组SMMC-7721肝癌细胞穿膜数比较 FCRL5转染组的穿膜数显著高于对照组(P<0.001)。FCRL5 inhibitor 组穿膜数显著低于对照组和FCRL5转染组(P<0.001)。见表5、图6。

图6 各组 SMMC-7721 细胞Transwell 迁移实验(结晶紫染色,×200)
2.9各组SMMC-7721肝癌细胞MMP-9、cyclinD1、VEGF表达比较 FCRL5转染组MMP-9、cyclinD1、VEGF表达显著高于对照组(P<0.001)。FCRL5 inhibitor组MMP-9、cyclinD1、VEGF表达显著低于对照组和FCRL5转染组(P<0.001)。见表5。
3 讨 论
FCRL5在进化中高度保守,由215个氨基酸组成,重约30 kDa,是一种多功能因子,涉及多种生物多样性过程,包括转录、DNA修复、分化、发育和细胞外信号〔11〕。FCRL5与DNA的小沟结合并促进在染色质内的同源结合位点装配位点特异性DNA结合蛋白(p53)。FCRL5可促成细胞迁移和肿瘤侵袭。FCRL5过表达已在许多类型的癌症中被描述,包括乳腺癌、结肠癌、前列腺癌、肝癌、肺癌、胃癌。与正常胃组织相比,观察到FCRL5在胃癌组织中大量表达和血清FCRL5水平与浸润深度和淋巴结转移显著相关,这表明FCRL51在胃癌中具有重要作用〔12〕。此外Hedgehog信号通路也能激活FCRL5 基因,配体(Shh)未与跨膜蛋白受体(Ptch)结合时,解除了 Ptch 对 Smo 的抑制作用,进而活化下游转录因子FCRL5,激活下游原癌基因〔13,14〕。本研究结果显示,肝癌组FCRL5蛋白水平表达水平高于癌旁组,肝癌组FCRL5蛋白阳性率高于癌旁组,这与上述讨论相符合。
体外细胞试验显示FCRL沉默显著抑制肝癌MGC-803细胞增殖,对细胞周期进展的分析表明,FCRL沉默减少了S期细胞的数量,同时增加了G0/G1期细胞的数量,表明G0/G1停滞〔15〕。进一步分析其中一种细胞周期调节因子cyclinD1,表明FCRL5可通过控制周期调节蛋白的表达来启动增殖。研究表明,FCRL5可通过与其受体的相互作用调节核因子(NF)-κB,磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)或丝裂原活化蛋白激酶信号通路激活癌细胞增殖〔16〕。肿瘤生物学的重要组成部分是细胞的转移能力。FCRL5沉默可显著降低癌细胞的转移能力,FCRL5沉默减少了MMP-9的细胞表达,MMP-9是参与细胞外基质(ECM)降解的关键酶。由于ECM对细胞运动产生生化和机械障碍,降解是癌细胞转移的重要过程;在胰腺癌细胞中FCRL5、MMP-9表达与癌转移能力一致;FCRL5通过特异性抑制PI3K/Akt信号通路诱导MMP-9表达〔17〕。而本试验结果提示FCRL5具有促进肝癌细胞增殖与侵袭迁移能力的作用。
研究〔18,19〕表明,cyclinD1是明确的原癌基因,能促进细胞增殖,其机制与cyclinD1结合周期蛋白依赖性激酶(CDK)蛋白磷酸化E2Fs-pRb二聚体,E2F脱离pRb蛋白后促使细胞越过G1/S限制点进入S期有关。FCRL5通过作用于细胞周期G1期,促进G1向S期正向转换,并以细胞周期素核编码区与CDK4/6结合,形成cyclinD1-CDK4或cyclinD1-CDK6复合物,此复合物是调节细胞增殖周期的关键蛋白。MMP-9其主要作用底物是Ⅳ、Ⅴ型胶原和明胶。体外侵袭实验证实肿瘤细胞的高侵袭能力与MMP-9高表达密切相关,本研究中FCRL通过诱导MMP-9的分泌,水解细胞外基质,从而有利于肝癌细胞的侵袭〔20〕。根据上述结果推测,FCRL5具有促进肝癌细胞增殖与侵袭迁移能力的作用,其机制可能与FCRL5诱导肝癌细胞高表达MMP-9、cyclinD1、VEGF有关。
综上所述,FCRL5在肝癌组织中高度表达;FCRL5具有促进肝癌细胞增殖与侵袭迁移能力的作用,其机制可能与FCRL5诱导肝癌细胞高表达MMP-9、cyclinD1、VEGF有关。
