胃癌患者全腹腔镜全胃切除手术治疗的有效性及对患者并发症发生的影响
2021-07-20张凌志李凯江
张凌志 刘 争 李凯江
消化道癌中胃癌属于较为常见的1种癌症,具有病死率、发病率高等特点[1]。胃根治性切除手术方式分为腹腔镜和开放性两种,开放性的手术虽然效果比较好,花费的时间较短,但是给予患者创伤较大,手术后恢复的时间较长,所以依从性较差[2]。腹腔镜虽然难度比较大,手术时间长,对操作者的要求较高,但是术后住院时间比较短,创伤较小[3]。两种治疗方式各有优势和劣势[4]。在本次研究过程中,通过对比开腹全胃切除术治疗和全腹腔镜全胃切除手术治疗,了解其有效性以及并发症的发生,现报告如下。
1 资料与方法
1.1 一般资料
选取2018年2月至2020年6月我院收治的胃癌患者82例,随机数字表法分为两组,纳入标准:①通过病理学诊断以及胃镜病理活检确诊为胃癌;②符合全胃切除手术治疗的标准;③病灶处于肌层和肌层以下的位置;④无其他脏器及远处转移;⑤所有患者均知晓本次研究,并签署同意书表示自愿参与。排除标准:①重度免疫功能障碍;②患有自身免疫系统以及血液系统重度疾病的患者;③临床资料不全;④患有精神类疾病;⑤腹部有手术史;⑥已经远处转移或者实施化疗者;⑦并发全身性重度感染性疾病;⑧患有其他恶性肿瘤;⑨出血性疾病。对照组41例,男性25例,女性16例,年龄43~82岁,平均(62.4±1.8)岁;研究组41例,男性27例,女性14例,年龄41~84岁,平均(63.2±1.2)岁。资料具有可比性(P>0.05),同时经过医院伦理委员会批准。
1.2 方法
1.2.1 对照组 首先需要对患者进行全身麻醉,平躺在手术台上,胃部正中间切1个约18~20 cm的切口,观察是否有腹腔积液,同时对周围的组织进行检查,是否发生转移,了解肿瘤切除范围。横结肠上端将胃结肠的韧带剖开,分离的位置上方是到横结肠系膜前叶,下方是到胰腺下缘,将肠系膜血管充分的表现出来,清扫淋巴结。胰腺被膜向上分离,到达胰腺上缘的位置,将胃十二直肠动脉充分的暴露出,显示胃右动脉、肝总动脉,将横结肠系膜前叶向左边分离,直到结肠脾区,将胃脾韧带离断,并结扎、离断胃短静脉和动脉,向右边游离,直到结肠肝区,充分的暴露胃网膜右边的静脉和动脉,胃网膜右侧动静脉从根部结扎和离断,幽门下淋巴结清扫,胃右动脉从根部结扎和离断,对于第5组淋巴结进行清扫,对十二指肠裸化进行处理,同时切割闭合十二指肠球部,使用1号细线缝合浆肌层,同时对十二指肠残端进行缝合,清扫腹腔干、脾、胃左动脉的淋巴结,比例肝十二直肠的韧带,同时对周围的淋巴结进行清扫,到食管右侧为止的小网膜全部切除,同时清除附近的淋巴结。剖开食管腹膜,对淋巴结清扫,离断胃膈韧带,结扎和离断左膈下动脉食管贲门,清除淋巴结,将脾门和脾动脉充分的显露出来,对脾动脉、脾门淋巴结进行清扫,距离肿瘤的上段大约是5 cm的位置使用荷包钳夹闭,离断食管,在距离屈氏韧带约25 cm离断空肠,远端的位置放置管状吻合器,完全吻合,使用切割闭合器对盲端进行缝合,距离食管空肠和近段空肠吻合口大约44 cm的地方实施肠端侧吻合,闭合系膜孔,放置引流管,将腹腔闭合[5]。
1.2.2 研究组 使用全腹腔镜切术手术:术前准备和对照组相同,在肚脐的位置开横切口,放置大小为10 mm的Trocar,同时建立人工气腹,压力值在14 mmHg,之后放置腹腔镜,在右侧和左侧肋缘下腋前线戳孔,作用是为了放置5 mm以及10 mm的Trocar,右侧和左侧锁骨中线平齐上段大约为2 cm的位置制作孔,放置12 mm、5 mm的Trocar,逐渐上提到大网膜,使用超声刀游离横结肠系膜前叶,左侧游离的位置是到结肠脾区、右侧为结肠肝曲、上游离到胰腺上缘, 将胃左动静脉、胃网膜右动脉、静脉、胃短动静脉充分的暴露,对第8、7、10、11组的淋巴结进行清扫,对于肝总动脉充分的暴露,之后离断、Hemlock夹闭胃左血管、胃右动脉[6]。清洁完成第12组淋巴结,再将第2组和第1组的淋巴结清扫干净。贲门食管下段裸化。在腹腔镜的帮助下,离断十二指肠使用的是直线切割缝合器,之后将腹腔镜器械撤出,在剑突下方大约6.5~8 cm的位置做辅助性的切口,荷包钳的钳夹固定食管,离断,全部切除淋巴结以及胃,食管残端缝合,距离屈氏韧带大约25 cm的位置游离和离断空肠,从远端空肠的位置将管状吻合器放入,食管下端实施食管空肠吻合,空肠盲端的位置需要使用切割缝合器闭合,在距离食管空肠吻合口大约44 cm的位置实施肠肠端侧吻合,固定缝合吻合口,常规放置腹腔引流管,并将腹腔闭合[7]。
1.3 观察指标
比较两组并发症发生概率。包含有:吻合口出血、肠梗阻、吻合口狭窄、感染。
比较两组各项手术指标。术后住院时间、首次排期时间、术中出血量、切口长度、手术时间。
比较两组血清肿瘤标志物水平。在保持空腹状态下采取静脉血3 ml,装入EDTA真空采血管中进行抗凝,离心使用的是高速冷冻离心机,常温下进行,时间为10 min,转速设定为3000 r/min,将血清分离之后,对糖类抗原50(CA50)、糖类抗原19-9(CA19-9)、癌胚抗原(CEA)测定使用的是电化学光免疫分析法。
1.4 统计学方法

2 结果
2.1 两组并发症发生情况对比
研究组吻合口出血、肠梗阻、吻合口狭窄、感染并发症发生率均低于对照组(P<0.05),见表1。

表1 两组并发症发生情况比较(例,%)
2.2 组各项手术指标对比
研究组术后住院时间、首次排气时间、术中出血量、切口长度均低于对照组(P<0.05),手术时间长于对照组(P<0.05),见表2。
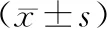
表2 两组各项手术指标对比
2.3 两组血清肿瘤标志物水平对比
研究组CA50、CA19-9、CEA水平均低于对照组(P<0.05),见表3。
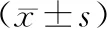
表3 两组血清肿瘤标志物水平对比
3 讨论
产生胃癌的原因有很多种,如果身体处于正常状态下,胃黏膜的上皮细胞会受到癌基因的调节以及抑癌基因影响,保持增殖和凋亡的平衡,如果这种状态被打破就是出现癌变[8]。临床中胃癌的病死率以及发病率都比较高[9]。在治疗方面一般使用全胃切除术,传统的治疗方法虽然可以清楚转移淋巴结以及胃癌原发病灶,但是因为解剖的层次较多,所以对操作者要求比较高,同时在实施手术时会导致出血量多,创伤大,同时还会出现切口感染、愈合不良,严重的应激反应等,对于预后有一定的影响[10]。选择科学、安全、有效的手段是治疗胃癌的重点[11]。
全腹腔镜全胃切除手术是微创治疗的1种,可以充分的看到腹腔中的情况,使用腹腔镜可以对四周狭小的位置进行探查,传统的手术方法只能依靠扩大手术切口增加手术视野,并且范围被限制[12]。有研究显示,全腹腔镜全胃切除手术因为有腹腔镜的辅助,所以可以对血管的走向、解剖平面、病灶位置进行准确的探查,可以彻底清扫淋巴结和切除病灶,减少对周围组织的伤害[13]。手术中使用超声刀可以减少出血量,在清扫淋巴结过程中,可以使用超声刀进入到间隙中,所以结果显示:研究组术后住院时间、首次排期时间、术中出血量、切口长度均低于对照组(P<0.05),手术时间长于对照组(P<0.05),从以上指标中我们可以清楚的了解全腹腔镜全胃切除手术对患者的有效性。
血清肿瘤标志物在临床中属于特异性存在的1种,位于肿瘤细胞异常增殖或者肿瘤细胞产生的物质,肿瘤的进展、发生和表达水平变化之间有一定的关系。血清CA50、CA19-9、CEA均是血清肿瘤标志物[14]。在本次研究过程中,结果显示:研究组CA50、CA19-9、CEA均低于对照组(P<0.05)。CA50属于唾液酸酯糖蛋白和唾液酸,在健康人群中水平比较低,如果细胞出现癌变,就会导致糖基化酶被激活,促使细胞表明的糖基结构出现改变,还会使水平增高[15]。CEA主要在胚层发育造成的消化系统肿瘤,通过消化道进行代谢,血清中占据的含量较少,如果发生肿瘤细胞时,就会释放进入到血液循环、淋巴循环,水平也会提高[16-17]。CA19-9属于糖链蛋白的1种,经过肿瘤细胞分泌,还会经过胸导管进入血液循环中,提高其水平[18-19]。由此我们可以认为全腹腔镜全胃切除手术可以改善胃癌患者的预后[20]。
研究组吻合口出血、肠梗阻、吻合口狭窄、感染并发症发生概率均低于对照组(P<0.05),说明在治疗胃癌时,对患者使用全腹腔镜全胃切除手术治疗安全性较强,这是因为腹腔镜手术给予患者较小的创伤,并且可以清楚直观的看到病灶以及周围的情况,从而实施清扫结节和全胃切除等操作方法,患者疼痛感较轻,切口较小,感染等并发症的发生概率较低,有效的帮助患者尽快康复出院,回归到正常的生活中。
综上所述,胃癌患者治疗过程当中,全腹腔镜全胃切除手术治疗效果理想,有效的降低并发症的发生,增加有效性,临床上应当进一步推广应用。
