上调蛋白激酶D2表达减轻小鼠肺缺血/再灌注损伤
2021-07-19刘浩明朱海宏
刘浩明,华 毛,张 莉,朱海宏
(青海省第五人民医院1.胸外科;2.头颈外科,青海 西宁810007;3.青海省人民医院 胸外科,青海 西宁810007)
肺缺血/再灌注损伤(lung ischemia-reperfusion injury, LI/RI)是指肺组织经历一定时间缺血再次恢复血流供应后,其功能代谢障碍及结构功能破坏出现加重的现象,是肺移植手术失败和患者死亡的主要原因[1-3]。低氧诱导因子-1 α(hypoxic inducible facter 1α,HIF-1 α)/血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)信号通路与LI/RI密切相关,HIF-1 α是调节细胞氧稳态的核心转录因子,VEGF可促血管生成,该信号通路可在缺氧条件下被激活[4-5]。蛋白激酶D(protein kinase D,PKD)属于丝/苏氨酸蛋白激酶家族,研究报道,PKD2的表达可能影响组织缺血/再灌注损伤(ischemia-reperfusion injury, I/RI)后的细胞修复反应,在维持血管壁完整性、稳定性中具有重要作用,但PKD2在LI/RI中的作用尚不清晰[6]。本研究建立小鼠LI/RI模型,以HIF-1 α/VEGF信号通路为切入点,探讨PKD2对LI/RI的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级C57BL/6J野生型(WT)小鼠20只(北京维通利华实验动物技术有限公司);PKD2基因过表达(PKD2+/+)小鼠40只(Jackson实验室)。实验小鼠均为6~8周龄,体质量18~22 g,雌雄各半。实验动物及饲养条件符合《实验动物管理条件》要求。
1.1.2 试剂(盒):戊巴比妥钠、HE染色试剂盒、RIPA裂解液、PMSF、脱脂奶粉、ECL发光液、PVDF转印膜和Trizol(北京索莱宝科技有限公司);2-甲氧基雌二醇(2-methoxyestradiol,2ME)、蛋白定量试剂盒、蛋白Marker(北京鼎国昌盛生物技术有限责任公司);TNF-α、IL-1β、IL-6 ELISA试剂盒(武汉伊莱瑞特生物科技有限公司);引物(TaKaRa公司);HIF-1 α、VEGFA、GAPDH兔源重组单克隆抗体,羊抗兔二抗(CST公司);中性树胶(国药集团化学试剂有限公司)。
1.2 方法
1.2.1 动物的分组及处理:将C57BL/6J WT小鼠和C57BL/6J PKD2+/+小鼠分别随机分为假手术组(WS和PS组;W.WT; P.PKD2+/+)、LI/RI组(WIR和PIR组,无创显微血管夹夹闭左侧肺门60 min,松开血管夹再灌注120 min)和HIF-1α抑制剂2-ME组[(WIR+2ME)和(PIR+2ME)组,造模前2 d腹腔注射20 mg/(kg·d)2ME],每组10只[7]。
1.2.2 肺组织湿/干重比(W/D)的检测:分离小鼠肺组织,记录湿重(W),然后放置于恒温干燥箱(80 ℃)烘烤48 h,记录干重(D),湿重与干重之比即为W/D。
1.2.3 HE染色观察肺组织病理变化:将肺组织置于4%多聚甲醛中固定处理48 h,制作组织切片,脱蜡、复水后行HE染色。
1.2.4 ELISA试剂盒检测肺组织中炎性因子:取大鼠肺组织,冰上匀浆,3 000 r/min离心取上清,按照ELISA试剂盒说明书检测TNF-α、IL-1β和IL-6的含量。
1.2.5 RT-qPCR检测肺组织HIF-1α和VEGFAmRNA表达:大鼠肺组织研磨匀浆后,加1 mL Trizol裂解液提取组织总RNA,所有样品均以GAPDH为内参。反应体系:dNTPs 0.5 μL+5×缓冲液5 μL+Taq 酶0.3 μL+MgCl21.5 μL+cDNA 模板2 μL +上下游引物分别1 μL,加去离子水至总体积25 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,重复40个循环,最后72 ℃延伸10 min,4 ℃ 5 min终止反应,实验重复3次。采用2-△△Ct的方法计算目的基因mRNA相对表达水平的变化。引物序列见表1。

表1 RT-qPCR引物序列
1.2.6 Western blot检测肺组织HIF-1 α和VEGFA蛋白表达:提取各组大鼠肺组织蛋白,BCA蛋白定量试剂盒测定蛋白浓度,配置15%的分离胶和5%的浓缩胶进行SDS-PAGE,上样后80 V电泳2 h,60 V转膜2 h,5%脱脂奶粉封闭2 h,随后将条带放入10 mL的HIF-1 α和VEGFA兔源一抗稀释液中,稀释比例均为1∶2 000,4 ℃环境下孵育12 h,第2天用TBST缓冲液清洗3次,每次10 min,然后加入羊抗兔二抗(1∶2 000)中,在37 ℃环境下孵育2 h,TBST缓冲液清洗3次后滴加ECL发光液,反应1 min后置于凝胶成像系统显影。免疫印迹实验的内参蛋白为GAPDH,用Image J软件分析各个蛋白对应的吸光度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白吸光度值/内参蛋白吸光度值。
1.3 统计学分析
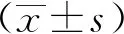
2 结果
2.1 肺组织湿/干重比(W/D)值比较
WS组W/D值为(4.11±0.62),PS组为(3.92±0.81),WIR组为(7.80±1.10),PIR组为(4.83±0.72),WIR+2ME组为(10.02±1.19),PIR+2ME组为(9.77±0.95)。与WS组比较,WIR组W/D值增加(P<0.05);与WIR组比较,PIR组W/D值降低(P<0.05);与WIR和PIR组比较,(WIR+2ME)和(PIR+2ME)组W/D值均增加(P<0.05);但两组之间差异无统计学意义。
2.2 肺组织病理学形态比较
WS组和PS组小鼠肺组织结构清晰,肺泡完整,肺间质中未见明显炎性细胞浸润现象;与WS组比较,WIR组小鼠的肺组织可见肺泡被明显破坏并伴有水肿,肺泡腔中有大量炎性细胞浸润和红细胞渗出;与WIR组比较,PIR组小鼠的肺组织损伤程度较轻,肺泡和肺间质轻度水肿,炎性细胞浸润较少,未见明显出血现象;与WIR和PIR组比较,(WIR+2ME)和(PIR+2ME)组小鼠肺组织损伤进一步加重,炎性细胞浸润和充血水肿程度明显(图1)。
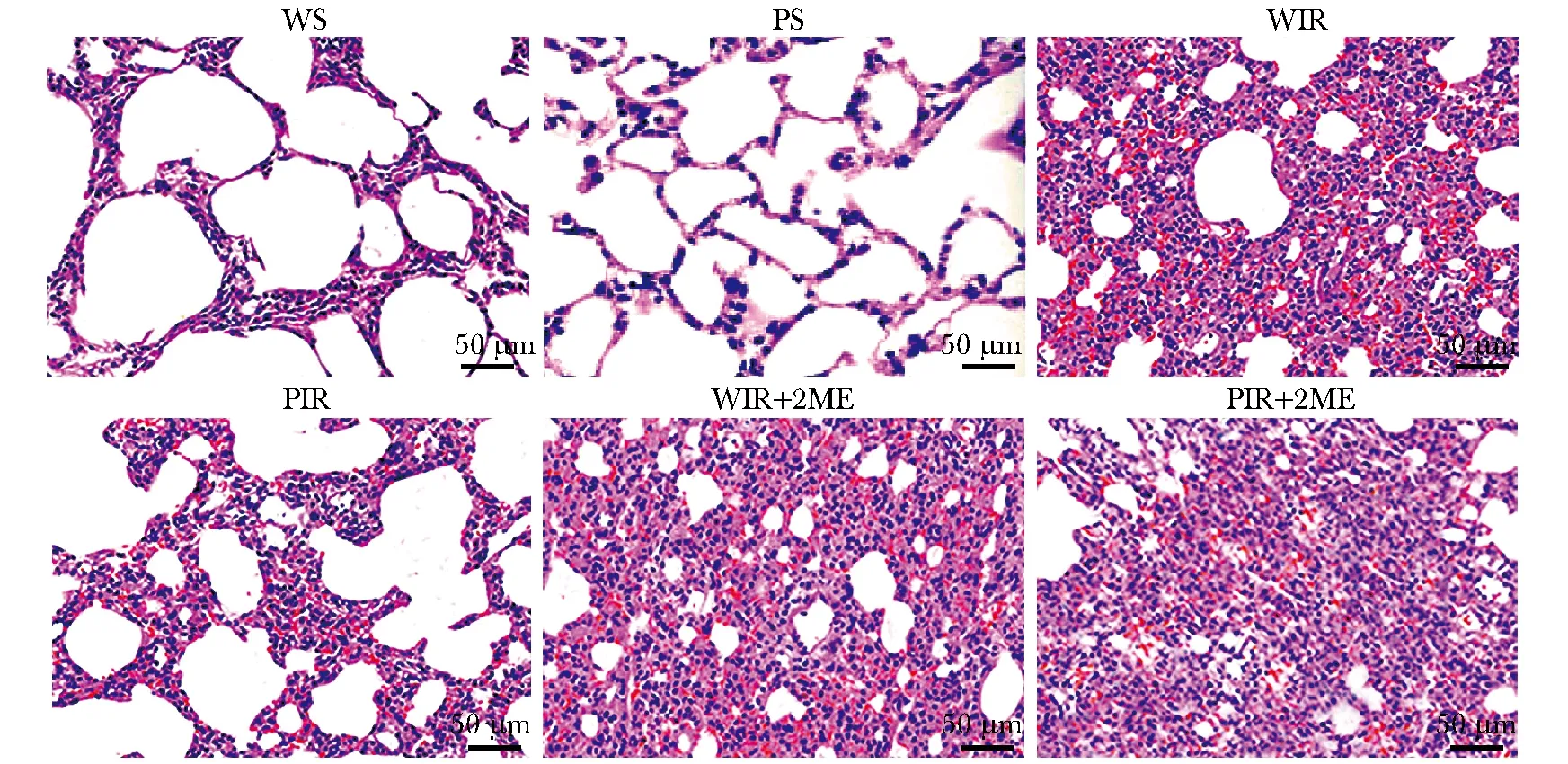
图1 肺组织病理学形态比较
2.3 肺组织中TNF-α、IL-1β和IL-6含量比较
与WS组比较,WIR组小鼠肺组织中TNF-α、IL-1β和IL-6含量显著增加(P<0.05);与WIR组比较,PIR组小鼠肺组织中TNF-α、IL-1β和IL-6含量则显著减少(P<0.05);与WIR和PIR组比较,(WIR+2ME)和(PIR+2ME)组TNF-α、IL-1β和IL-6含量均升高(P<0.05)(图2)。
A.TNF-α (pg/mL); B.IL-1β (pg/mL); C.IL-6 (pg/mL); *P<0.05 compared with WS group; #P<0.05 compared with WIR group; △P<0.05 compared with PIR group
2.4 肺组织HIF-1 α和VEGFA mRNA表达水平比较
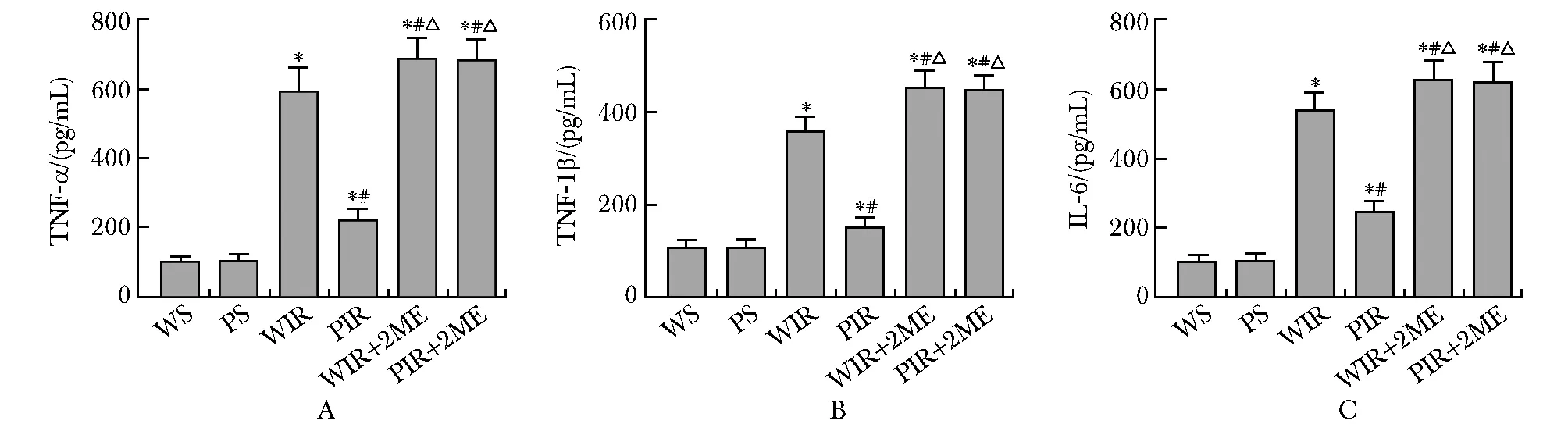
与WS组比较,WIR组小鼠肺组织中HIF-1 α和VEGFA的mRNA水平增加(P<0.05);与WIR组比较,PIR组小鼠肺组织中HIF-1 α和VEGFA的mRNA水平增加(P<0.05);与WIR和PIR组比较,(WIR+2ME)和(PIR+2ME)组HIF-1 α和VEGFA mRNA水平显著降低(P<0.05)(图3)。
*P<0.05 compared with WS group; #P<0.05 compared with WIR group; △P<0.05 compared with PIR group
2.5 肺组织中HIF-1 α和VEGFA蛋白表达比较
与WS组比较,WIR组小鼠肺组织中HIF-1 α和VEGFA蛋白表达显著增加(P<0.05);与WIR组比较,PIR组小鼠肺组织中HIF-1 α和VEGFA蛋白表达显著减少(P<0.05);与WIR和PIR组比较,(WIR+2ME)和(PIR+2ME)组HIF-1 α和VEGFA蛋白表达显著降低(P<0.05)(图4)。
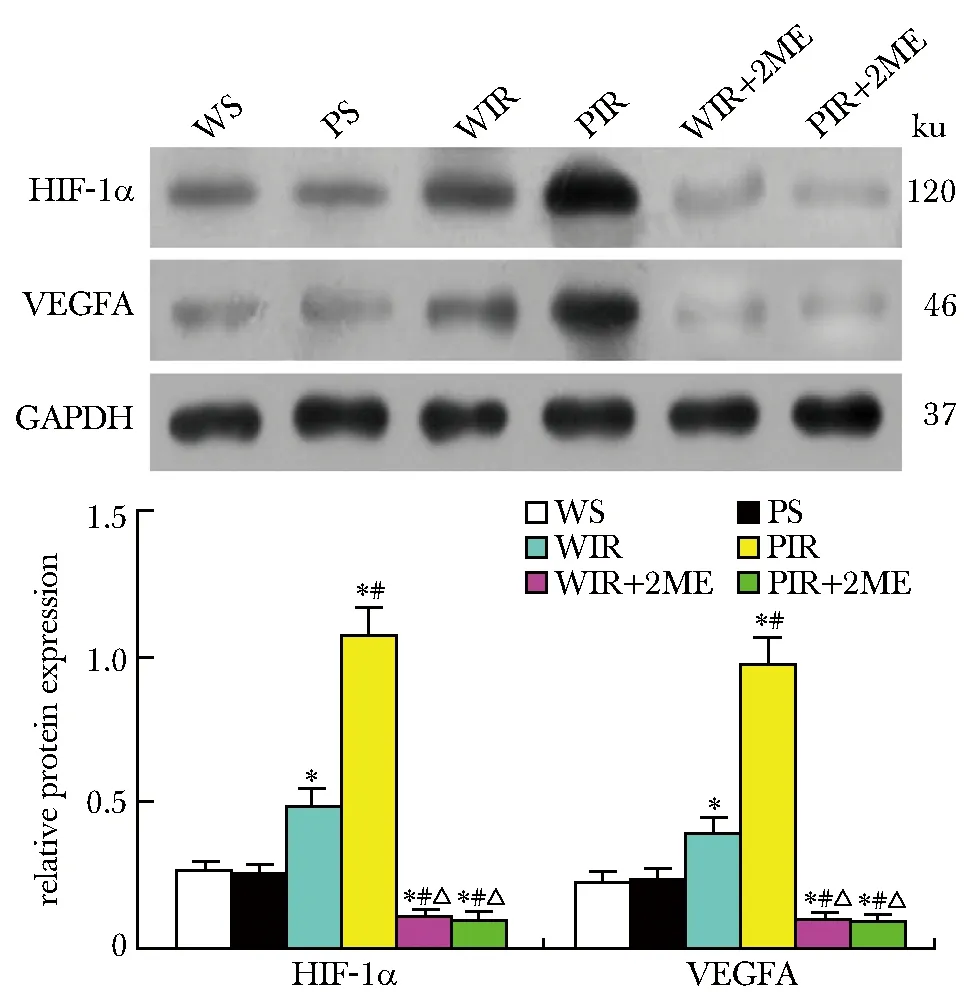
*P<0.05 compared with WS group; #P<0.05 compared with WIR group; △P<0.05 compared with PIR group
3 讨论
LI/RI是肺移植手术后器官衰竭和患者死亡的常见原因,其发生机制虽得到广泛研究,但尚未完全阐明,也导致临床缺乏有效的特异性药物治疗[8-9]。PKD家族是属于Ca2+/钙调蛋白依赖性蛋白激酶的一组独立蛋白激酶家族,在细胞的增殖、分化和凋亡过程中发挥重要调控作用[10]。研究表明,PKD2可增强部分组织和细胞对I/RI的耐受性,保护细胞免受氧化应激损伤,抑制炎性因子的表达[11]。目前,PKD2基因在LI/RI中的作用尚不清晰,因此,本研究构建了PKD2基因过表达小鼠LI/RI模型,探究PKD2在LI/RI中的作用及其机制。
本研究发现,WIR组小鼠肺组织W/D值高于WS组,肺组织损伤明显,而PIR组小鼠W/D值降低,肺组织损伤减轻,表明PKD2基因高表达可改善小鼠肺组织损伤。LI/RI的显著特点是疾病进展过程中产生大量促炎因子[12]。本研究发现,LI/RI使小鼠肺组织炎性因子TNF-α、 IL-1β和IL-6的含量显著增加,而PKD2过表达后炎性因子含量明显降低,表明PKD2基因高表达可抑制炎性因子的释放。哺乳动物细胞普遍具有对缺氧或缺血性损伤的自我保护能力,HIF-1 α是这一过程中的关键调节因子[13]。常氧条件下,HIF-1 α被大量降解,表达水平较低,在低氧条件下则被大量激活,调节下游VEGFA等多种靶基因的转录和表达,发挥在低氧环境中保护组织器官的代偿作用[14]。本研究发现,LI/RI使小鼠肺组织中HIF-1 α和VEGFA mRNA及蛋白表达增加,PKD2过表达后HIF-1 α和VEGFA mRNA及蛋白表达显著增加,表明PKD2基因高表达可能促进HIF-1 α/VEGFA信号通路的活化。为了进一步探究PKD2是否通过HIF-1 α/VEGFA信号通路调控LI/RI,我们对LI/RI小鼠使用了HIF-1 α抑制剂2-ME,结果显示,HIF-1 α抑制剂使(WIR+2ME)和(PIR+2ME)组小鼠肺组织W/D值增加,肺组织损伤进一步加重,炎性因含量均升高,PKD2对LI/RI的保护和改善作用被取消,而HIF-1 α mRNA及蛋白表达被2-ME降低的同时,VEGFA mRNA及蛋白表达亦显著降低,(PIR+2ME)组上述指标的变化与(WIR+2ME)组比较差异无统计学意义,表明HIF-1 α/VEGFA信号通路的表达上调可减轻LI/RI,PKD2基因对LI/RI的调控是通过HIF-1 α/VEGFA信号通路实现的。
综上所述,PKD2基因表达上调可改善小鼠LI/RI,其机制可能与增加HIF-1 α/VEGFA信号通路的表达有关。
