miR-193a-3p抑制高糖诱导人视网膜血管内皮细胞凋亡
2021-07-19秦建民张来香魏振英
秦建民,张来香,魏振英
(1.青岛市第八人民医院 眼科, 山东 青岛 266000; 2.青岛市中心医院 肝胆血管外科, 山东 青岛 266000;3.青岛市妇女儿童医院 新生儿童重症监护病房, 山东 青岛 266011)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的主要微血管并发症之一,也是世界范围内致盲的主要原因[1]。据统计,1型糖尿病患者视网膜病变患病率为24%~27%,2型糖尿病患者视网膜病变患病率为9%~16%,糖尿病患者失明率为0.2%~0.5%[2]。因此,了解DR发生的分子机制,寻找新的治疗方法至关常重要。微小RNA(microRNA,miRNA)是一类具有调节功能的短链非编码RNA,其通过抑制下游靶蛋白表达来降解mRNA,调节蛋白翻译,参与细胞的增殖、凋亡等生理和病理过程。目前对miRNA的研究主要集中在肿瘤中,对其在其他疾病中的研究较少。miR-193a-3p是一种肿瘤相关miRNA,miR-193a-3p在食管癌、胰腺癌等多种恶性肿瘤表达异常,参与对肿瘤细胞增殖、凋亡以及耐药等的调控[3-4]。研究显示高血糖状态下仔猪心外膜脂肪组织miR-193a-3p的表达发生改变,其表达异常可能与Ⅱ型糖尿病的发生有关[5]。于是推测miR-193a-3p可能参与人DR进展。视网膜内皮细胞凋亡是视网膜病变的早期病理表现之一,因此,本研究采用高糖诱导人视网膜内皮细胞(human retinal endothelial cells,HRECs)凋亡构建DR细胞模型[6-7],研究miR-193a-3p在高糖干预的HRECs中的变化以及对HRECs凋亡的影响,以期为DR的治疗开辟新的途径。
1 材料与方法
1.1 材料
人视网膜内皮细胞HRECs系(美国模式培养物保藏所);DMEM培养基和胎牛血清(Hyclone公司);抑制物对照(anti-miR-NC)、miR-193a-3p抑制物(anti-miR-193a-3p)、模拟物对照(miR-NC)和miR-193a-3p模拟物(miR-193a-3p mimics)(上海吉玛制药有限公司);PI3K/AKT信号通路阻断剂LY294002(Sigma-Aldrich公司);总RNA提取试剂盒和LipofectamineTM2000(Invitrogen公司);膜联蛋白异硫氰酸荧光素/碘化丙啶(annexin V-FITC/PI)双染细胞凋亡试剂盒、RIPA裂解液(上海碧云天生物科技公司);兔源活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved-caspase-3,c-caspase-3)抗体、兔源B细胞淋巴瘤/白血病-2(B cell lymphoma/leukaemia-2,Bcl-2)抗体以及山羊抗兔Ⅱ抗(Abcam公司);兔源磷酸化的磷酸肌醇3激酶(p-PI3K)抗体、兔源磷酸化的蛋白激酶B(p-AKT)抗体、兔源β-actin抗体(CST公司)。
1.2 方法
1.2.1 细胞的培养和分组:用10%胎牛血清的DMEM培养基于37 ℃、CO2体积分数5%条件下培养HRECs,0.25%的胰蛋白酶消化后传代。分为正常对照(normal control,NC)组;模型(model)组:用葡萄糖浓度为30 mmol/L的细胞培养液培养HRECs细胞48 h;anti-miR-NC组:转染anti-miR-NC的HRECs;anti-miR-193a-3p组:转染anti-miR-193a-3p的HRECs;模型+miR-NC组:转染miR-NC后进行高糖处理;模型+miR-193a-3p组:转染miR-193a-3p mimics后进行高糖处理;模型+LY294002组:高糖处理HRECs细胞后,利用30 μmol/L的LY294002进行干扰24 h。细胞转染步骤参考LipofectamineTM2000说明书进行。
1.2.2 RT-qPCR检测miR-193a-3p的表达水平:用细胞总RNA提取试剂盒提取各组细胞的总RNA,紫外分光光度计测定各组样品中RNA的浓度。以U6为内参,按照反转录试剂盒说明合成cDNA,以cDNA为模板,进行PCR扩增。PCR程序设置为:95 ℃ 15 min,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,40个循环。用2-ΔΔCt法计算各组样品中miR-193a-3p的表达水平。引物序列如下:miR-193a-3p上游引物5′-AACTGGCCTACAAAGTCCCAGT-3′,试剂盒通用引物作为下游引物;U6上游引物5′-CTCGCTTCG GCAGCACA-3′,下游引物5′-AACGCTTCACGAATT TGCGT-3′。
1.2.3 流式细胞测量术检测细胞凋亡:PBS洗涤细胞两次,胰蛋白酶消化后,收集细胞沉淀,加入结合缓冲液重悬细胞,调整细胞为1×105个/mL。取100 μL细胞悬液,依次加入5 μL的annexin V-FITC和5 μL的PI,于避光条件下结合15 min,1 h内上机检测细胞凋亡情况。
1.2.4 Western blot检测c-caspase-3、Bcl-2、p-PI3K和p-AKT蛋白的表达水平:用RIPA细胞裂解液提取细胞蛋白。取适量细胞蛋白与上样缓冲液混合后,沸水浴5 min变性细胞蛋白,取40 μg蛋白样品上样至每个泳道进行聚丙烯酰胺凝胶电泳。电泳结束后利用常规湿法砖模装置将蛋白转移至PVDF膜,封闭后,与稀释的Ⅰ抗(c-caspase-3和Bcl-2抗体稀释比例为1∶1 000,β-actin抗体稀释比例为1∶500)室温条件反应2 h后,与稀释的Ⅱ抗(1∶1 000)室温条件下结合1 h,采用电化学发光试剂盒显色,以β-actin为内参,采用Quantity One软件对各组细胞目的蛋白条带进行定量分析。
为检测miR-193a-3p是通过调控PI3K/AKT信号进而影响HG诱导的HRECs细胞凋亡,提取细胞蛋白,按照上述步骤检测p-PI3K和p-AKT蛋白的表达水平。p-PI3K抗体稀释比例为1∶1 000,和p-AKT抗体稀释比例为1∶2 000。
1.3 统计学分析
2 结果
2.1 高糖诱导的人视网膜血管内皮细胞中miR-193a-3p的表达
模型组HRECs细胞中miR-193a-3p的表达显著低于对照组(P<0.05)。
2.2 模型组HRECs蛋白表达及凋亡
模型组HRECs细胞c-caspase-3的表达水平显著升高,Bcl-2的表达水平显著降低,细胞凋亡率显著升高(P<0.05)(图1,表1)。
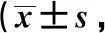
表1 模型组HRECs蛋白表达及凋亡
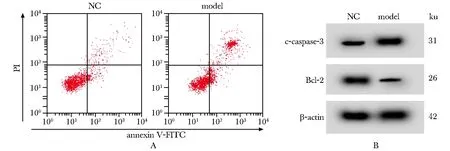
c-caspase-3.cleaved-caspase-3; A.flow cytometry detected cell apoptosis; B.Western blot detected the expression of c-caspase-3 and Bcl-2 protein
2.3 低表达miR-193a-3p对HRECs凋亡的影响
与anti-miR-NC组比较,anti-miR-193a-3p组miR-193a-5p的表达水平显著降低,c-caspase-3蛋白的表达水平显著升高,Bcl-2蛋白的表达水平显著降低,细胞凋亡率显著增加(P<0.05)(图2,表2)。
表2 低表达miR-193a-3p对HRECs凋亡的影响

c-caspase-3.cleaved-caspase-3
2.4 Western blot检测PI3K/AKT信号通路相关蛋白
模型组同对照组相比PI3K/AKT信号通路相关蛋白p-PI3K和p-AKT的表达显著升高,anti-miR-193a-3p组同anti-miR-NC组相比PI3K/AKT信号通路相关蛋白p-PI3K和p-AKT的表达显著升高(P<0.05)(图3)。
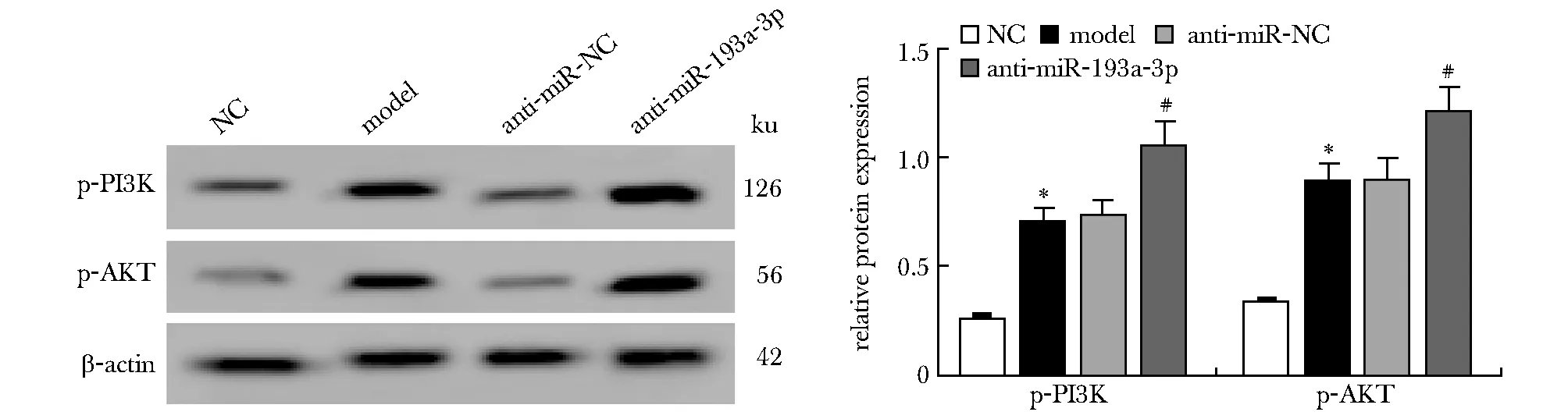
*P<0.05 compared with NC; #P<0.05 compared with anti-miR-NC
2.5 高表达miR-193a-3p可以减轻高糖处理对HRECs凋亡的影响
模型+miR-193a-3p组同模型+miR-NC组比较HRECs细胞miR-193a-3p的表达水平显著升高,c-caspase-3蛋白的表达水平显著降低,Bcl-2的表达水平显著升高,细胞凋亡率显著降低(P<0.05)(图4,表3)。

c-caspase-3.cleaved-caspase-3
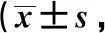
表3 高表达miR-193a-3p可以减轻高糖处理对HRECs凋亡的影响
2.6 抑制PI3K/AKT信号通路可减轻高糖处理对HRECs凋亡的影响
模型+LY294002组同模型组比较HRECs细胞p-PI3K、p-AKT和c-caspase-3蛋白的表达水平显著降低,Bcl-2蛋白的表达水平显著升高,细胞凋亡率显著降低(P<0.05)(图5,表4)。
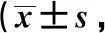
表4 Western blot检测PI3K/AKT信号通路相关蛋白
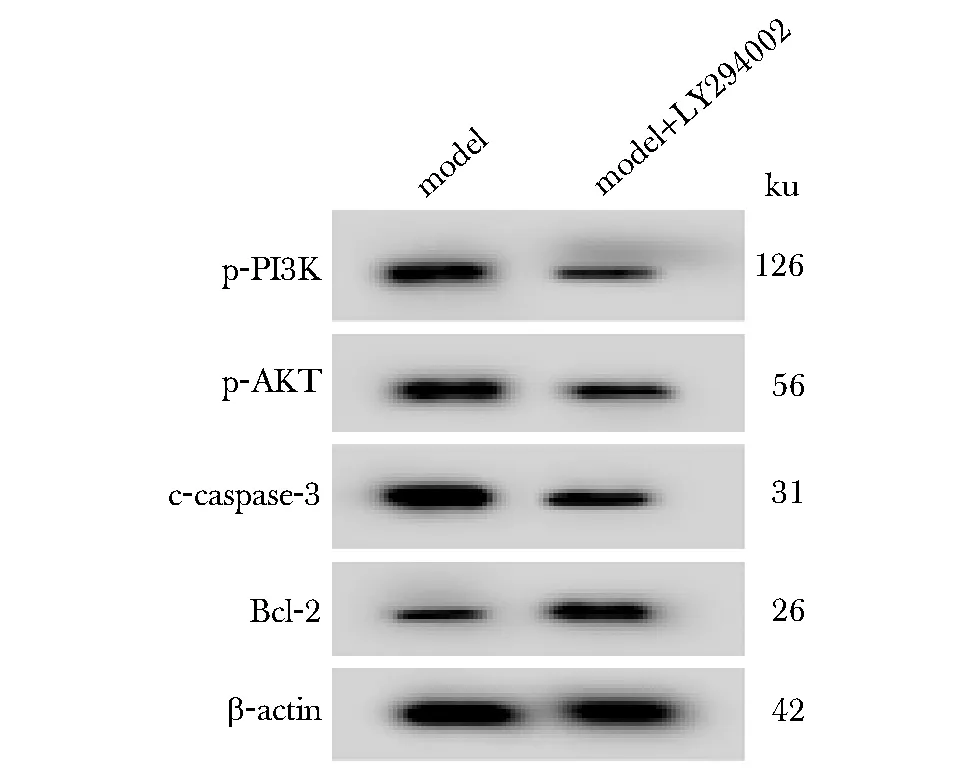
c-caspase-3.cleaved-caspase-3
3 讨论
DR是一种常见的糖尿病微血管并发症, 可导致视网膜微血管进行性损害,严重影响患者的身心健康,给社会带来了沉重的精神和经济负担。近年来,尽管医学研究不断进展,但DR治疗效果仍不能能令人满意[8]。因此,阐明DR进展的分子机制,开辟新的治疗途径迫在眉睫。
miRNAs参与细胞增殖、凋亡、信号传导等多种生理和病理过程。随着对miRNAs和DR的相关研究的不断深入,多种miRNAs相继被发现。研究显示miR-200b通过调控血管内皮生长因子和转变生长因子β1表达,调节HRECs增殖,延缓糖尿病视网膜病变进展[9]。血红素氧合酶1对DR中hRECs具有保护作用,miR-214和miR-181b是HO-1发挥保护作用的关键靶点[10]。miR-21-5p在高糖诱导的HRECs中表达上调,抑制miR-21-5p通过调控PI3K/AKT和细胞外信号调节激酶通路活性抑制HRECs的血管生成[11]。miR-193a-3p被认为参与调控糖尿病发生发展[5],但其在DR中的作用尚未阐明。本研究显示高糖诱导后HRECs中miR-193a-3p的表达水平显著降低,c-caspase-3表达增加,Bcl-2表达减少,细胞凋亡率增加。转染anti-miR-193a-3p低表达miR-193a-3p可促进c-caspase-3表达,抑制Bcl-2表达,诱导HRECs凋亡。进一步研究发现高表达miR-193a-3p可抑制c-caspase-3表达,促进Bcl-2表达,逆转高糖处理对HRECs细胞凋亡的促进作用。提示miR-193a-3p的表达降低与高糖诱导的HRECs凋亡有关。
PI3K/AKT信号通路是调节胰岛素信号传导和调控血糖的主要信号途径,其异常影响相应组织器官细胞的增殖、凋亡、侵袭、血管生成等多个细胞过程,导致疾病发生[12]。高糖通过激活猴视网膜血管内皮细胞RF/6A内PI3K/Akt信号通路促进血管新生,抑制PI3K/Akt信号通路可阻断高糖对血管新生的促进作用[13]。miR-126通过调控PI3K/AKT信号通路促进HRECs增殖,增加细胞存活率,抑制高糖诱导的HRECs凋亡,是DR治疗的潜在靶点[14]。本研究显示高糖诱导后HRECs中p-PI3K和p-AKT的磷酸化水平显著增加,PI3K/Akt信号通路激活。miR-193a-3p低表达促进PI3K-Akt信号通路活化。阻断PI3K/Akt信号通路抑制c-caspase-3表达, 促进Bcl-2表达,减缓高糖诱导的HRECs凋亡。提示miR-193a-3p可能通过调控PI3K-Akt信号通路抑制高糖诱导的HRECs凋亡。
综上所述,miR-193a-3p可抑制高糖诱导的HRECs凋亡,其机制可能与抑制PI3K/Akt信号通路有关。因此,miR-193a-3p有望成为DR的潜在治疗靶点,为DR临床治疗提供了新的方向。
