内镜活检标本中胃泌酸腺肿瘤6例临床病理特征
2021-06-18陈雪燕朱伟峰黄榕芳
陈雪燕,陈 刚,朱伟峰,黄榕芳
胃泌酸腺肿瘤好发于老人,内镜常显示上三分之一胃的息肉或隆起性病变,周围胃黏膜通常无萎缩或肠化改变,组织学表现为网状、索状腺体结构,即“无穷无尽的腺体”模式,而非正常的管状结构,由主细胞和壁细胞两种成分构成。约60%病例可发生黏膜下浸润,部分病例淋巴结转移,较少发生腹膜播散。根据WHO(2019)消化系统肿瘤分类:病变局限于黏膜内,为胃泌酸腺腺瘤(oxyntic gland adenoma, OGA);病变发生黏膜下侵犯,为胃底腺腺癌(gastric adenocarcinoma of fundic gland, GA-FG)。本文着重探讨内镜活检标本中OGA/GA-FG临床病理学表现,旨在提高病理诊断的准确率。
1 材料与方法
1.1 材料收集2017年1月~2020年12月福建省肿瘤医院病理科存档的3 674例内镜活检组织切片,重新阅片,筛选可疑病例,并通过医院网络系统收集患者内镜特征及临床资料。
1.2 方法标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,HE染色,镜下观察。免疫组化采用EnVision两步法染色,DAB显色,一抗胃蛋白酶原重组人抗体1(Pepsinogen 1)购自Abcam公司。
2 结果
2.1 临床特点3 674例内镜活检病例中有6例OGA/GA-FG,包括2例会诊病例。女性4例,男性2例,女性略多于男性,年龄44~69岁,中位年龄59.5岁,好发于老人。内镜主要表现为胃底、胃体多发息肉样隆起(3/6)或胃底、胃体单发息肉样隆起(3/6)(图1),M-NBI示表面腺管结构不规则扩张、扭曲,血管迂曲、延长(图2),HP均阴性,均未见肠化及萎缩背景。4例活检部位为胃底,2例活检部位为胃体。
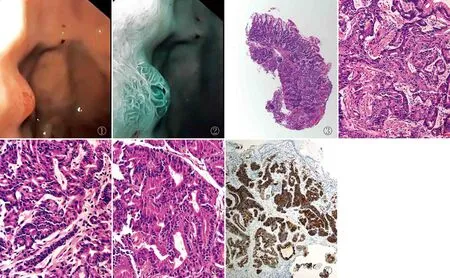
图1 胃镜白光提示隆起性病变 图2 胃镜M-NBI示表面腺管结构不规则扩张扭曲,血管迂曲、延长 图3 病变主要位于黏膜层中下部,该病例局部破坏黏膜肌 图4 病变区域腺体结构复杂、相互融合、延长,结构异型明显 图5 细胞呈多层或复层,可见主细胞、壁细胞两种成分 图6 细胞异型性小,细胞核密度增高,部分细胞核从基底层上移,核仁小而不明显 图7 主细胞Pepsinogen 1阳性,EnVision两步法
2.2 病理特征低倍镜下可见病变与周围正常黏膜有明显的分界线,病灶主要位于黏膜层中下部,1例破坏黏膜肌(图3),腺体结构复杂、相互融合、延长,结构异型明显(图4),间质无明显变化,可合并胃底腺息肉(3/6)。高倍镜下可见细胞呈多层或复层,可见两种细胞:主细胞和壁细胞(图5),以主细胞为主(5/6)或主细胞、壁细胞混杂分布(1/6),细胞异型性小,接近正常胃底腺细胞形态,细胞核稍增大,细胞核密度增高,部分细胞核从基底层上移,核仁小而不明显(图6),未见坏死及核分裂象。首次病理诊断:胃底腺息肉(2/6)、增生性息肉(1/6)、异型增生(1/6)、泌酸腺息肉(1/6)、GA-FG(1/6)。后续补充免疫组化标记:Pepsinogen 1示主细胞胞质阳性(图7)。
2.3 预后本组3例进行ESD病灶切除,均显示黏膜内病灶残留;另3例患者失访。
3 讨论
2007年Tsukamoto等[1]报道1例组织学检查显示分化良好的管状腺癌,由嗜碱性柱状或立方状细胞组成,偶尔可见粗嗜酸性颗粒,免疫组化标记胃蛋白酶原Ⅰ、Ⅱ和RUNX3强阳性,然而壁细胞的标志物(H+/K+-ATPase)阴性,于是首次提出主细胞分化腺癌的概念。2012年,Singhi等[2]在10例以主细胞分化为主的胃腺癌中,发现病变均集中在黏膜层深部,但不累及黏膜下层,作者认为患者既无复发也无疾病进展,提出了泌酸腺息肉/腺瘤的概念。2016年,Chan等[3]发现胃底腺型腺癌和泌酸腺息肉/腺瘤主要的结构模式:网状的、实性的、丛生的腺体或这些模式的混合,主要均由形态温和的主细胞组成,因此认为两者是一个连续的谱系。根据WHO(2019)消化系统肿瘤分类:当病变局限于黏膜内为OGA;病变发生黏膜下侵犯,则为GA-FG。本组有50%的病例失访,黏膜下层浸润情况不明确,故采用泌酸腺肿瘤的名称。目前,国内也有少量GA-FG的病例报道[4-6]。
临床及内镜特征:在111例GA-FG的大型综述[7]研究中,GA-FG发病平均年龄66岁(39~85岁),男女比为2.2 ∶1,80%发生在胃的上三分之一的隆起性病变,平均直径为10 mm,最大直径为85 mm。
OGA/GA-FG的组织学通常表现为分化良好的肿瘤,类似于正常胃底腺[3],病变表面大多由正常的小凹型上皮构成,黏膜层靠下的部位形成网状、索状结构,即“环状腺体”模式[3],失去了正常的管状结构。腺体可能表现为主细胞为主型、壁细胞为主型,或是两种细胞的混合型。背景间质可能正常,或出现水肿、黏液样改变,即使发生黏膜下浸润,结缔组织增生也较少[8]。
OGA/GA-FG的HE染色易识别高分化胃泌酸腺肿瘤中的壁细胞和主细胞,一般只有在低分化的病例中,需行免疫组化标记以确认主细胞或壁细胞分化。主细胞表达MUC6、Pepsinogen 1、RUNX3,壁细胞表达H+/K+-ATPase。若表达Pepsinogen 1提示主细胞型,表达H+/K+-ATPase提示壁细胞型,Pepsinogen 1和H+/K+-ATPase均表达提示混合型[9]。
OGA/GA-FG需与以下疾病进行鉴别:(1)胃底腺息肉,表现为深部泌酸腺体局限性增生、部分腺体不同程度扩张,内衬受压扁平的壁细胞、主细胞和颈黏液细胞,细胞分布正常,无明显增生及结构异型,间质正常或轻微炎性改变,而OGA/GA-FG细胞增生并有明显结构异型。(2)“牵手癌(cawling-type adenocarcinoma)”,组织学表现为不规则融合的腺体,由嗜酸性细胞构成的囊性扩张腺管,被形容为类似字母“WHYX”,肿瘤细胞异型性不大,也可出现印戒细胞,间质炎性背景较重(HP相关),其周围黏膜多伴萎缩及肠化。OGA/GA-FG主要由两种细胞组成,其炎性背景较轻,几乎没有炎性病变,周围黏膜组织一般无萎缩及肠化。(3)神经内分泌肿瘤,可表现为细胞异型性低,炎性背景较轻,周围黏膜组织一般无萎缩及肠化。组织学特点与OGA/GA-FG相似,但神经内分泌肿瘤表达Syn、CgA、CD56,不表达Pepsinogen 1、MUC6;而OGA/GA-FG表达Pepsinogen 1、MUC6,可局灶表达CD56、Syn,不表达NSE、CgA,两者可资鉴别。
目前,OGA/GA-FG相关的分子机制报道有限,WNT-β-catenin信号通路或ERK1/2MAPK通路的激活被认为在肿瘤的发生中起作用。日本学者Nomura等[10]报道26例GA-FG,认为GNAS突变可能作为激活Wnt/β-catenin信号通路的另一种机制。OGA/GA-FG的发病危险因素与常见胃肿瘤不同,可能与质子泵抑制剂的使用有关,其导致组织学改变,尤其是胃底腺息肉和壁细胞增生[11-12]。
OGA中约60%的患者出现黏膜下浸润[7],研究[2,13-14]表明GA-FG是一种生长缓慢的肿瘤,浅表黏膜下浸润的患者可以行ESD病灶切除或局限性胃切除,怀疑有较深的侵袭性病变或淋巴结转移的病例,才需行扩大胃切除和(或)淋巴结清扫。
近年,随着对OGA/GA-FG认识的提高,本组部分病例得到了较准确的病理诊断,患者也进行了ESD病灶切除。OGA/GA-FG是一种具有特征性的肿瘤性病变,但不同于传统意义上的癌,过度诊断可导致胃切除风险,误诊为其他良性疾病可能会延误治疗,提高临床和病理医师对其认识水平,才能更好地指导临床治疗。
