体外膜肺氧合治疗心源性休克患者的效果及对并发症的影响
2021-06-08曾庆芳罗梦洁刘巧
曾庆芳 罗梦洁 刘巧
东莞康华医院 523000
心源性休克(CS)临床上指由心肌收缩力极度降低、心室射血障碍、心室充盈障碍及心脏直视手术后低排综合征等多种原因引起严重急性周围循环衰竭的一组综合征,是心泵衰竭的极期表现〔1〕。CS患者心脏泵血功能不足以维持机体所需的心输出量,从而引发血压降低、重要器官及组织呈现低灌注状态,以组织缺氧、缺血、代谢障碍和重要脏器受损为主要病理特征〔2〕。CS是急性心肌梗死患者临床致死的一项重要原因,也是继发心肌炎、心肌病和严重心律失常的主要危险因素之一,病死率极高。以人工心脏替代原本心脏功能是心功能衰竭患者目前临床上最直接有效的治疗方式之一,通过建立机体外周动脉,将氧合后的血液泵入其中从而使心肺得到休息,并为心肺功能发生急性衰竭的危重症患者创造心肺复苏、抢救及治疗的理想时机〔3〕。体外膜肺氧合(ECMO)以患者机体外循环系统作为基础,是经体外循环给予患者生命支持的有效辅助治疗手段之一,其目的即在于把患者体内血液泵入体外循环装置,保证血液氧合充足的同时排除血液中二氧化碳,从而为机体提供有效血液〔4〕。本文回顾性分析了该院2016年1月至2018年1月期间行ECMO支持的6例心源性休克患者临床治疗相关资料,旨在探讨ECMO的应用对CS患者症状改善情况和并发症情况的相关影响。
1 资料与方法
1.1 一般资料
收集整理2016年1月至2018年1月在东莞康华医院行ECMO支持治疗的6例心源性休克患者资料,进行回顾性分析。其中男4例、女2例;年龄12~58岁,中位年龄39岁;急性爆发性心肌炎2例,急性心肌梗死2例,阵发性室性心动过速1例,冠状动脉旁路移植1例。纳入标准〔5〕:①心脏疾病急性加重患者;②收缩压高于90 mmHg或平均动脉压低于60 mmHg,③经液体管理休克症状无改善患者;④器官低灌注症状和指标持续存在患者。排除标准:分析实际病情ECMO辅助治疗方案不适用患者。所有患者或其家属了解研究内容后自愿签署同意书并接受ECMO治疗。经该院伦理委员会审核,批准许可本次研究。
1.2 研究方法
1.2.1治疗药物和设备 治疗所用药物包括预充液及肝素;ECMO系统选用德国MAQUET与美国美敦力套件包,设备包括离心泵、变温水箱以及空氧混合器与气源。选用动静脉薄壁进口插管作为导管。
1.2.2置管和管理方法 所有患者均在静脉-动脉辅助模式下以右侧股动脉和股静脉为穿刺部位进行置管,并安置股动脉远端灌注导管以避免发生远端肢体缺血性坏死。离心泵起始灌注流量设置40~80 ml/(kg·min),随后观察患者血流动力学指标变化和中心静脉血氧饱和度予以适当调整。治疗期间中心静脉血氧饱和度应处于65%~75%。抗凝管理使用普通肝素,激活凝血时间150~180 s,每2 h检测一次。镇静药物为咪达唑仑注射液,先给予负荷剂量2~3 mg,于20~30 s内静脉注射完毕,随后以持续泵入方式输注,剂量为1~5 μg/(kg·min),直到镇静深度达到满意效果。安排本科室5年以上工作经验资深医师进行床旁彩超检查,每日观察患者心脏结构以及左心室射血分数,评估病情恢复情况。监测患者血液动力学指标变化。
1.2.3ECMO撤机时间 密切关注患者心脏功能恢复情况,逐渐降低ECMO流量,直至循环维持流量达到患者心输出量20%~30%。给予患者小剂量血管活性药物情况下左心室射血分数超过40%,静脉血氧饱和度超过65%,血流动力学稳定且动脉血乳酸低于2 mmol/L即可考虑撤离ECMO。
1.3 疗效评价
分析6例患者行ECMO治疗前血压、左心室射血分数、肌钙蛋白Ⅰ和脑钠肽等指标〔6〕,完善病例资料;观察并记录所有患者接受ECMO治疗前以及治疗后2 h/12 h/48 h血流动力学相关指标,具体包括心率(HR)、平均动脉压(MAP)、中心静脉压(CVP)、中心静脉血氧饱和度(SvO2)、pH及乳酸(LA)。以撤离成功率与生存出院率作为ECMO治疗效果终点指标,统计并发症发生情况。
1.4 统计学方法
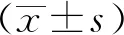
2 结果
2.1 ECMO治疗前患者状态分析
研究对象6例心源性休克患者中包括急性爆发性心肌炎2例、急性心肌梗死2例、阵发性室性心动过速和冠状动脉旁路移植各1例。接受ECMO治疗前6例患者均采取心肺复苏抢救10~180 min,2例患者实施经皮冠状动脉介入治疗,1例联合主动脉内球囊反博(IABP)支持治疗,经询问病史,1例患者有2型糖尿病既往史。前期积极治疗包括大剂量的血管活性药物,但6例患者心源性休克症状均未得到有效纠正。ECMO治疗前患者相关指标:血压73~86/41~56 mmHg;左心室射血分数28%~40%;肌钙蛋白Ⅰ0.01~93.72 μg/L;脑钠肽:386~6827 ng/L。
2.2 ECMO治疗前与治疗后2 h/12 h/48 h血液动力学指标变化
应用ECMO辅助治疗后2 h开始患者血液动力学各项指标出现明显改善,与治疗前比较差异有统计学意义(P<0.05);治疗后12 h/48 h与治疗前、治疗后2 h比较差异显著,均具有统计学意义(P<0.05)。以F值检验各项指标,多组间差异均存在统计学意义(P<0.05)。见表1。

表1 ECMO治疗前与治疗后2 h/12 h/48 h血液动力学指标变化
2.3 ECMO治疗效果及并发症发生情况分析
观察临床疗效,6例心源性休克患者中有5例患者休克症状得到有效改善,并且待病情稳定后顺利完成撤机,1例患者发生死亡,撤机成功率与出院生存率为83.33%(5/6)。患者接受ECMO辅助治疗时间15~220 h,平均(158.65±33.25)h,治疗期间并发症发生情况见表2。其中有1例患者同时并发急性肾功能不全和弥散性血管内凝血(DIC)最终导致临床死亡,无放弃治疗患者。

表2 ECMO辅助治疗并发症发生情况(n)
3 讨论
3.1 ECMO辅助治疗方式及其应用
3.1.1ECMO应用时机 一般情况下,危重症患者进行心脏手术前预先安装ECMO辅助治疗预防心外科手术导致的CS不是常规做法〔7〕,但如果患者血液动力学指标不稳定,血压、心率等变化难以把控,可选择手术前及时安装ECMO,为后续手术治疗起到过渡作用。心肌梗死患者并发室间隔穿孔病情往往十分凶险,有相关研究表明这类患者术前及时安装ECMO过渡临床有一定可行性〔8〕。对于血液动力学不稳定的高危退行性主动脉瓣狭窄患者尽快采取经皮或者心脏外科主动脉瓣置换手术治疗临床意义重大。有学者认为,进行心脏外科手术之前即应用ECMO辅助治疗虽然会加重患者病情,但预先安装ECMO支持效果明显,患者手术和术后安全性有所提高,提示ECMO临床应用效果确切〔9〕。总的来说,心源性休克患者明确需要ECMO辅助支持治疗时,应用时机越早对患者病情越有利,应用时机越晚可能导致患者辅助治疗时间、呼吸机使用时间、IUC观察时间和住院时间均有所延长,患者身体耐受条件变差、ECMO辅助治疗效果有所下降。如果小剂量升压药物与IABP联合应用仍无法维持患者器官灌注,就应该考虑实施ECMO辅助支持治疗。
3.1.2ECMO置管方法 建立体外循环系统通常可采用中心和周围两种置管方式,中心置管途径为右心房-主动脉,周围置管途径成人一般为股静脉-股动脉,由经皮穿刺或外科切开完成置管,而小儿一般为颈静脉-颈动脉,由外科切开完成置管。无论是经皮穿刺还是外科切开完成置管,都各具优缺点,实际选择时应充分考虑现有技术条件,例如,患者于手术室建立体外循环并且不能停机情况下多采用外科切开置管;患者于监护室则由监护室医生采用经皮下穿刺方式置管〔10〕。本文6例心源性休克患者均采用经皮下穿刺方式实施右侧股静脉-股动脉模式置管,置管全部成功。据相关研究报道〔11〕,行ECMO治疗的15例患者经皮下穿刺股动脉-股静脉途径置管,并在股浅动脉经皮留置导管,保持肢体远端血液灌注,结果均置管成功,其中出现过心搏骤停患者9例、穿刺口感染患者2例、腹膜后血肿1例、股动脉局部夹层1例、急性肢体缺血1例,表明经皮下穿刺置管操作相对便捷,应用于心肺复苏患者具有一定优势,但同时也具有不容忽视的血管并发症风险。
3.1.3抗凝与药物影响 应用ECMO支持的患者治疗期间需持续进行全身抗凝管理,行心脏手术后第1天可不使用肝素,随后应根据具体病情逐渐增加肝素用量,对于渗血、出血严重患者则限制肝素使用剂量,一般认为抗凝期间激活凝血时间维持在150~200 s为宜,而活化部分凝血活酶时间维持在50~70 s为宜〔12〕。当患者血小板出现减少或者有出血症状时应考虑停用肝素抗凝。ECMO支持治疗期间药物灭活减少等作用可影响患者机体药物代谢动力学,因此合理调整辅助药物剂量也是治疗的重要内容。使用脂溶性药物及高蛋白结合药物(如芬太尼、伏立康唑)可加重ECMO管路吸附作用,而水溶性药物(如糖肽类抗生素)浓度可随血液稀释或其他生理过程减小吸附作用〔13〕。
3.1.4ECMO撤机问题 ECMO辅助治疗撤机问题相对复杂,主要影响因素为患者心脏以及其他终末器官功能恢复情况,倘若患者心功能尚未恢复极易导致撤机失败,甚至造成患者死亡。治疗期间采用床旁B超等方式持续性监测患者心脏功能、及时检测血液动力学相关指标可作为撤机指导依据〔14〕。本文6例患者中有5例患者在病情稳定后顺利完成撤机,1例患者发生死亡。
3.2 ECMO辅助治疗并发症与护理
3.2.1ECMO相关并发症 肾衰竭、肺栓塞以及多脏器功能衰竭是ECMO辅助治疗常见的并发疾病,也是影响患者预后效果、威胁患者生命安全的重要危险因素〔15〕。心源性休克患者多组织和器官存在缺血缺氧现象,肾脏发生严重缺血缺氧即引发肾功能衰竭,进而影响患者机体血容量与内环境相关调节,心脏负担加剧,构成恶性循环。肺栓塞可造成患者呼吸障碍,加快机体循环衰竭情况,不利于预后。多脏器功能衰竭则是引起冠状动脉缺血、缺氧的主要原因,可造成患者机体出现代谢性酸中毒,释放心肌抑制因子加重心脏损害,危及患者生命。此外,护理不周还可使患者发生出血、严重感染,引发各类感染性疾病,如细菌性肺炎等等。
3.2.2ECMO临床护理措施 加强临床护理是预防相关并发症、降低感染风险的有效途径。首先,辅助治疗期间护理人员应重点观察患者创口、穿刺部位、皮肤黏膜、引流和大便等情况,检查是否有出血现象,从而避免不必要的穿刺,可采用持续低负压吸引的方式保持胸管通畅,密切关注患者凝血机制。其次,颅内出血也是极其重要的监护内容之一,置管管理、抗凝管理期间需保证患者体外循环稳定,使用肝素抗凝时注意观察患者是否神志清楚以及动脉搏动情况,可推断患者是否有颅内出血,可行进一步检查。再者,对于栓塞的预防应从患者体征观察和ECMO泵运行监听两方面加强护理,密切观察患者瞳孔变化、病理反射、肢体活动等情况,以此判断是否存在栓塞;ECMO声响异常时同样可说明循环系统中存在栓塞,应立即报告医生采取措施,必要时更换ECMO系统或氧合器,并加强对氧合器的检查。
综上所述,及时给予心源性休克患者体外膜肺氧合治疗,能够有效改善血液动力学状态,在较短时间内缓解休克症状,提高ECMO辅助治疗临床效果的关键即在于严格把握应用时机、合理使用治疗药物、加强置管和抗凝等管理操作以及积极采取并发症预防护理措施。
利益冲突所有作者均声明不存在利益冲突
