汝南县花生白绢病菌的鉴定、生物学特性及室内抗病药筛选
2021-05-27李亮亮杨文玲杜志敏王继雯
李亮亮, 杨文玲, 杜志敏, 甄 静, 王继雯
(河南省科学院生物研究所有限责任公司/河南省微生物工程重点实验室,郑州 450008)
花生白绢病是枯萎型真菌病害,发生范围广泛,曾对美国[1]、阿根廷[2]、印度[3]、日本[4]等国家的花生产业造成巨大的经济损失,该病病原菌的无性世代是齐整小核菌(Sclerotium rolfsii Sacc.),有性世代为罗氏阿太菌(Athelia rolfsii)[5]. 该病菌寄主范围广泛,能侵染花生、辣椒、油茶、白术等植物,是一种危害严重的土传真菌[6-9]. 我国各大花生产区都有白绢病的发生,尤其以北方地区危害最为严重[10]. 2004年,山东省临沂市白绢病发病面积达60 000 hm2,造成直接经济损失9000万元[11]. 2010年,河南中牟、登封、汝南等花生产区白绢病大爆发,有些地块花生白绢病发病率高达80%,造成了严重的经济损失[12]. 本研究从河南省汝南县花生病株上分离白绢病的病原菌,对其进行了菌种鉴定,同时研究了病原菌的生物学特性和室内抗病高效药筛选,以期为白绢病的防治研究提供理论依据.
1 材料与方法
1.1 病株采集与病原菌的分离
2019年8月在河南省驻马店市汝南县花生产区采集具有白绢病典型症状的花生植株,小心收集茎秆基部的菌核带回实验室进行病原菌分离. 病原菌的分离采用菌核分离法和组织分离法.
菌核分离法:将收集到的菌核用75%乙醇处理30 s,30%次氯酸钠处理2 min 进行表面消毒,无菌水冲洗. 将消毒后的菌核放在无菌环境中自然风干,置于PDA培养基(200 g新鲜马铃薯去皮煮汁,葡萄糖20 g、琼脂粉20 g、蒸馏水1000 mL)在25 ℃培养箱内培养至产菌核萌发产生菌丝.
组织分离法:将花生发病组织的病健交界处切成5 mm长的小段,表面消毒后置于PDA培养基上培养至萌发产生菌丝.
用无菌牙签挑取菌落边缘菌丝重新接种到PDA平板上进行纯化.
1.2 病原菌的致病性测定
将通过两种方法分离到的病原菌(RS-1、RS-2)菌饼无伤接种到盆栽培养2个月的花生植株根基部,外加浸有无菌水的棉球保湿,置于人工气候箱内(温度25 ℃,湿度60%,16 h光照、8 h黑暗)培养. 每个处理接种4株花生,以接种PDA培养基为对照. 每3 d观察一次发病情况,20 d后将发病植株的病部组织带回实验室进行病原菌的分离. 将分离纯化后的菌株置于PDA平板上培养,观察分离菌株的菌落形态、菌核大小,并将菌株RS-1、RS-2进行比较.
1.3 病原菌的鉴定
1.3.1 形态学鉴定 将病原菌RS-1、RS-2接种到PDA平板上置于25 ℃条件下培养. 3 d后,观察菌落的形状、颜色及菌丝形态等. 继续培养10 d,观察RS-1和RS-2在PDA平板上形成的菌核数量、颜色变化等,并测量菌核直径. 经致病性验证和形态特征观察,发现RS-1、RS-2完全一致,是同一种病菌,故采用RS-1为研究对象.
1.3.2 分子生物学鉴定 病原菌RS-1菌株基因组的提取方法如下:将菌株RS-1接种于PDA平板上培养3 d,无菌条件下收集菌丝体,使用真菌基因组提取试剂盒(北京索莱宝科技有限公司)进行提取,将提取的RS-1基因组置于-20 ℃冰箱中备用. 以提取的菌株RS-1的基因组为模板,对病菌的rDNA-ITS序列进行PCR扩增.引物序列:ITS1为5′-TCCGTAGGTGAACCTGCGG-3′;ITS4为5′-TCCTCCGCTTATTGATATGC-3′. PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;最后72 ℃延伸10 min.PCR产物经1%琼脂糖凝胶电泳检测后,交由华大基因测序. 将测序结果在NCBI 网站上进行Blast 比对,选取同源性较高的菌株序列,用MEGA 6.05软件构建系统发育树.
1.4 病原菌生物学特性测定
1.4.1 温度对病原菌生长及菌核形成的影响 取直径5 mm的RS-1菌饼接种到PDA培养基上,分别置于4、10、15、20、25、30、35、40和45 ℃条件下培养. 3 d后,十字交叉法测量不同处理温度下RS-1的菌落直径,平均直径减去5 mm作为实际生长直径. 继续培养10 d,记录不同温度下产生的菌核数量. 每个处理温度设3个重复.
1.4.2 培养基pH对病原菌生长及菌核形成的影响 用1 mol/L的NaOH和HCl将PDA培养基的pH分别调至1.0~12.0,然后把病原菌RS-1接种于不同pH的PDA 平板上,在25 ℃条件下培养. 按照1.4.1项的方法测量不同pH下菌落生长直径和产生的菌核数量.
1.4.3 培养基碳、氮源对病原菌生长及菌核形成的影响 以Czapek培养基(KNO32 g、K2HPO41 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、FeSO40.01 g、蔗糖30 g、蒸馏水1000 mL、琼脂20 g)作为基础培养基,分别以葡萄糖、半乳糖、麦芽糖、山梨醇、淀粉、甘露醇等量置换其中的蔗糖作为培养基碳源. 将菌株RS-1菌饼接种于以上不同碳源培养基上置于25 ℃培养箱内培养. 菌落生长直径和产生菌核数量的测量方法同1.4.1项.
以Czapek培养基作为基础培养基,分别以胰蛋白胨、硫酸铵、硝酸钠、尿素、氯化铵、甘氨酸等量置换其中的KNO3作为培养基氮源. 将菌株RS-1菌饼接种于以上不同氮源培养基上置于25 ℃培养箱内培养. 菌落生长直径和产生菌核数量的测量方法同1.4.1.
1.4.4 菌核致死温度的测定 将菌株RS-1的成熟菌核转移到装有无菌水(完全淹没菌核)的试管中,在45、50、55和60 ℃的水浴锅中处理10 min后,取出试管在流水下使其迅速冷却. 随后取出菌核置于PDA平板上,25 ℃条件下培养. 3 d后检查菌核的萌发情况,每次检查不少于30粒菌核. 每个处理做3次重复.
1.5 室内药剂毒力测定
采用菌丝生长速率法测定8种市售药剂对白绢病菌的室内毒力. 药剂种类、剂型及生产厂家见表1. 用分析天平精确称取一定量的供试药剂,并用无菌水配置成10 000 mg/L 的母液. 将母液加入到PDA 培养基(50 ℃左右)中制成含不同药剂浓度的带毒平板. 将病原菌RS-1 接种于带毒平板,置于25 ℃条件下培养.每个处理重复3次,以加入无菌水的PDA培养基作对照. 待对照的菌落接近长满整个平板时,测量各处理的菌落直径,计算不同药剂对菌株RS-1的菌丝生长抑制率. 菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100. 根据抑菌率求出毒力回归方程y=ax+b,并计算不同药剂的有效抑制中浓度(EC50).
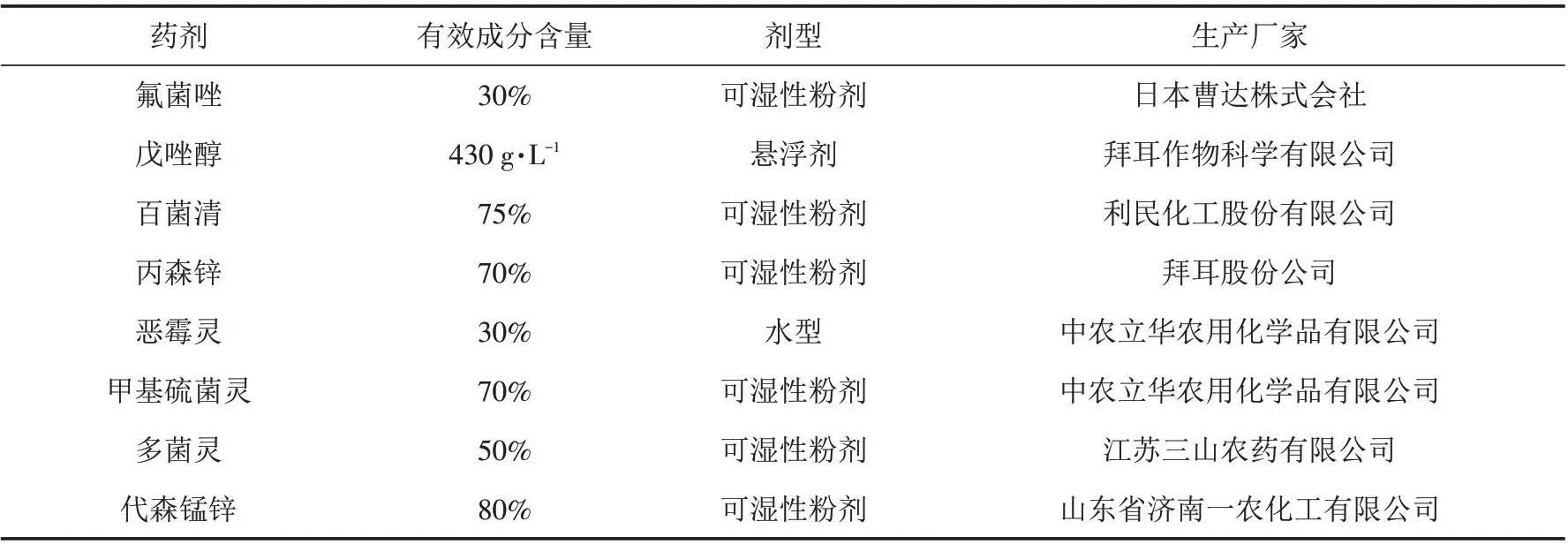
表1 8种供试药剂性状Tab.1 Properties of eight test fungicides
2 结果与分析
2.1 花生白绢病病害症状
花生各个生育期均可受白绢病菌的侵染,以成株期感染最为严重,危害部位主要是茎基部、根部以及果柄和荚果. 花生植株感病早期,感病部位由绿色转变为褐色并会出现云纹状斑点,在茎基部和根部土壤表面往往会长出一层白色绢丝状菌丝体(图1a). 随着病害的加重,感病部位开始出现腐烂、皮层脱落等症状,植株叶片边缘焦枯,最后枯萎而死. 环境潮湿时,茎基部和附近土壤的菌丝体会形成褐色、油菜籽状的菌核(图1b箭头所示).
2.2 病原菌致病性验证

图1 花生白绢病症状图Fig.1 Symptoms of peanut southern blight
用分离的病菌RS-1、RS-2 接种花生植株3 d 后,花生根基部开始出现少量放射状白色菌丝体,12 d后菌丝体大量出现,花生根基部出现与田间自然感病植株相似的症状,而接种PDA培养基的对照植株没有任何发病症状. 20 d 后将感病花生植株带回实验室进行病原菌分离,将分离菌株在PDA 培养基上25 ℃培养3 d,获得了与接种菌株RS-1和RS-2菌落、菌核形态特征一致的病原菌,完成科赫法则验证,证明菌株RS-1和RS-2对花生均具有致病性.
2.3 病原菌的鉴定
2.3.1 形态学鉴定 病原菌RS-1和RS-2能在PDA培养基上良好地生长,菌丝为白色细羽毛状,有隔膜,多分枝,向四周辐射生长(图2a、b). 25 ℃条件下培养3~4 d,即可长满直径为90 mm平板. 继续培养5~6 d,菌丝体紧密交织在一起开始形成菌核. 菌核初为白色,渐变为黄色,最后转为深褐色(图2c). 菌核多为球形,大小不一,表面光滑有光泽,直径0.4~2.2 mm. 经比较,病原菌RS-1和RS-2在对花生的致病性以及形态特征上完全一致,是同一种病菌. 根据《真菌鉴定手册》[13],初步将汝南县花生白绢病菌鉴定为齐整小核菌(S.rolfsii).

图2 菌株RS-1的菌落、菌丝和菌核形态Fig.2 Characteristic of colony,mycelium and sclerotia from strain RS-1
2.3.2 分子生物学鉴定 以提取的菌株RS-1的基因组为模板,对病菌的rDNA-ITS序列进行PCR扩增. 扩增产物经琼脂糖凝胶电泳后,显示约600 bp的单一条带(图3). 产物经测序,获得639 bp的rDNA-ITS片段,将序列提交至Genbank,获得登录号MN646214. 将获得的rDNA-ITS 序列与Genbank中的序列进行Blast 比对,结果表明菌株RS-1与罗氏阿太菌(A.rolfsii)有99%的最大相似性. 选取同源性较高的菌株序列构建系统发育树(图4),可以看出菌株RS-1与A.rolfsii聚于同一分支. 综合菌落形态特征与分子生物学分析,将菌株RS-1鉴定为罗氏阿太菌(A.rolfsii),其无性态为齐整小核菌(S.rolfsii).
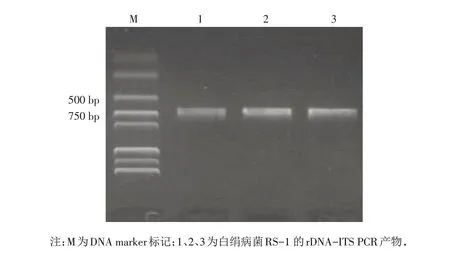
图3 花生白绢病菌RS-1的rDNA-ITS序列电泳图Fig.3 PCR products of rDNA-ITS of the pathogen RS-1
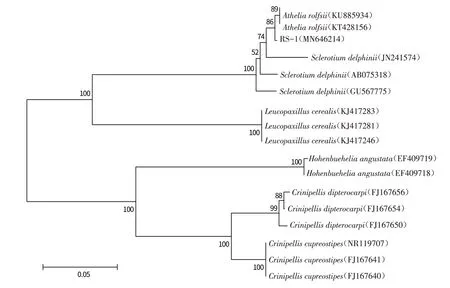
图4 花生白绢病菌RS-1的系统发育树Fig.4 Phylogenetic tree of the pathogen RS-1
2.4 病原菌生物学特性测定
2.4.1 培养温度对病原菌生长及菌核形成的影响 不同培养温度对病原菌生长和菌核形成的影响见图5.由图5 可知,在10 ~35 ℃条件下病菌可以正常生长,在温度为30 ℃时生长速度最快,3 d 后菌落直径为81.51 mm. 在20~35 ℃条件下病原菌能产生成熟菌核,其中在温度为25 ℃时产生的菌核最多,达到平均124 粒/皿. 在10 ℃和15 ℃条件下,病菌虽然能生长,但不能产生菌核.
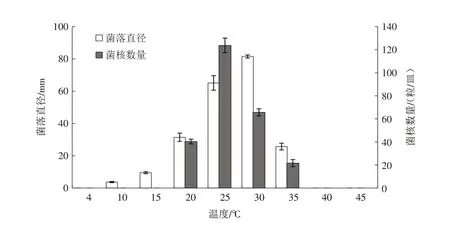
图5 温度对病原菌RS-1菌丝生长及菌核形成的影响Fig.5 Effects of temperature on growth and sclerotia formation of S.rolfsii RS-1
2.4.2 培养基pH 对病原菌生长及菌核形成的影响 病原菌RS-1生长的pH 值范围广泛,在pH 为2.0~10.0之间均能生长. 培养3 d后,pH为6.0时菌落直径最大,达到82.81 mm,继续培养10 d后产生的成熟菌核数量也最多,为132 粒/皿,可将其视为白绢病病原菌生长的最适pH. 在pH值为9.0和10.0时,虽然病原菌能生长,但此时不能产生成熟菌核(图6),说明碱性环境会抑制病原菌菌核的产生.
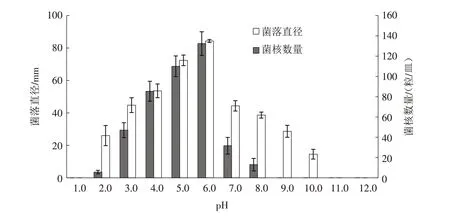
图6 pH对病原菌RS-1菌丝生长及菌核形成的影响Fig.6 Effects of pH on growth and sclerotia formation of S.rolfsii RS-1
2.4.3 培养基碳、氮源对病原菌生长及菌核形成的影响 不同培养基碳源对病原菌生长和菌核形成的影响如表2. 由表2 可知,供试的7 种碳源均能被白绢病菌利用进行营养生长,其中在以山梨醇为碳源的培养基上生长的最快,3 d 后菌丝生长直径为81.42 mm,甘露醇次之. 继续培养10 d 后,产生的菌核数量分别为32 粒/皿和48 粒/皿. 在以半乳糖为碳源的培养上,病原菌菌丝生长的速度虽然不是最快,但10 d后却产生了最多数量的菌核,达到78 粒/皿. 另外,在以葡萄糖、麦芽糖、淀粉为碳源的培养上病原菌不能产生菌核.
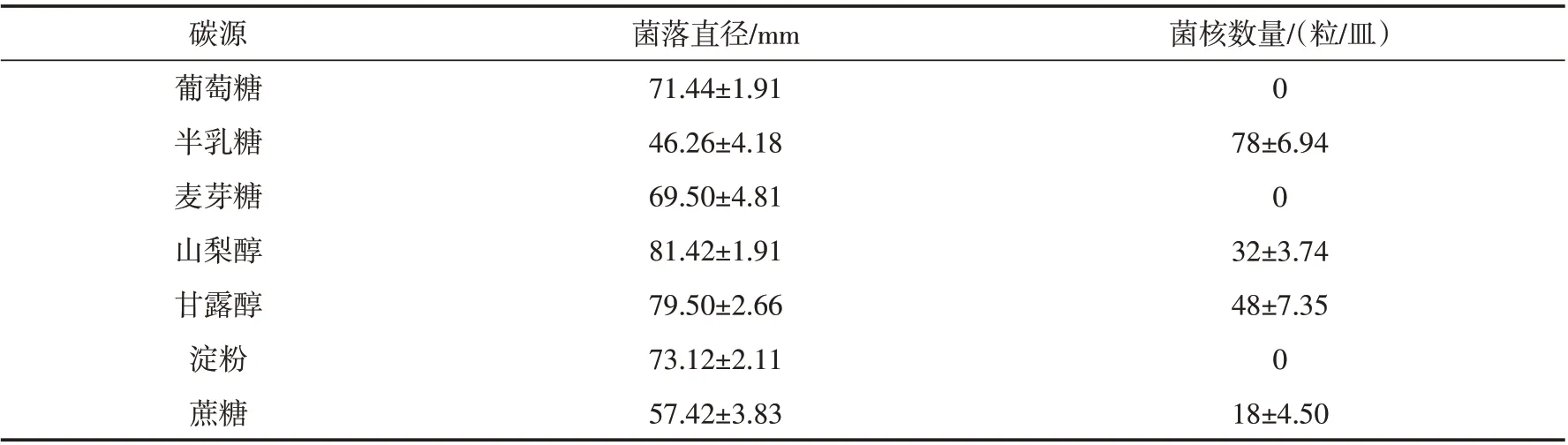
表2 不同碳源对病原菌RS-1菌丝生长及菌核形成的影响Tab.2 Effects of carbon sources on growth and sclerotia formation of S.rolfsii RS-1
不同氮源对病原菌菌丝生长及菌核形成的影响结果见表3. 白绢病菌在以胰蛋白胨为碳源的培养基上生长情况最好,培养3 d后菌丝生长直径77.06 mm,硫酸铵和硝酸钾次之. 白绢病菌在以胰蛋白胨为碳源的培养基上形成了最多的菌核,10 d后菌核数量为62 粒/皿. 病原菌几乎不能利用尿素为氮源进行营养生长,培养3 d后菌丝生长直径9.07 mm,并且不能形成菌核.
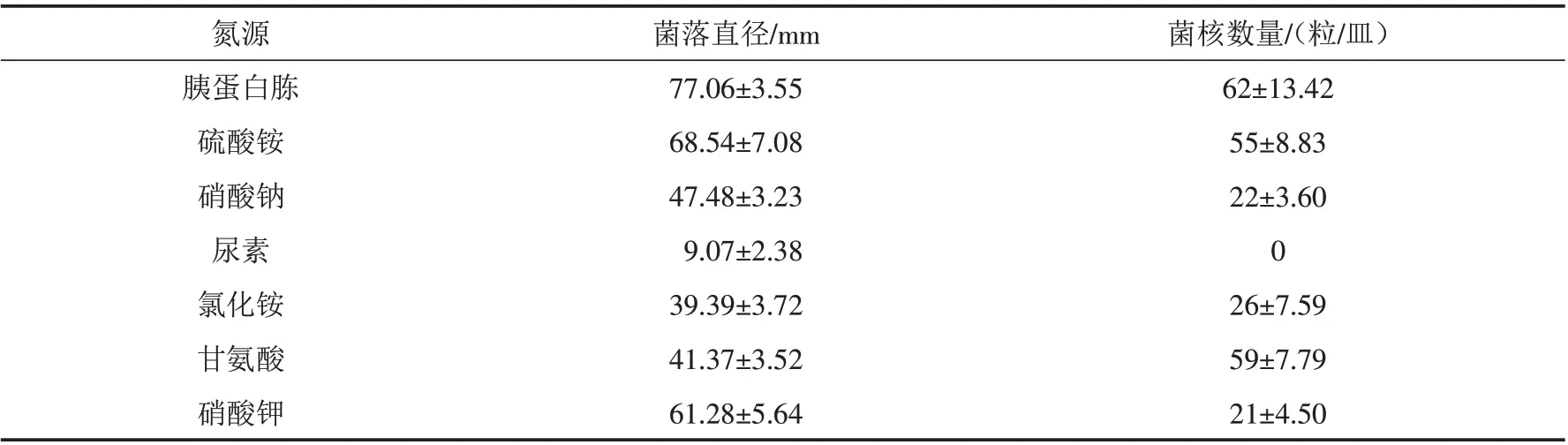
表3 不同氮源对病原菌RS-1菌丝生长及菌核形成的影响Tab.3 Effects of nitrogen sources on growth and sclerotia formation of S.rolfsii RS-1
2.4.4 菌核致死温度的测定 实验结果表明,RS-1菌核经45 ℃水浴处理10 min后,菌核能正常萌发,萌发率为84%. 温度升到50 ℃时,菌核萌发率下降到22%. 菌核经55 ℃和60 ℃水浴处理后萌发率为0. 由此可知,菌核的抑制萌发温度为55 ℃,时间为10 min.
2.5 室内药剂毒力测定
实验用的8种杀菌剂对白绢病病菌的室内毒力测定结果见表4. 由表4可知,戊唑醇对白绢病病菌的菌丝生长抑制作用最强,EC50值最小,为0.462 9 mg/L. 其次是氟菌唑和丙森锌,EC50值分别为12.177 0 mg/L和14.235 0 mg/L. 多菌灵对病菌的抑制作用最差,EC50值最大,为38.128 6 mg/L.
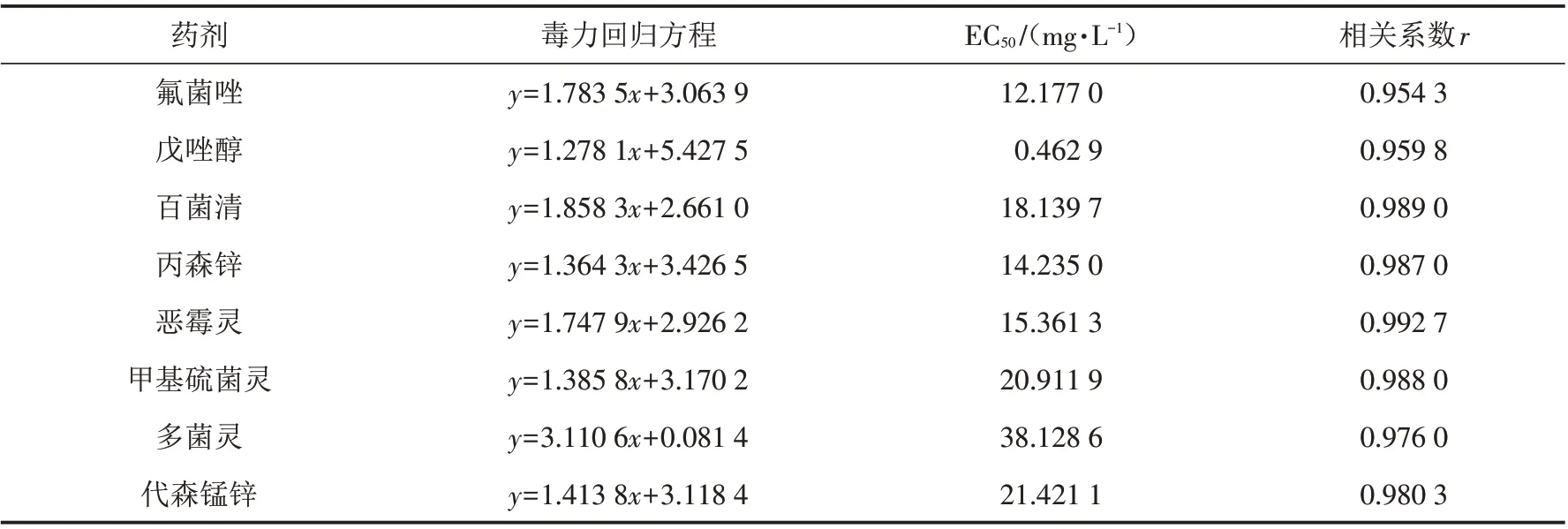
表4 8种药剂对白绢病菌RS-1的室内毒力测定结果Tab.4 Toxicity of eight fungicides towards S.rolfsii RS-1
3 结论与讨论
花生白绢病是世界范围内危害严重的一种土传真菌病害,目前还没有行之有效的防治办法. 早在20世纪六七十年代,河南省就有花生白绢病发生的报道,由于当时未造成严重危害,所以并未引起人们的重视.近年来,河南开封、驻马店等花生产区白绢病危害严重,发病严重地块发病率可达80%以上,有些地块甚至颗粒无收. 从河南省汝南县花生病株上分离到白绢病病原菌RS-1,并通过科赫法则验证了其致病性. 根据病菌的形态特征和rDNA-ITS序列的分析结果,将引起花生白绢病的病原菌RS-1鉴定为罗氏阿太菌(A.rolfsii),其无性态为齐整小核菌(S.rolfsii). 这与傅俊范等[14]分离的辽宁花生白绢病的病原菌相一致. 二者对温度的要求非常接近,菌丝的最适生长温度均为30 ℃,都在25 ℃时产生最多的菌核. 张翠英[15]对引起云南玄参白绢病的病原菌进行了鉴定,经鉴定病原菌同样为齐整小核菌. 与菌株RS-1相比,二者的生物学特性十分接近,在低于10 ℃的环境下均不能正常生长,菌丝的最适生长温度均为30 ℃等. 两者的菌丝生长范围稍有不同,花生白绢病病菌的生长范围为10~35 ℃,玄参白绢病病原菌的生长范围为13~40 ℃. 生长pH方面,二者的最适pH均为6.0,这也与前人研究的辣椒白绢病[16]和韭菜白绢病[17]病菌的最适生长pH一致. 白绢病菌随着培养基pH值增加,生长逐渐变慢,说明病菌喜好酸性土壤环境,防治该病时可以施用碱性肥料调节土壤的酸碱性,达到抑制病菌生长的效果.
花生白绢病对7种供试碳源的利用有较大差异. 在以山梨醇和甘露醇为碳源的培养基上病菌生长速度最快,淀粉、葡萄糖、麦芽糖次之,对半乳糖的利用效果最差. 但是却在半乳糖培养基上形成了最多数量的菌核,而在以淀粉、葡萄糖、麦芽糖为培养基碳源时,病菌不能形成菌核,这说明白绢病菌在菌丝生长阶段和菌核形成阶段所需的碳源有较大不同,在菌核形成阶段所需的碳源条件更为苛刻. 花生白绢病在供试的7种氮源上均能生长,对胰蛋白胨的利用效果最好,此时也能产生更多的菌核,说明病菌在菌丝生长阶段和菌核形成阶段所需的氮源较一致. 病菌在以尿素为氮源的培养基上生长非常缓慢,且不能产生菌核,这一结果与前人的报道相一致[18],这可能与尿素的碱性性质有关.
本文研究了8种市售药剂对白绢病病菌的室内毒力效果,结果表明戊唑醇对病菌的抑制效果最好,EC50值最小,为0.462 9 mg/L. 作为一种三唑类甾醇脱甲基抑制剂,戊唑醇具有低毒、杀菌普广、持效期长的特点,抗真菌活性极高,且对环境友好,可作为防治白绢病的首选用药. 氟菌唑、丙森锌和恶霉灵对白绢病菌也具有较好的抑制效果,可作为备选用药. 谢瑾卉等[19]研究了9种杀菌剂对花生白绢病的室内抑制效果,结果表明三唑类杀菌剂己唑醇EC50值最小,对白绢病菌的毒力最强. 同为三唑类药剂,戊唑醇和己唑醇对病菌的作用机制均为抑制其细胞膜上麦角甾醇的去甲基化,使得病菌无法形成细胞膜,从而杀死病菌[20]. 在实际生产中,可对以上几种杀菌剂进行轮换、复配用药,以达到最佳防治效果.
