ESD与EMR对早期胃癌及癌前病变患者血清EGF、Livin、hs-CRP水平的影响
2021-05-08陆游
陆 游
(上海市青浦区中医医院消化内科,上海 201700)
胃癌是常见消化道肿瘤,早期胃癌患者无典型性体征及临床表现,仅表现为上腹部不适感,大部分患者病情确诊时已经处于中晚期而错过了最佳治疗时机[1]。目前内镜技术获得了长足的发展,早期胃癌及癌前病变早期诊断率获得了较大的提高。以往临床上主要以外科手术作为治疗手段,内镜下黏膜切除术(EMR)为临床治疗该疾病的常用术式,取得一定的临床效果,但其在临床上具有一定的局限性,对于直径较大的病灶难以完全切除。内镜黏膜下剥离术(ESD)能将病灶组织从黏膜上精确剥离,对于大直径病灶也有较好的切除效果,可有效弥补EMR治疗的不足之处[2]。本研究旨在探讨ESD与EMR对早期胃癌及癌前病变患者血清表皮生长因子(EGF)、抗凋亡因子(Livin)、超敏-C反应蛋白(hs-CRP)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2017年7月至2019年8月在上海市青浦区中医医院接受治疗的72例早期胃癌及癌前病变患者的临床资料,按治疗方式的不同分成EMR组(31例)与ESD组(41例)。纳入标准:符合《腹腔镜胃恶性肿瘤手术操作指南(2007版)》[3]中的相关诊断标准者;均经术前胃镜检查、术后病理检查等确诊为早期胃癌及癌前病变者等。排除标准:术前心电图以及血常规、凝血功能检查异常者;合并其他恶性肿瘤者;合并其他严重躯体性病变者;存在严重内镜检查或者治疗禁忌证者等。EMR组患者中早期胃癌25例(病灶位于胃窦底部者12例、胃体部者4例、胃底贲门部5例,其他4例),癌前病变6例;其中男性18例,女性13例;年龄31~75岁,平均(50.45±5.07)岁。ESD组患者中早期胃癌33例(病灶位于胃窦底部者16例、胃体部者7例、胃底贲门部6例,其他4例),癌前病变8例;其中男性24例,女性17例;年龄29~77岁,平均(51.37±4.98)岁。两组患者一般资料经比较,差异无统计学意义(P>0.05),组间具有可比性。研究经院内医学伦理委员会批准。
1.2 方法 EMR组患者采用EMR治疗,将内镜插入患者胃内并将甘油果糖注射于癌灶周围黏膜下以使病灶充分隆起,将内镜退出,然后于前端安装透明帽并在透明帽内放置高频圈套器,再次插入内镜并对准病灶黏膜,将病灶负压吸入透明帽内,将圈套器收紧并套住病灶,然后将病灶切除。分次切除较大病灶,应用金属夹或者电凝等方式对出血创面进行止血处理。将切除病理标本置于10%甲醛固定液中及时送检。ESD组患者采用ESD治疗,对患者全麻后实施心电监护与吸氧支持。在与病灶边缘相距约5 mm处应用Dual刀作2 mm电凝标记,在病灶边缘标记点外侧黏膜下应用注射针多点注射甘油果糖、美蓝、肾上腺素混合液,注射剂量为2 mL/次,病灶隆起后应用一次性黏膜切开(Dual)刀将胃黏膜切开并行黏膜下层剥离操作,对渗血创面实施止血操作,一旦有出血、穿孔等现象发生需要立即应用金属钛夹进行夹闭操作,若创面无活动性出血现象即可将内镜退出。两组患者均术后观察1个月。
1.3 观察指标 ①比较两组患者整块切除率,完全切除率及治愈性切除率,其中整块切除:病灶一次性整块切除;完全切除:病灶切除完整,且未在切除边缘发现残存肿瘤细胞;治愈性切除:病灶完全切除且未见肿瘤细胞转移[4]。②记录两组患者临床指标,包括术中出血量、手术时间、切除病灶直径及住院时间。③抽取两组患者术前与术后1个月3 mL空腹静脉血,采用血液分析仪检测两组患者血清表皮生长因子(EGF)、血清抗凋亡因子(Livin)及超敏-C反应蛋白(hs-CRP)水平。④比较两组患者并发症发生率(术中出血、术中穿孔、术后感染、腹腔脏器粘连)。
1.4 统计学方法 采用SPSS 23.0统计软件进行数据统计和分析,计量资料以(x±s)表示,采用t检验;计数资料以[例(%)]表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 ESD组患者整块切除率、完全切除率及治愈性切除率均高于EMR组,差异均有统计学意义(均P<0.05),见表 1。
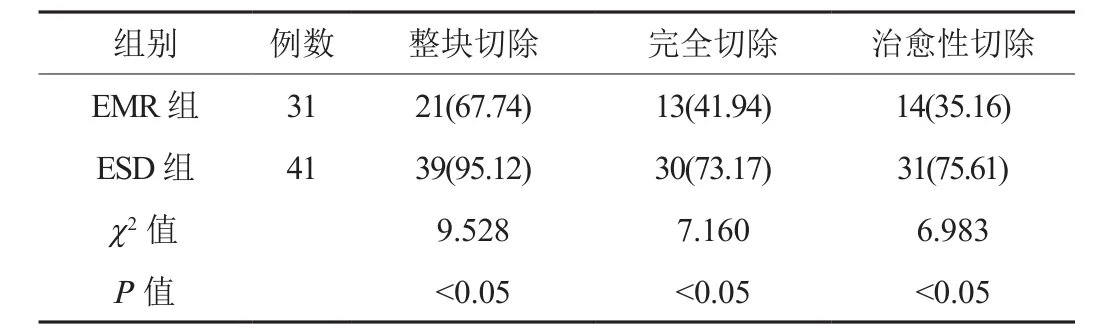
表1 两组患者临床疗效比较[例(%)]
2.2 临床指标 ESD组患者术中出血量少于EMR组,手术时间、住院时间长于EMR组,切除病灶直径大于EMR组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者临床指标比较( ±s)

表2 两组患者临床指标比较( ±s)
住院时间(d)组别 例数 术中出血量(m L)手术时间(m i n)切除病灶直径(m m)E M R 组 3 1 8 5.8 4±7.3 6 4 7.8 6±1 4.3 8 1 5.3 4±4.2 7 9.3 9±2.3 4 E S D 组 4 1 6 7.3 9±7.2 8 5 9.4 6±1 5.3 9 3 2.0 9±4.3 5 1 2.4 7±2.2 6 t值 1 0.5 9 8 3.2 5 7 1 6.3 0 6 5.6 4 0 P值 <0.0 5 <0.0 5 <0.0 5 <0.0 5
2.3 血清EGF、Livin、hs-CRP水平 术后1个月两组患者血清EGF、Livin、hs-CRP水平均较术前降低,且ESD组低于EMR组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者血清EGF、Livin、hs-CRP水平比较( ±s)
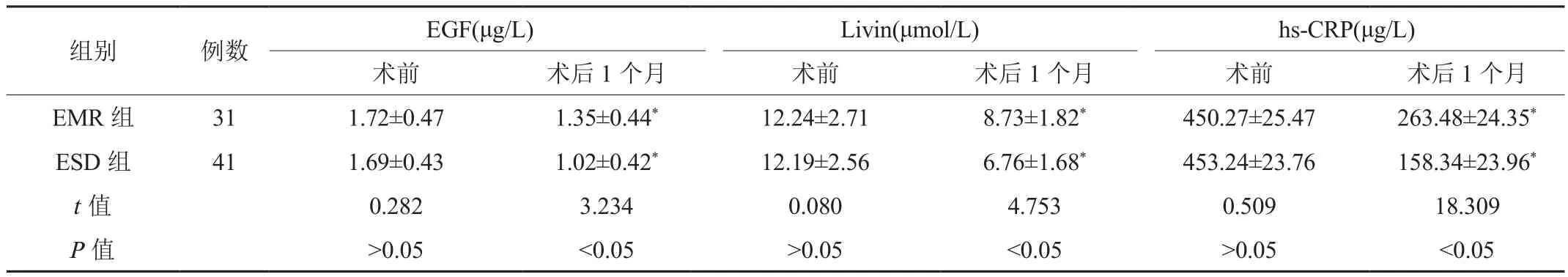
表3 两组患者血清EGF、Livin、hs-CRP水平比较( ±s)
注:与术前比,*P<0.05。EGF:表皮生长因子;Livin:血清抗凋亡因子;hs-CRP:超敏-C反应蛋白。
组别 例数 EGF(μg/L) Livin(μmol/L) hs-CRP(μg/L)术前 术后1个月 术前 术后1个月 术前 术后1个月EMR 组 31 1.72±0.47 1.35±0.44* 12.24±2.71 8.73±1.82* 450.27±25.47 263.48±24.35*ESD 组 41 1.69±0.43 1.02±0.42* 12.19±2.56 6.76±1.68* 453.24±23.76 158.34±23.96*t值 0.282 3.234 0.080 4.753 0.509 18.309 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 并发症 ESD组患者并发症总发生率低于EMR组,差异有统计学意义(P<0.05),见表4。
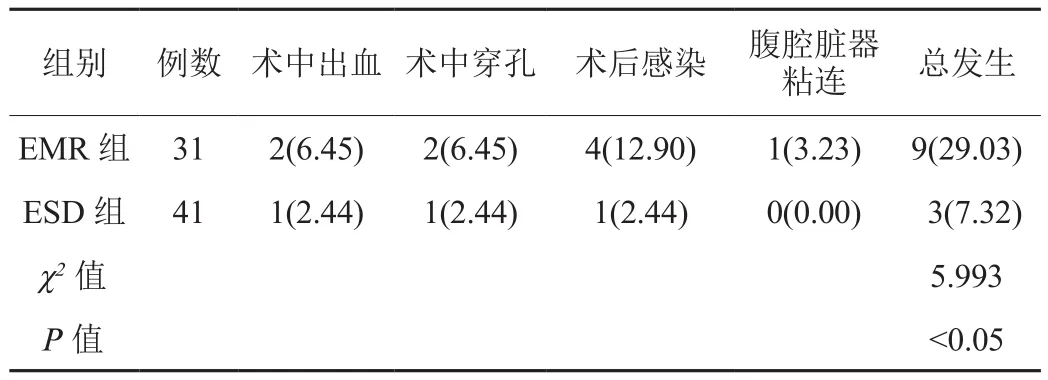
表4 两组患者并发症发生率比较[例(%)]
3 讨论
对早期胃癌及癌前病变患者进行早诊断、早治疗对于提高其远期生存率至关重要。传统胃癌切除手术创伤大,影响患者术后康复质量。近年来随着内镜检查技术不断进步和完善,胃癌早期检出率不断升高,对于存在较低淋巴结转移风险的早期胃癌或者癌前病变患者采用部分胃黏膜内镜切除术可有效减轻创伤并促进其预后改善。临床常用EMR治疗该疾病,但是因其切除病灶的不完整性,故需要寻找可剥离更大病灶组织的手术方式[5]。
ESD技术在剥离胃黏膜过程中需采用边注射边剥离的方式,操作难度明显增加,耗费时间也随之增多。但是ESD病灶整体切除率更高,有助于延长患者生存期,而且将整块病灶完整切除也有利于临床准确进行病理评估,便于对患者癌灶转移风险作出准确判断[6]。随着ESD手术器材的研发和手术者操作技术的熟练掌握,手术时间会进一步缩短,可有效降低手术过程中风险的发生[7]。本研究结果显示,ESD组患者整块切除率、完全切除率及治愈性切除率均高于EMR组,ESD组患者术中出血量少于EMR组,手术时间、住院时间长于 EMR组,切除病灶直径大于EMR组,ESD组患者并发症总发生率低于 EMR组,表明ESD对早期胃癌和癌前病变患者具有较高的病灶切除率,且安全性较好。
EGF与肿瘤细胞的增殖及黏附有关,其会在胃癌组织中高度表达,血清EGF水平越高,表明胃癌进展越严重;Livin属于重要抗细胞凋亡因子,可阻断线粒体及凋亡受体相关途径,抑制细胞凋亡,其会在胃癌患者机体内高表达;hs-CRP属于全身炎症反应急性期非特异性标志物,主要由肝脏合成,一旦身体出现炎症反应便会导致血清hs-CRP水平升高,早期胃癌和癌前病变患者的病情进展越严重其血清hs-CRP水平越高[8]。ESD可完全切除患者病灶组织,且保留正常组织的相关功能,可有效降低肿瘤基因的高表达,减少机体EGF、Livin含量,缓解组织因肿瘤细胞浸润造成的损伤,减轻机体炎症反应[9]。本研究结果显示,术后ESD组患者血清EGF、Livin、hs-CRP水平低于EMR组,表明ESD可有效减轻患者机体炎症反应,抑制肿瘤组织的浸润。
综上,ESD对早期胃癌及癌前病变患者具有较高的病灶切除率,减轻患者机体炎症反应,抑制肿瘤组织的浸润,且安全性好,值得临床推广应用。
