fPSA%、PSAD、proGRP水平对前列腺癌及骨转移的诊断价值
2021-04-28段云康钰龄郑虹蕾徐蓉生
段云 康钰龄 郑虹蕾 徐蓉生
(四川省肿瘤医院核医学科,四川 成都 610041)
前列腺癌(Prostate Cancer,PCa)为泌尿系统最常见的恶性肿瘤之一,在男性中是第二高的癌症发病率和第五大癌症死因[1], 且近年来国内PCa的发病率逐年增高。PCa涉及的风险因素有年龄、种族、家族史、胰岛素样生长因子、生活方式、饮食、环境和职业曝光[2]。PCa的预后与肿瘤转移有关,其中80%为骨转移[3]。因此,早期诊断、提高患者生存率对医生和患者尤为重要。血清前列腺特异性抗原(PSA)是PCa筛选和监测最常用指标,根据2020版欧洲泌尿外科协会(European Urological Association,EAU)指南,发现近年来尽管有多种新型的肿瘤标志物被应用于PCa的早期诊断,但目前均只能作为对PSA检查的补充[4]。对于PSA值为4~10 ng mL诊断灰色区域中,PSA敏感性不高,Barisiene、Fan等[5-8]认为前列腺癌特异抗原前体(proPSA)、前列腺特异性抗原同源异构体(p2PSA)、游离PSA(fPSA)、PSA 密度(PSAD)、PSA速率(PSAV)等PSA衍生指标对PCa早期诊断、监测、预后有帮助。
本研究回顾性分析了PCa患者与前列腺增生(Benign Prostatic Hyperplasia,BPH)患者的的临床特征和肿瘤标志物fPSA%、PSAD、proGRP及其组合的敏感性、特异性和接受者操作特征(ROC)的比较,并探讨上述3种肿瘤标志物在PCa诊断和预测骨转移中的价值,旨在评估肿瘤标志物是否与PCa诊断以及骨转移发生的风险有关。
1 资料与方法
1.1 一般资料 选取2016年4月~2019年11月在我院均为首次就诊的108例PCa全身骨显像患者为研究对象,并作为观察组,均为男性,年龄46~88岁,平均(65.43±15.76)岁。在骨显像检查时,所有患者没有接受任何抗肿瘤治疗或手术切除,经全身骨显像结合临床表现及其它影像学检查诊断结果,将观察组分为骨转移(Bone Metastasis,BM)63例、无骨转移(No Bone Metastasis,NBM)45例两个亚组。纳入标椎:①患者有详细影像学资料支持(MRI、超声等),组织学检查确定为PCa。②入组PCa Ⅳ期的患者伴有骨转移。③无其它重要功能障碍者。排除标准:①不符合纳入标准者。②合并有其它恶性肿瘤者。③自身免疫性疾病患者、长期或近期服用激素。另选取25例BPH者为对照组,均接受了B超、MRI检查和实验室检测,并病理证实以排除肿瘤。所有患者均检查了临床症状、疾病征象以及血清肿瘤标志物水平,临床特征从电子记录中获得。根据肿瘤、淋巴结及TNM分期对患者进行分类,以表征每位患者的PCa。本研究经医院伦理委员会批准。
1.2 血清学检测方法 所有受检者清晨空腹抽取静脉血3 mL,分离血清,采用罗氏诊断医疗设备(上海)有限公司cobas e 411全自动化学发光免疫仪测定PSAD、fPSA%(fPSA%=fPSA/tPSA×100%)、proGRP水平。所用检测试剂均为相应配套试剂,严格按照说明书操作。各指标的正常参考范围:PSA (0~4 ng/mL),fPSA%(>16)[9],proGRP(0~30 U/mL)。
1.3 PSAD测定方法 前列腺体积测定使用彩色经直肠多普勒超声测定前列腺左右径(D1)、上下径(D2)及前后径(D3),计算前列腺体积(V=D1×D2×D3×0.52),PSAD(PSAD=tPSA/V)。PSAD<0.15 ng/mL/cm3为正常临界值[9]。
1.4 全身骨显像诊断 显像设备:SIEMENS Symbia Intevo 16双探头SPECT/CT,CT为具备诊断功能的16排螺旋CT。肿瘤患者多发骨转移诊断:SPECT检查出现多发代谢增高灶;肿瘤患者单发骨转移诊断:SPECT检查出现单发代谢增高灶+同部位CT密度改变+/同部位MRI信号异常。

2 结果
2.1 患者临床病理特征和肿瘤标志物水平 观察组平均年龄水平高于对照组,差异有统计学意义(P<0.05)。观察组ALP、LDH水平高于对照组,差异有统计学意义(P<0.05)。两组血清肌酐(CREA)水平无显著性差异(P>0.05)。观察组的PSA、PSAD、proGRP水平明显高于对照组,fPSA%水平明显低于对照组,差异有统计学意义(均P<0.05),见表1。
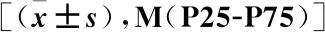
表1 患者临床特征和生物标志物水平
2.2 肿瘤标志物fPSA%、PSAD、proGRP的诊断前列腺癌价值比较 108例PCa患者中,根据美国癌症分期联合会前列腺癌第8版,TNM分期Ⅰ、Ⅱ、Ⅲ期45例(41.66%),Ⅳ期63例(58.33%)。ROC曲线分析结果显示,联合检测(fPSA%+PSAD+proGRP)诊断PCa的AUC值最大(AUC=0.809),高于各项指标单独检测;每个指标诊断能力均有显著性差异(P<0.001),见表2、图1。
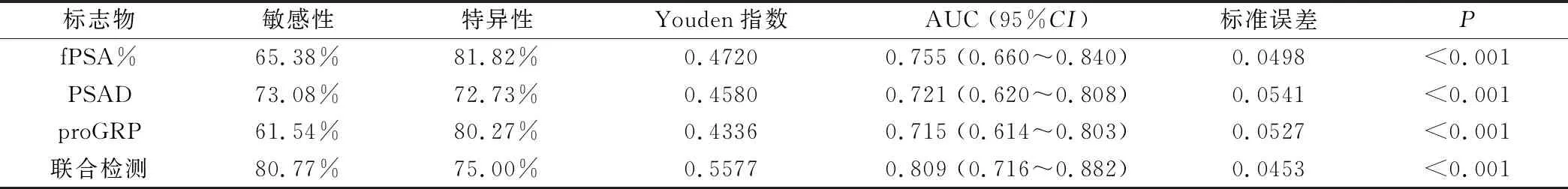
表2 PCa患者fPSA%、PSAD、proGRP的ROC分析结果
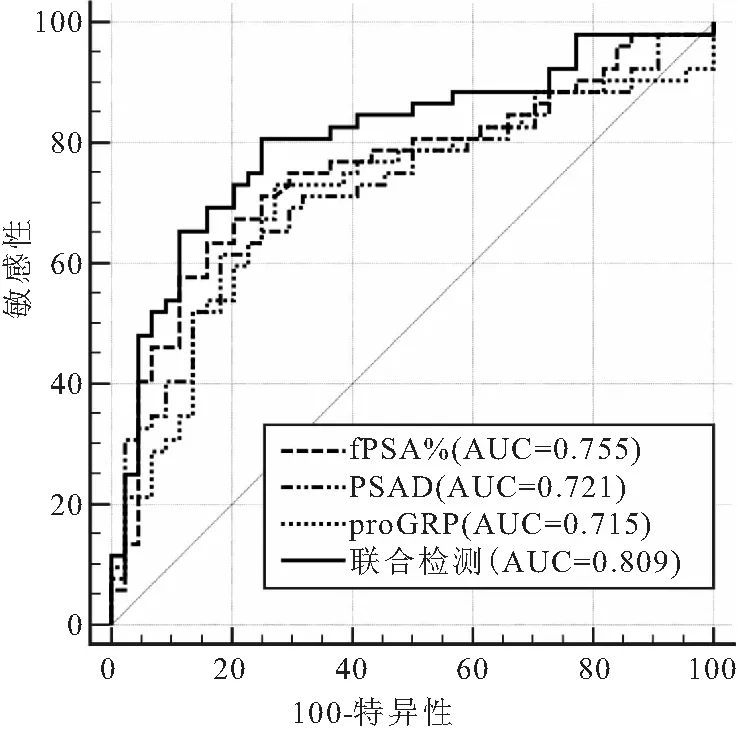
图1 具有将PCa患者与BPH分开的诊断能力
2.3 肿瘤标志物PSA、fPSA%、PSAD、proGRP在前列腺癌NBM、BM组与对照组的诊断价值比较 由于PSA在4~10 ng/mL存在诊断灰区,故重点关注fPSA%、PSAD、proGRP对于区分BPH与PCa(Ⅰ、Ⅱ、Ⅲ期)NBM的诊断能力。ROC曲线分析结果显示,联合检测(fPSA%+PSAD+proGRP)诊断PCa(早中期)的AUC最大(AUC=0.733),高于其它各项单独检测指标;fPSA%、PSAD、proGRP及联合检测诊断能力均有显著性差异(P<0.05)。PSA的诊断能力无统计学意义(P>0.05)。根据Youden指数,分别定义fPSA%、PSAD、proGRP诊断PCa(NBM)最佳临界值,发现三种肿瘤标志物均有较高敏感性、特异性、阳性和阴性预测值,见表3、图2。
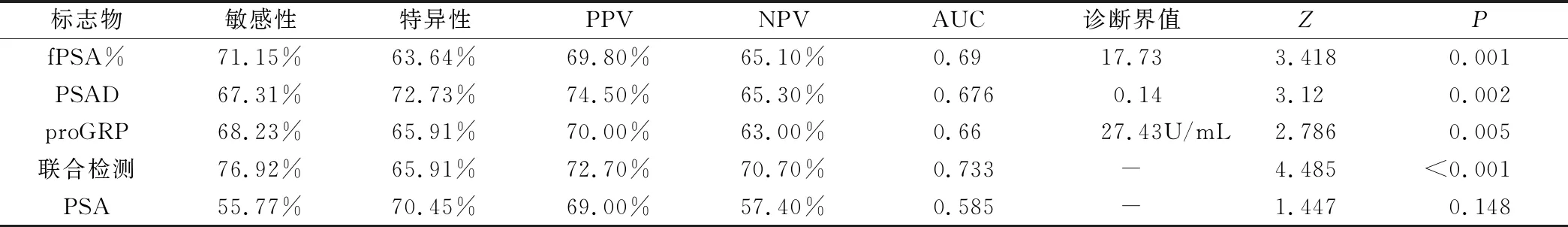
表3 PCa(NBM)患者fPSA%、PSAD、proGRP的ROC分析结果
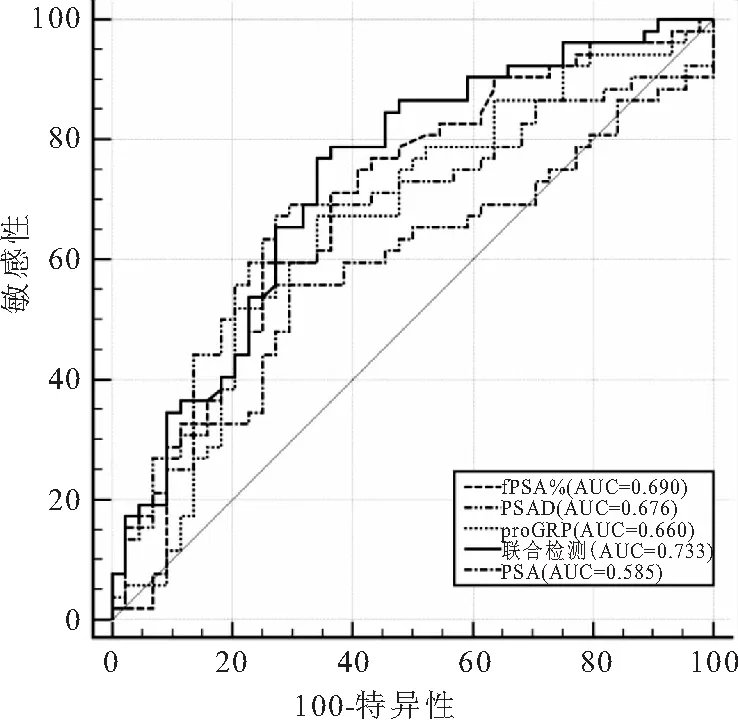
图2 具有将PCa(NBM)患者与BPH分开的诊断能力
ROC曲线分析结果显示,血清PSA诊断PCa(晚期)的AUC最大(AUC=0.926),高于其它指标,五种指标诊断能力均有显著性差异(P<0.001)。根据Youden指数,分别定义fPSA%、PSAD、proGRP诊断PCa(BM)最佳临界值,发现三种肿瘤标志物均有较高的敏感性、特异性、阳性和阴性预测值,见表4、图3。
3 讨论
PCa的早期诊断可以确保实施治愈治疗,对于PCa骨转移高危人群给予干预措施,可改善患者的生活质量,提高患者生存率。故本研究进行了标志物PSA、PSA衍生物(fPSA%、PSAD)及proGRP的对照研究。
本研究观察组年龄高于对照组,差异有统计学意义(P<0.05),表明随着年龄增长,老年男性PCa发病率上升,这与全球疾病负担癌症合作[1]分析前PCa发病率的上升有42%因素归结于人口的老龄化观点一致。
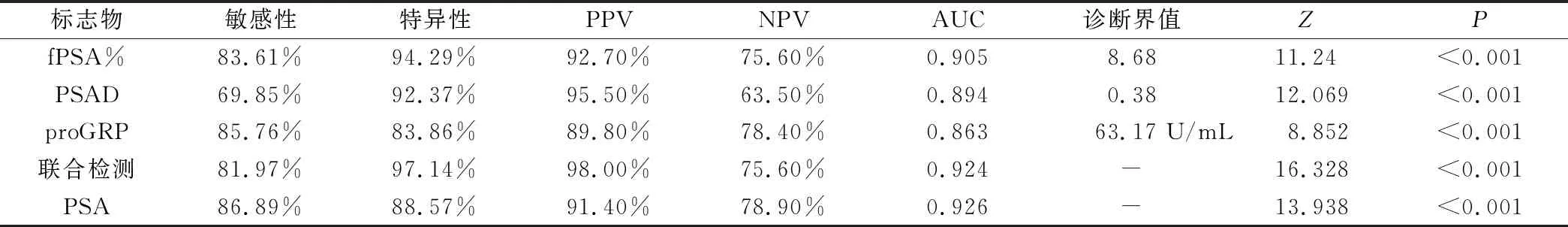
表4 PCa(BM) 患者fPSA%、PSAD、proGRP的ROC分析结果
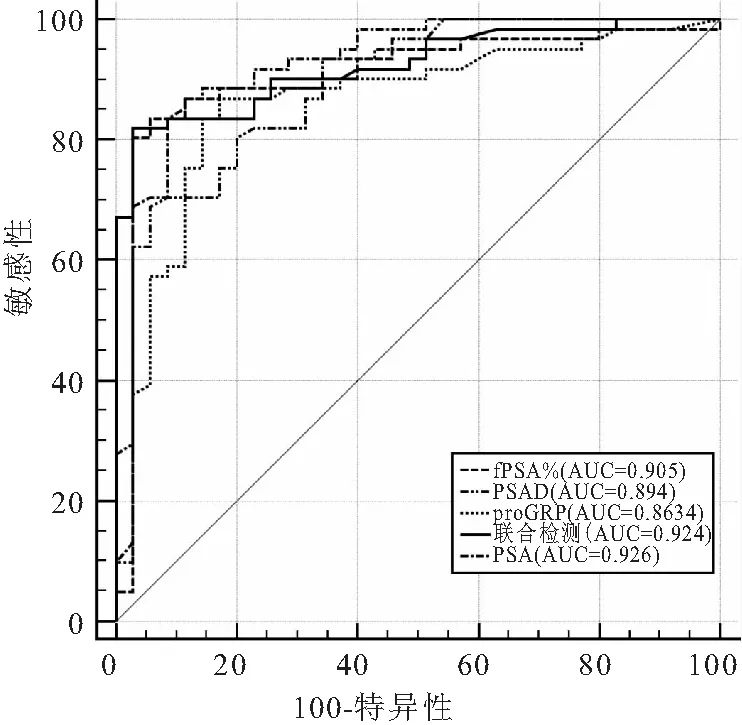
图3 具有将PCa(BM)患者与BPH分开的诊断能力
本研究中观察组的实验室指标值ALP、LDH高于对照组,差异有统计学意义(P<0.01)。ALP升高主要与骨转移有关,LDH的升高主要与肿瘤的代谢、侵袭、转移有关[10]。Yordanova[11]分析了137例前列腺癌患者ALP、骨特异性碱性磷酸酶(BAP)、PSA、LDH、嗜铬粒蛋白A和pro -GRP显著升高,并确定基线ALP(临界值120 U / L),LDH(临界值248 U/L)与患者生存率显着相关。
PSA是前列腺相关的一种抗原,由前列腺上皮细胞分泌产生的丝氨酸蛋白酶。fPSA为游离前列腺特异抗原,占总前列腺特异抗原(tPSA)的10%~30%,前列腺炎、良性前列腺增生和PCa均可导致tPSA和fPSA水平升高,fPSA%=fPSA/tPSA×100%,fPSA的百分比低,提示患PCa的可能性较高;PSAD为血清PSA的浓度与前列腺体积的比值,PSAD≤0.15时一般不会有恶性病变存在,但>0.15时,患PCa的危险性增高;proGRP是胃泌素释放肽前体,主要分布神经系统、胃肠道和肺部,在小细胞肺癌显著升高。Barisiene、Schulze[5, 12]等认为前列腺健康指数(phi)和phi密度(PHID)作为独立生物标志物预测高级前列腺上皮内瘤变的诊断潜力(HGPIN)。Foj[13]认为tPSA、%fPSA、PHI变化与侵袭性PCa有关,Vezyraki[14]比较PSA、fPSA%在PCa分级(2~5级)有显著性差异。本研究fPSA%、PSAD和proGRP的AUC值分别为0.755、0.721、0.715,与学者[15-16]研究接近,提示fPSA%、PSAD和proGRP可以作为PCa诊断的重要参考指标。本研究将fPSA%、PSAD和proGRP三项指标联合检测,ROC曲线结果显示AUC值为0.809,敏感性为80.77%,特异性为75.00%,与学者[15-16]研究接近,提示联合检测在PCa诊断中比单项检测更具有诊断价值。
学者Foj[13, 17]认为fPSA%、PSAD、proGRP等与PCa的原发组织和转移相关。本研究重点关注了fPSA%、PSAD、proGRP在BPH对NBM的PCa(早中期)的比较,结果显示联合检测的AUC值最高(AUC=0.733),fPSA%、PSAD、proGRP的AUC值分别为0.690、0.676、0.660,与学者[5, 18-20]研究接近, 表明联合检测有助于早期发现PCa。PSA的AUC值为0.585,P=0.147,说明PSA在PCa早期诊断不敏感,与众多学者观点一致[17-20]。国内学者认为通过尿液中趋化因子(C-X-C基元)配体16(CXCL16)以及穿刺活检结合PSA、 PSAD、fPSA%可以提高早期PCa的检出率[21-23]。使用PSAD、fPSA%、proGRP最大截断值,区分早中期PCa均有较高敏感性、特异性、阳性和阴性预测值,通过对最大截断值判断有助于对PCa早期诊断早期治疗。
本研究结果显示PSA的AUC值最大,为0.926,表明PSA对晚期PCa骨转移诊断能力最大,与目前肿瘤标志物无法替代PSA观点一致[4]。fPSA%、PSAD、proGRP的AUC值分别为0.905、0.894、0.863,与学者[5, 16-18]研究接近。使用fPSA%、PSAD、proGRP最大截断值,区分晚期PCa(骨转移)均有较高敏感性、特异性、阳性和阴性预测值,通过对最大截断值判断有助于对PCa预后预测,减少或延迟骨转移事件的发生。近年来基于前列腺特异性膜抗原(PSMA)放射性核素示踪剂(68Ga-PSMA、18F- PSMA、68Ga- PSMA、177Lu-PSMA、99mTc-PSMA))对PCa成像诊断和177Lu-PSMA PCa骨转移治疗取得满意结果[24],为PCa及骨转移早期诊断早期治疗提供了新的手段。
尽管近年来早期诊断PCa的标志物报道较多,目前均不能替代PSA的作用。根据2020年EAU诊疗指南,在PCa早期诊断方面,推荐年龄>40岁且携带有BRCA2基因突变的男性定期行PSA筛查、年龄介于40~69岁的男性每年筛查PSA1次,若PSA>3.0 ng/mL,则行前列腺穿刺,携带有BRCA2基因突变的男性,推荐评估前列腺mpMRI检查结果并及时与病理结果比对,但不推荐前列腺mpMRI作为初始筛查检查[4]。
本研究存在以下限制:为回顾性收集,数据在单个中心获得,研究人群小及入组患者标准有一定局限性。
4 结论
fPSA%、PSAD和proGRP是诊断早期PCa和预测预后有用的肿瘤标志物。将三种肿瘤标志物联合检测可提高诊断性能,随着TNM分期的进展,肿瘤标志物fPSA%、PSAD和proGRP的诊断能力越明显。
