MicroRNA-182-5p对高糖诱导内皮细胞损伤的影响*
2021-04-28崔元生尚祥李龙彪刘建雄陈阵许舒国
崔元生 尚祥 李龙彪 刘建雄 陈阵 许舒国
(1.宁德师范学院附属宁德市医院介入科,福建 宁德 352100;2.武汉市中心医院急诊科,湖北 武汉 430014)
糖尿病是一种严重危害人体健康的常见慢性病。最新研究显示,我国糖尿病加权患病率为11.2%,患者人数达1.56亿,约占全球糖尿病总人数1/4。2017年,我国与糖尿病相关的医疗保健费用高达1100亿美元,居全球第二[1]。糖尿病血管病变是糖尿病慢性并发症的主要表现,其是由于慢性高血糖状态及继发的各种病理、生理改变而导致的系统或局部的血管损伤,是糖尿病患者致死、致残的主要原因[2]。内皮细胞位于血管壁内层,长期直接暴露于高血糖刺激,因此人们认为内皮损伤是糖尿病血管病变的始动环节[3]。在高糖刺激下,内皮细胞抗氧化能力降低并产生大量反应活性氧(Reactive Oxygen Species,ROS),引起内皮氧化应激损伤和细胞死亡[4-5]。MicroRNAs是一类存在于真核生物中的非编码单链小分子RNA,参与调控机体多种病理生理过程,包括血管稳态[6-8]。MicroRNA-182-5p(miR-182-5p)在内皮细胞中有很高的表达水平,但其在高糖诱导的内皮细胞氧化应激和死亡中作用尚不明确[9]。本研究通过建立高糖诱导的内皮细胞损伤模型,旨在探讨miR-182-5p对高糖诱导的内皮细胞损伤的作用及可能机制。
1 材料与方法
1.1 材料 人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells,HUVECs)购自美国ATCC公司;miR-182-5p的mimic、inhibitor及其对照,SIRT1小干扰RNA(Small interfering RNA against SIRT1,siSIRT1)购自广州锐博生物科技有限公司;CCK-8试剂盒购自日本东仁化学科技有限公司;DMEM培养基(正常糖5.5 mmol/L和高糖25 mmol/L)、胎牛血清和0.25%胰蛋白酶溶液购自美国GIBICO公司;总超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,Gpx)、胱天蛋白酶-3(Caspase-3)、乳酸脱氢酶(Lactate dehydrogenase,LDH)活性检测试剂盒和2′, 7′-二氯荧光黄双乙酸盐(2′, 7′-dichlorofluorescin diacetate,DCFH-DA)购自上海碧云天公司;3-硝基酪氨酸(3-nitrotyrosine,3-NT)和丙二醛(Malondialdehyde,MDA)、SIRT1抗体、β-actin抗体购自英国Abcam公司;逆转录试剂盒购自瑞典Roche公司。
1.2 实验分组 HUVECs在正常糖培养基中培养48 h,经饥饿处理12 h后随机分为5组:对照组细胞换含有19.5 mmol/L甘露醇的正常糖培养基继续培养24 h,高糖+mimic对照组细胞用高糖培养基培养并同时加入mimic对照试剂培养24 h,高糖+mimic组细胞用高糖培养基培养并同时加入mimic试剂(50 nmol/L)培养24 h,高糖+inhibitor对照组细胞用高糖培养基培养并同时加入inhibitor对照试剂培养24 h,高糖+inhibitor组细胞用高糖培养基培养并同时加入inhibitor试剂(50 nmol/L)培养24 h。为敲低内皮SIRT1表达,细胞先在无血清培养基中用siSIRT1转染试剂(50 nmol/L)处理24 h[10-12]。
1.3 酶活性、3-NT和MDA水平检测 细胞SOD、CAT、Gpx、Caspase-3、LDH酶活性,3-NT和MDA水平检测均参照试剂盒说明书进行。
1.4 CCK-8检测 细胞接种到96孔板并完成相应刺激后,换无血清培养基并加入10 μL/孔CCK-8试剂,将细胞放回37 °C培养箱继续避光孵育2 h,随后用酶标仪检测450 nm处吸光度值,每组设置5个复孔[13]。
1.5 细胞内 ROS水平检测 细胞刺激完成后换无血清培养基并加入5 μmol/L的DCFH-DA继续培养30 min,用PBS洗涤3遍后在激发波长为485 nm,发射波长为525 nm的酶标仪下检测[14]。检测过程中设置不含细胞的空白组,ROS水平(%)=(待测组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.6 实时荧光定量PCR 弃细胞培养基加入1 mL/孔TRIzol充分裂解细胞,Nanodrop 2000c检测RNA浓度和纯度,完成逆转录后按下列程序反应:95 ℃预变性2 min; 95 ℃×1 min,55 ℃×1 min,72 ℃×1 min,40个循环;72 ℃延伸7 min。以GAPDH为内参进行定量检测凋亡相关蛋白BAX和BCL-2的mRNA水平[15]。
1.7 免疫印迹 弃细胞培养基加入30 μL/孔裂解液,置于摇床上充分裂解20 min。用细胞刮将裂解液刮下后,转移到新EP管内,经超声裂解、离心,用BCA试剂盒校正蛋白浓度,最后煮沸变性分装保存[16]。蛋白分离采用SDS-PAGE电泳,待蛋白转移到PVDF膜后,经封闭、一抗和二抗孵育,用化学扫膜仪扫描并用ImageLab软件分析定量。
1.8 荧光素酶报告基因检测 将带有SIRT1野生型(Wild Type,WT)和突变型(Mutant,MUT)的3′-UTR基因序列构建到psi-CHECK2荧光素酶报告基因质粒(美国Promega公司)中,随后用脂质体6000将其转入内皮细胞并同时予以mimic刺激,转染48 h后收集细胞,用荧光素酶报告基因检测试剂盒检测荧光素酶活性[17]。

2 结果
2.1 miR-182-5p在高糖刺激的内皮细胞中表达上调 高糖刺激可增加内皮细胞miR-182-5p表达(P<0.05),且高糖刺激24 h的内皮细胞miR-182-5p水平和高糖刺激48 h无差异(P>0.05),见图1。
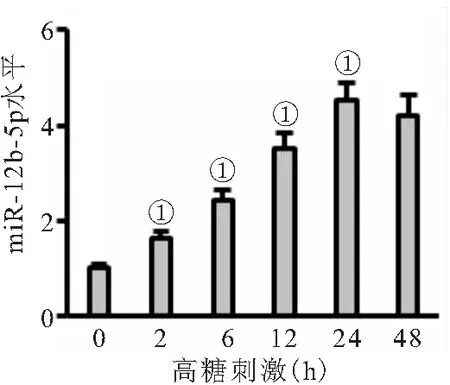
图1 miR-182-5p在高糖刺激的内皮细胞中表达上调
注:与对照组相比,①P<0.05
2.2 miR-182-5p mimic加重高糖诱导的氧化应激,而inhibitor改善高糖诱导的氧化应激 miR-182-5p mimic处理可显著增加高糖刺激下内皮细胞miR-128-5p表达水平,而inhibitor处理则抑制miR-128-5p表达,见图2。与对照组相比,高糖+mimic对照组细胞脂质及蛋白质氧化产物MDA和3-NT水平升高,抗氧化酶SOD、CAT和Gpx活性降低,ROS水平显著增加;而使用mimic处理后则进一步加重高糖诱导的内皮细胞氧化应激反应(均P<0.05)。与对照组相比,高糖+inhibitor对照组细胞ROS生成也增加,抗氧化能力减弱;而使用inhibitor处理后则显著减轻内皮细胞氧化应激水平(均P<0.05),见表1。
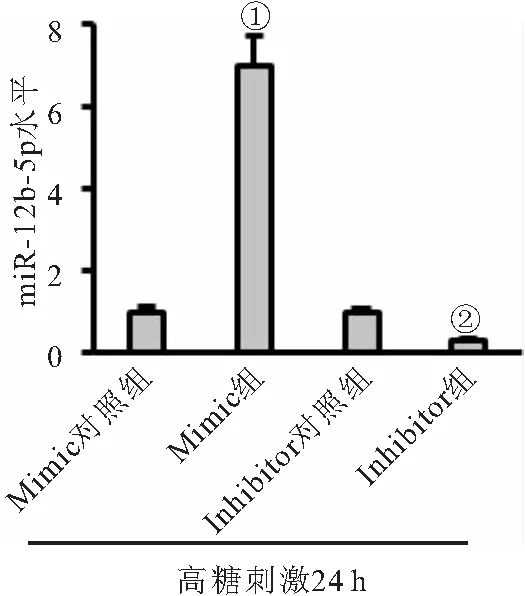
图2 miR-182-5p的mimic和inhibitor效率检测
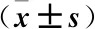
表1 各组氧化应激指标
2.3 miR-182-5p mimic促进高糖诱导的细胞凋亡,而inhibitor减轻高糖诱导的细胞死亡 与对照组相比,高糖+mimic对照组细胞明显损伤,表现为存活率降低、LDH释放增加;而mimic处理则进一步降低细胞存活率、增加LDH释放(均P<0.05)。与对照组相比,高糖+inhibitor组细胞存活率降低、LDH释放增加;而inhibitor处理则显著减轻细胞损伤(均P<0.05)。高糖刺激可增加内皮细胞Caspase-3活性,并上调促死亡蛋白BAX和抗死亡蛋白BCL-2的mRNA比值;mimic处理加重,而inhibitor处理改善高糖诱导的细胞凋亡(均P<0.05),见表2。
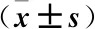
表2 各组细胞存活指标
2.4 miR-182-5p通过SIRT1发挥对内皮细胞的调控作用 在高糖刺激的内皮细胞中,miR-128-5p mimic可减少SIRT1蛋白水平,而inhibitor处理则增加SIRT1蛋白表达(P<0.05),见图3。inhibitor处理改善高糖诱导的内皮细胞氧化应激和细胞死亡;与高糖+inhibitor+siRNA组相比,高糖+inhibitor+siSIRT1组细胞ROS水平、氧化应激产物MDA和3-NT生成增加,LDH释放量也增多,而细胞存活率显著降低,即沉默SIRT1阻断miR-128-5p inhibitor介导的内皮保护效应(均P<0.05),见表3。
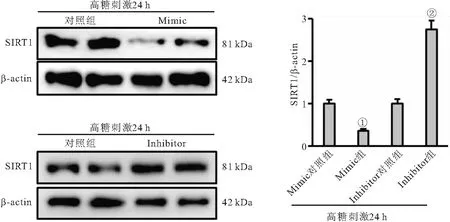
图3 miR-182-5p对SIRT1蛋白表达影响
表3 各组氧化应激和细胞存活指标
2.5 miR-182-5p直接结合到SIRT1的3′-UTR TargetScan软件预测发现miR-182-5p可直接结合到SIRT1的3′-UTR,见图4A。荧光素酶报告基因检测发现,miR-182-5p mimic处理抑制携带WT报告基因的荧光素酶活性(P<0.05),而对MUT组活性没有影响(P>0.05),见图4B。
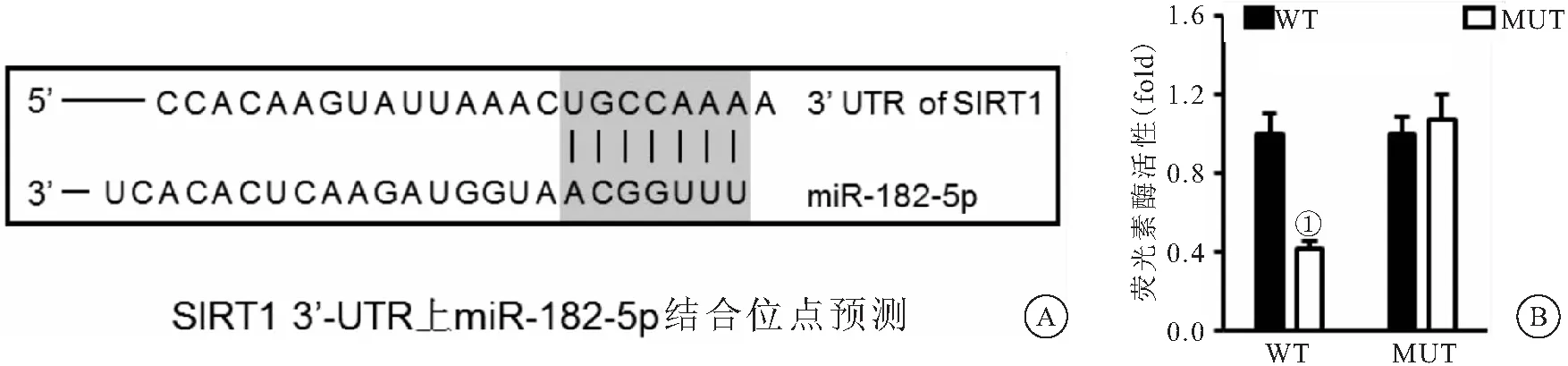
图4 miR-182-5p直接结合到SIRT1的3′-UTR
3 讨论
内皮细胞损伤是糖尿病血管病变的关键病理、生理过程。在长期高糖刺激下,内皮细胞抗氧化能力减弱,ROS大量堆积从而促进脂质和蛋白质等重要生物大分子发生氧化性损伤,诱发细胞死亡[2]。本研究发现,高糖刺激可降低内皮细胞抗氧化酶活性,细胞蛋白质和脂质分子氧化产物增加;相应地,高糖组内皮细胞LDH释放量增加、细胞存活率降低且凋亡比例显著增加。使用miR-182-5p mimic可加重高糖诱导的内皮细胞氧化应激和细胞死亡,而inhibitor处理则发挥显著的内皮保护效应。此外,软件预测结合荧光素酶实验证实miR-182-5p可直接结合到SIRT1的3′-UTR并抑制其蛋白表达,miR-182-5p inhibitor处理则恢复内皮细胞SIRT1水平。
SIRT1是Sirtuins家族重要成员,属于Ⅲ类组蛋白去乙酰化酶,在细胞增殖、分化、衰老和肿瘤发生等方面均有重要调控作用[18-19]。既往研究提示,SIRT1具有显著的抗氧化和细胞保护作用[20]。Matsui 等[21]发现,SIRT1活化可增加抗氧化转录因子NRF2蛋白表达和核聚集,从而增加细胞抗氧化活性。SIRT1可促进FoxO因子入核调控抗氧化酶SOD2转录[22]。此外,SIRT1可促进凋亡相关蛋白p53去乙酰化,从而抑制其促凋亡活性;而抑制SIRT1则增加p53活性,促进凋亡发生[23-24]。SIRT1在内皮细胞中也有大量表达,Li等[25]发现高糖刺激可明显抑制内皮细胞SIRT1表达,同时伴有氧自由基大量生成和内皮功能障碍。敲低内皮SIRT1可增加糖尿病小鼠内皮细胞ROS生成,加重内皮损伤和功能障碍;而SIRT1内皮特异性转基因小鼠在建立糖尿病模型后则表现出较低的氧化应激水平和内皮损伤程度[26-27]。Fan等[28]近来研究发现,激活SIRT1可减轻内皮氧化应激损伤,促进内皮存活和血管生成,从而改善糖尿病小鼠后肢缺血性损伤。本研究发现,抑制miR-182-5p可通过激活SIRT1改善高糖诱导的内皮氧化应激和细胞死亡,而沉默SIRT1则阻断这种内皮保护效应。因此,SIRT1是调控糖尿病内皮损伤的关键靶点。
MicroRNAs是一类长约19~24个核苷酸的非编码RNA,常通过碱基互补配对方式与靶基因3’-UTR上种子区域完全或部分结合,在转录后水平调控靶基因表达[6]。近来研究提示,microRNAs参与调控细胞氧化应激和死亡等过程。Xu等[29]研究发现,miR-626可激活KEAP1-NRF2抗氧化信号通路减轻视网膜色素上皮细胞氧化性损伤。La等[30]研究提示,高糖刺激在诱导氧化应激反应的同时伴有miR-21表达上调;进一步研究证实,miR-21可抑制多种抗氧化分子表达,而使用miR-21抑制剂则减轻高糖诱导的内皮损伤。既往有关miR-182-5p的研究大多局限在肿瘤领域,但越来越多研究提示,miR-182-5p在正常组织细胞的病理生理过程中也发挥重要调控作用[31]。Guzzolino等[32- 33]发现,miR-182-5p在心脏组织中有较高表达水平,参与调控心脏发育和电活动,并可调节心肌肥厚的发生、发展。过表达miR-182-5p还可抑制肿瘤坏死因子诱导的气道平滑肌细胞增殖迁移,从而参与哮喘的气道重构过程;miR-182-5p还是特发性肺纤维化的重要生物标志物,抑制miR-182-5p可缓解肺纤维化进展[34-35]。本研究发现,miR-182-5p在高糖刺激的内皮细胞中表达上调并抑制SIRT1蛋白表达,从而加重内皮氧化应激损伤和细胞死亡;而抑制miR-182-5p可恢复内皮SIRT1水平并发挥内皮保护效应。本研究揭示了miR-182-5p在高糖诱导的内皮细胞损伤中的作用,并证明miR-182-5p是通过结合SIRT1的3′-UTR抑制其蛋白表达,从而促进高糖诱导的内皮氧化应激和细胞凋亡;为临床治疗糖尿病内皮损伤和血管病变提供新的理论依据。
4 结论
高糖刺激增加内皮miR-182-5p表达,抑制miR-182-5p可恢复内皮SIRT1水平,从而减轻高糖诱导的内皮氧化应激损伤和细胞凋亡;而增加miR-182-5p则降低SIRT1表达,进一步加重高糖诱导的内皮损伤。靶向miR-182-5p可为糖尿病内皮损伤和血管并发症提供新策略。
