miR-34a通过调控SESN2表达促进耳蜗毛细胞凋亡的机制*
2021-04-28哈再古丽贾汉阿依恒曲库尔汗冯娟阿不都许库尔吾买尔
哈再古丽·贾汉 阿依恒·曲库尔汗 冯娟 阿不都许库尔·吾买尔
(1.新疆医科大学第一附属医院耳鼻咽喉科,新疆 乌鲁木齐 830000;2.新疆医科大学第七附属医院耳鼻咽喉科,新疆 乌鲁木齐 830028)
老年性听力损伤(Age-Related Hearing Loss, AHL)是一类由遗传、免疫、炎症等多种因素共同参与产生的老年感知性疾病[1-2],病情呈缓慢性加重,严重影响老年患者的生活质量。多种microRNAs(miRNAs)可在转录后水平通过调控基因沉默复合体(RNA-Induced Silencing Complex, RISC)来影响听觉相关分子的表达[3],从而参与AHL疾病的发生与进展[4-5],其中大量数据证实miR-34a可以通过miR-34a/SIRT1/p53、miR-34a/Bcl-2等信号通路来介导耳蜗毛细胞凋亡[6-7],并能够作为潜在的AHL治疗靶点而受到广泛关注。另外,最新研究通过筛查AHL模型小鼠发现Sestrin 2(SESN2)表达显著降低[8],且进一步生物信息学分析提示SESN2的3′非翻译区(3′ UTR)存在与miR-34a的靶向结合位点[9-10]。然而,关于miR-34a与SESN2在AHL发生、发展中的相互作用关系及机制报道鲜少,因此本研究旨在通过探讨两者在耳蜗毛细胞增殖及凋亡中的作用机制,为靶向miR-34a治疗AHL提供新的理论依据。
1 材料与方法
1.1 一般材料 耳蜗毛细胞系HEI-OC1购自中国科学院上海生命科学研究院细胞资源中心;胎牛血清(Fetal Bovine Serum, FBS)、高糖DMEM培养基、PBS及0.25%胰蛋白酶溶液等购自美国Hyclone公司;Effectene Transfection Reagent转染试剂购自德国QIAGEN公司;Dual-Luciferase Reporter Assay System(Promega)、CCK-8试剂盒(Abmole)、TRIzol、RT-PCR试剂及Power Up SYBR Green Kit等均购自美国Invitrogen公司;Annexin V-FITC细胞凋亡检测试剂盒、RIPA细胞裂解液、BCA蛋白定量试剂盒购自上海碧云天公司;超氧化物歧化酶(Superoxide Dismutase, SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase, GSH-Px)、过氧化氢酶(Catalase, CAT)、丙二醛(Malondialdehyde, MDA)ELISA检测试剂盒等购自南京建成生物工程研究所;WB检测抗体均购自Abcam; 双萤光素酶报告载体pGL3购自美国Promega公司,相应pGL3-PIK3CA-SESN2-WT及突变型报告载体pGL3-PIK3CA-SESN2-Mut、SESN2过表达载体及同型阴性对照载体(Negative Control, NC)、miR-34a mimic及miR-34a无序对照物(NC mimic)等均由上海吉玛生物公司设计合成,PCR检测引物见表1。

表1 引物序列
1.2 细胞转染及分组 HEI-OC1细胞分组培养于24孔板中,组别设置为转染SESN2同型阴性对照组(NC组)、转染SESN2过表达载体组(SESN2组)、共转染SESN2过表达载体及miR-34a mimic组(SESN2+miR-34a mimic组)。待板中细胞密度至50%后参照Effectene Transfection Reagent说明书分别转染不同载体质粒,常规培养48 h后换液收集转染后的细胞经测序验证后用于后续实验检测。
1.3 双萤光素酶报告基因实验 根据TargetScan(http: //www.targetscan.org)预测的miR-34a与SESN2(NM0314593)靶向结合位点,克隆含miR-34a潜在结合位点的SESN2 3′UTR区的野生型pGL3-PIK3CA-SESN2-WT载体,扩增序列引物上游:5′-AT TGCCAAACCTCTGACTGCCA-3′,下游:5′-AATC GGATTCGGACTTCGGC-3′,定点突变核心序列“ACCTCT”后扩增得到突变型pGL3-PIK3CA-SESN2-Mut载体。分别将上述载体与miR-34a mimic或NC mimic共转染HEK293T细胞,并用pRL-TK空载体转染空白细胞做阴性对照,48 h后根据Dual-Luciferase Reporter Assay System试剂盒说明书测定各组细胞相对萤光素酶活性。
1.4 CCK-8检测细胞增殖活力 96孔板中接种各组细胞,每组6个平行对照,参照Cell Counting Kit说明书于稳定培养24、48、72 h后加入10 mL CCK-8试剂,赋予4 h。检测各组细胞在450 nm处的吸光度(OD值),计算分析各组细胞的增殖活性。
1.5 细胞凋亡检测 收集各组细胞,调整细胞密度至4×105/mL,参照Annexin V-FITC细胞凋亡试剂盒说明书加入500 μl Binding Buffer重悬细胞后,避光依次加入5 μl的Annexin V染色液和10 μl PI染液,同时配置空白细胞样品、单染Annexin V和单染PI样品用于调节光路补偿,染色15 min后上流式细胞仪检测并计算各组细胞凋亡率。
1.6 细胞内氧化应激指标检测 消化收集上述3组细胞,PBS漂洗1次,采用超声破碎仪裂解细胞,3000 r/min低速离心15 min,收集细胞裂解上清,参照SOD、CAT、GSH-Px、MDA试剂盒说明书检测miR-34a与SESN2各组细胞内氧化损伤相关分子的表达影响。
1.7 Western blot检测细胞内蛋白表达水平 收集各组细胞加入含1%PMSF的RIPA裂解液于冰上裂解细胞,并提取细胞蛋白,定量检测后取等量蛋白行10% SDS-PAGE凝胶电泳,100 V恒压电泳120 min; 电泳结束后采用湿转法将蛋白条带转移于活化的PVDF膜上,常规抗体孵育后滴加发光液曝光显影,以GAPDH为内参蛋白,采集发光图像分析相关蛋白表达水平。
1.8 qRT-PCR检测细胞内基因表达水平 参照TRIzol说明书裂解提取细胞总RNAs,逆转合成cDNAs,标定各组样本cDNAs浓度后参照Power Up SYBR Green Kit说明书定量检测目的基因表达量。GADPH、U6扩增引物分别作为mRNA和miRNA的参比基因,每组细胞样本设置3个平行对照,以采集到荧光信号均值(Ct值)计算2-△△Ct表示目的基因的相对表达量。同时做阴性对照用以排除反应体系内PCR污染及引物二聚体干扰。

2 结果
2.1 miR-34a靶向调控SESN2表达 双荧光素酶实验结果表明,miR-34a能够靶向抑制SESN2表达(图1A);WB及qRT-PCR结果显示,miR-34a能够显著抑制HEI-OC1细胞中SESN2的表达(图1B),而过表达SESN2能够显著抑制细胞内miR-34a的表达量(图1C)。
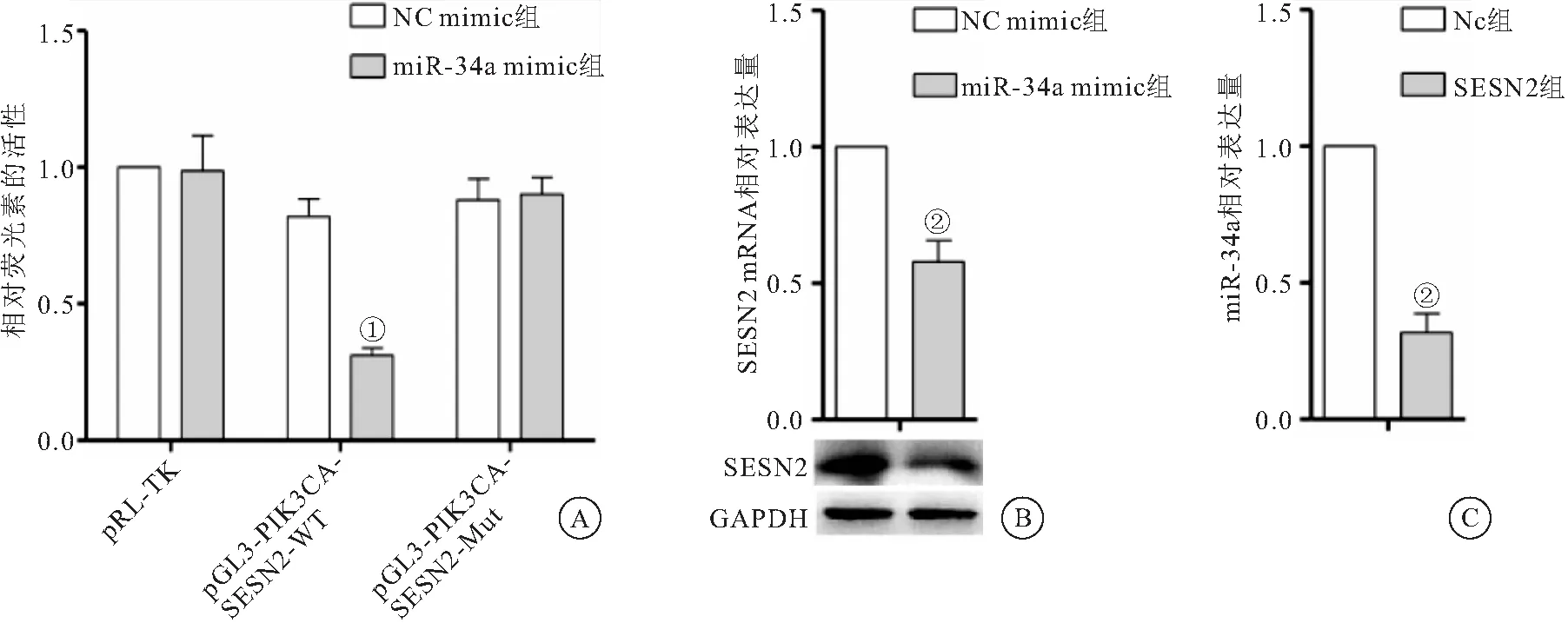
图1 miR-34a与SESN2靶向结合并相互作用
2.2 miR-34a靶向调控SESN2表达参与影响HEI-OC1细胞增殖 CCK-8增殖实验结果显示,过表达SESN2能够显著促进HEI-OC1细胞增殖活力,与NC组细胞相比,48 h后SESN2组细胞增值活力显著升高(P<0.001),SESN2+miR-34a mimic组细胞的增殖活力无明显变化(P>0.05);而与SESN2组细胞相比,SESN2+ miR-34a mimic组细胞的增殖活力在48 h后明显降低(P<0.05),见图2。
2.3 miR-34a靶向调控SESN2参与影响HEI-OC1细胞凋亡 与NC组HEI-OC1细胞相比,SESN2组细胞的凋亡率及细胞中促凋亡相关蛋白Bax、Caspase-3表达均明显降低,但凋亡抑制蛋白Bcl-2及AMPK信号通路相关蛋白AMPK磷酸化水平及SIRT1表达水平明显增加(均P<0.05),而SESN2+ miR-34a mimic组细胞的凋亡率及上述相关蛋白表达均无明显差异(P>0.05);但与SESN2组相比,SESN2+miR-34a mimic组细胞的凋亡率及促凋亡相关蛋白Bax、Caspase-3表达明显升高,凋亡抑制蛋白Bcl-2及AMPK信号通路相关蛋白AMPK磷酸化水平及SIRT1表达水平均明显降低(均P<0.05),见图3。
2.4 miR-34a靶向调控SESN2参与影响HEI-OC1细胞氧化损伤 与NC组相比,SESN2组细胞能显著促进HEI-OC1细胞中SOD、CAT及GSH-Px表达,并减少MDA表达(均P<0.05),SESN2+miR-34a mimic组细胞中SOD、CAT及GSH-P表达均无明显变化(P>0.05);而与SESN2细胞相比,SESN2+miR-34a mimic组细胞中SOD、CAT及GSH-P表达均明显降低,但MDA表达量显著增加(均P<0.05),见表2。
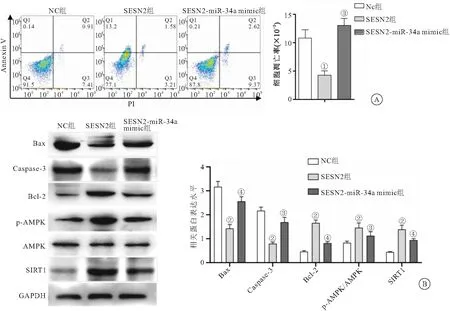
图3 miR-34a靶向SESN2促进HEI-OC1细胞凋亡
表2 miR-34a靶向SESN2参与调控HEI-OC1细胞氧化应激水平
3 讨论
SESN2蛋白是应激诱导蛋白SESNs家族的重要成员,最初被发现确定为p53靶基因[11-12],发挥维持代谢、增强自噬及调控细胞增殖等生物学作用,特别是在代谢及年龄相关性疾病中,胰岛素抵抗、非酒精性脂肪肝及动脉粥样硬化等疾病的发生、发展都与SESN2对胁迫免疫响应和炎症激活有着或多或少的关系[13-14]。同时随着研究的不断深入,SESN2活化参与介导的下游AMPK/TSC2/mTOR、PERK/ERS、Nrf2-ARE等多种信号通路的激活及分子调控机制被不断揭示[15-17],而SESN2的表达抑制及应激条件激活又受到何种分子或信号的调控尚未完全阐明。因此,本研究验证了SESN2与miR-34a在HEI-OC1细胞中的相互作用关系,并初步揭示了两者在耳蜗毛细胞凋亡中作用及机制。
通过构建双萤光素酶报告基因系统体外转染HEK293T模式细胞验证miR-34a与SESN2 3′UTR区靶向结合可能,证明SESN2与miR-34a存在稳定结合序列,且在定点突变该结合序列后miR-34a mimic不能结合并阻断萤光素酶表达。进一步验证两者在HEI-OC1细胞中的的表达相关性,本研究采用HEI-OC1细胞相较于原代提取的体内毛细胞具有一定的永生化能力,在包括AHL等多种听觉相关疾病研究模型中得到广泛应用,结果显示SESN2与miR-34a在HEI-OC1细胞中的表达水平存在相互拮抗,miR-34a的过表达能够显著抑制SESN2 mRNA的转录及细胞内SESN2蛋白的生成。以上结果显示,miR-34a靶向结合并抑制SENS2的表达,其机制可能与miR-34a靶向结合SESN2并指导基因沉默复合体(RNA-induced silencing complex, RISC)[18]实现对SENS2 mRNA的降解及翻译抑制有关。
随后通过CCK-8、细胞凋亡及ELISA等方法检测miR-34a靶向SESN2对HEI-OC1细胞体外增殖、凋亡及氧化损伤等方面的影响,结果显示过表达SESN2能够显著促进HEI-OC1细胞增殖、抑制细胞凋亡并提高细胞抗氧化应激水平,反之过表达miR-34a则会削弱SESN2对HEI-OC1细胞的保护作用。根据相关文献报道,miR-34a高表达于AHL患者中,并能够通过抑制SIRT1表达参与介导耳蜗毛细胞凋亡[19],同时研究发现在小鼠年龄相关性耳聋模型中,随着年龄的增加SESN2的表达随之减少[20],且SESN2蛋白参与的自噬及凋亡调控被证实与SIRT1/AMPK信号转导相关[21-22],这提示在耳蜗毛细胞相关分子损伤中miR-34a的表达增加可能通过靶向抑制SESN2激活,减少应激蛋白表达,最终导致细胞损伤甚至凋亡。因此,本研究进一步检测了细胞内p-AMPK、AMPK、SIRT1蛋白表达变化及SESN2相关抗氧化损伤因子表达变化,结果显示,与NC组相比,过表达SESN2能显著促进SIRT1、p-AMPK/AMPK蛋白相对表达量增加,细胞内抗氧化应激因子SOD、CAT及GSH-Px表达量随SESN2增加而升高,提示SESN2可能通过调控AMPK/SIRT1信号通路降低HEI-OC1细胞氧化应激水平,提高细胞活性,抑制细胞凋亡,反之共转染miR-34a mimic抑制SESN2的表达进而抑制了细胞内SIRT1、p-AMPK/AMPK、SOD、CAT及GSH-Px蛋白的表达,促进MDA表达,最终造成细胞氧化损伤、诱导细胞凋亡的发生。这提示,miR-34a靶向SENS2参与介导AMPK/SIRT1信号通路表达调控并促进耳蜗毛细胞凋亡。
4 结论
本研究结果显示,miR-34a能通过靶向抑制SENS2表达,促进AMPK/SIRT1信号通路激活、抑制细胞内抗氧化应激因子SOD、CAT及GSH-Px表达促进细胞氧化损伤,miR-34a靶向SENS2对HEI-OC1细胞凋亡具有促进作用。
