五大思维模型助攻化学反应原理综合题
2021-04-08葛珊珊
葛珊珊

化学反应原理题是化学高考中不可缺少的重点试题,一般以真实的工业生产情况作为背景,以前沿科技作为载体展开命题,综合考查学生的必备知识、关键能力和综合素养。
考查项目 具体内容
必备知识 焓变及其计算、盖斯定律;各类方程式的书写;平衡常数、转化率、速率计算;平衡移动原理的应用
关键能力 提取图表信息的能力;接受和整合化学信息的能力;化学计算的能力
核心素养 变化观念与平衡思想;证据推理与模型认知
由于试题情境新颖,图表众多,很多考生在面对这类试题时缺乏自信。其实纵观近几年的各地高考题,虽然命题者不断求新求变,但具体考点是相对固定的。我们应当采取化整为零、逐个击破的应考策略,梳理常见考点,构建解题思路,形成思维模型。
盖斯定律的应用
盖斯定律用于计算多反应体系的热效应,要求学生掌握化学方程式整合时ΔH 的计算方法,具备细致处理数据的能力。这本是一个模式化的考查点,但近几年有了翻新的趋势。部分试题不直接提供热化学方程式,而是提供反应过程—能量图作为信息材料。
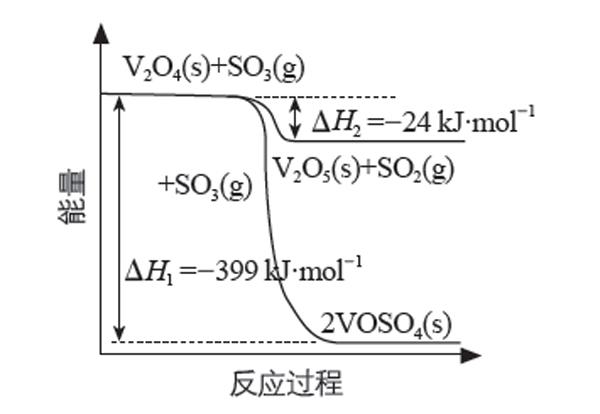
【例1】(2020年全国卷Ⅰ理综节选)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) ΔH =-98 kJ·mol-1。
钒催化剂参与反应的能量变化如图所示,V2O5(s)與SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
【解题指导】
第一步,明确目标方程式。根据反应物和生成物,结合氧化还原配平的方法,得出目标方程式:
2V2O5(s) + 2SO2(g) =2VOSO4(s) + V2O4(s)
第二步,明确盖斯定律需要的热化学反应方程式。根据目标方程式中的反应物和产物,结合图像中的两条曲线写出两个热化学方程式:
①V2O4(s)+SO3(g)=V2O5(s)+SO2(g) ΔH =-24kJ·mol-1
②V2O4(s)+2SO3(g)=2VOSO4(s) ΔH =-399 kJ·mol-1
第三步,确定方程式之间的整合方法。若目标方程式中某种物质只在一个方程式中出现,应优先确定该反应方程式的系数,以此方程式作为突破口确定其他方程式的反应方向和系数。本题可从SO2(g)和VOSO4(s)突破,得到目标方程式=②-①×2。
第四步,根据化学方程式的系数变化调整对应ΔH的计量数。目标方程式ΔH =(-399 kJ·mol-1)-(-24 kJ·mol-1)×2= -351 kJ·mol-1
【答案】2V2O5(s) + 2SO2(g)=2VOSO4(s) + V2O4(s)
ΔH =-351 kJ·mol-1
盖斯定律应用思维模型
1. 根据目标方程式中的反应物和产物筛选试题所给的方程式。若某种物质只在一个方程式中出现,应优先确定该反应方程式的系数,以此方程式作为突破口确定其他方程式的反应方向和系数;
2. 根据化学方程式的系数变化调整对应ΔH 的计量数,注意调整反应方向后改变ΔH 的正负值;
3. 代入数据仔细计算。
信息背景下方程式的书写
该考点的试题以书写化学反应方程式或离子反应方程式为主要形式,考查物质转化的基本规律,要求考生熟悉常见物质在氧化还原反应中的化合价变化,关注不同酸碱性环境下物质的存在形式,根据题目所给的信息判断反应物和生成物。
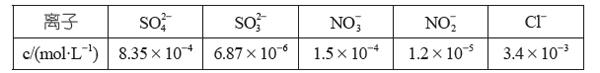
【例2】煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气。采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×10-3 mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 SO42- SO32- NO-3 NO-2 Cl-
c/(mol·L-1) 8.35×10-4 6.87×10-6 1.5×10-4 1.2×10-5 3.4×10-3
(1)写出NaClO2溶液脱硝过程中主要反应的离子方程式 。
(2)随着吸收反应的进行,吸收剂溶液的pH逐渐(填“提高”“不变”或“降低”)。
【解题指导】
第一步,分析主要的反应物和产物。根据题意观察表格中的数据,发现SO2和NOx被NaClO2溶液吸收后产生了四种离子SO42-,SO32-,NO-3和NO-2,而亚氯酸钠具有氧化性,在反应过程中化合价应当下降,生成Cl-。第(1)问要求考生写出脱硝的主要反应,对比NO-3和NO-2的浓度大小确定NO-3是主反应产物,NO-2是副反应产物。
第二步,根据电子得失守恒和电荷守恒进行配平。先氧化还原配平可得 3ClO2-+4NO4NO-3+3Cl-,再根据电荷守恒配出氢离子3ClO2-+4NO4NO-3+3Cl-+4H+,最后根据原子守恒配出水2H2O+3ClO2-+4NO=4NO-3+3Cl-+4H+。
第三步,根据反应方程式解决相关问题。第(1)小题中两个主要反应分别是2H2O+ClO2-+2SO2 =2SO42-+Cl-+ 4H+和2H2O+3ClO2-+4NO=4NO-3+3Cl-+4H+。可知随着吸收反应的进行,氢离子浓度增大,吸收剂溶液的pH逐渐降低。
试题要求考生根据数据分析多种产物共存的原因,分清主要产物和副产物。考生要加强审题,耐心从数据、图表和语言中挖掘信息,再用书写陌生方程式的思维模型解决问题。
【答案】(1)2H2O+3ClO2-+4NO=4NO-3+3Cl-+4H+;
(2)降低
书写陌生反应方程式思维模型
1.找准目标:写出主要的反应物与生成物。
2.正确配平:(1)选择守恒视角——电子守恒(氧化还原反应)、电荷守恒(离子反应)、质量守恒(所有反应);(2)补充缺项物质——依据体系酸碱性,补充必要的酸或碱。
3.完善细节:(1)依据事实标明反应条件;(2)基于意义规范使用“”“↑”“↓” 。
常数计算
化学平衡常数的计算问题可以考查考生对平衡常数、转化率、产率等基本概念的组合,相对耗时。考生需思路清晰,有条理地完成解题。
【例3】(2020年天津卷节选)利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应)。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH < 0
某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应的平衡常数的值为 。
【解题指导】
根据CH3OH的产率为b,如果CO2(g)完全转化为CH3OH(g),理论产量为a mol·L-1,故实际产量=理论产量×产率=ab,其他平衡量根据变化量可依次求出。
【答案】
常数计算思维模型
1. 用三段法列出反应前后各物质浓度变化情况(注意:对信息的提取务必准确,将转化率、产率、浓度、物质的量概念区分清晰);
2. 计算化学平衡常数要代入浓度值,固体和纯液体的浓度为1。
图像分析
化学反应原理综合题中出现抽象的数学图表已经成为常态,试题要求考生从图像中获取、评价、整合和应用信息解决化学问题。试题以多反应体系为背景,涉及化学平衡和化学反应速率知识,考查考生的证据推理和模型认知素养。
【例4】(2020年南京一模节选) Jo De Vrieze等设计了可以脱除沼气中的CO2和H2S的膜电解法,并将阴极处理后的混合气体(含CH4,CO2 和H2)制成高纯度生物甲烷。主要发生的反应为:
。
【解题指导】
第一步,分析文本和图像明确研究内容。图左研究的主要是温度对化学平衡的影响,图右研究温度和压强对化学平衡的影响。首先必须明确反应吸放热的情况。
第二步,针对多反应体系分析单一反应的特点。图左中出现了CO2,H2,CH4,H2O和CO五根曲线,CO2,H2和H2O在两个反应中均有出现,对吸放热问题的分析帮助不大,而CH4只出现在反应Ⅰ中,CO只出现在反应Ⅱ中,利用CH4和CO曲线可分别判断出ΔH1<0,ΔH2>0。
第三步,分析单一反应对多反应体系的贡献。由于反应Ⅰ和反应Ⅱ的吸放热情况相反,温度升高时平衡的移动情况恰好相反,根据图中出现的实际情况即可分析出对体系作出主要贡献的部分。
【答案】 (1)温度升高时,反应Ⅰ向左移动增加的CO2的量大于反应Ⅱ向右移动减少的CO2的量;(2)增大压强,反应Ⅱ不移动,反应Ⅰ向正反应方向移动;反应Ⅰ中CO2减小的平衡转化率始终大于反应Ⅱ中CO2增大的平衡转化率。
图像分析思维模型
1.关注图像横纵坐标含义,找出题意要求的特殊区间,如最高值、最低值或者变化最快的区间等;
2.结合图像所呈现的变化趋势,用化学语言表述其中的化学反应原理。常常从反应速率、平衡、物质转化率等角度展开回答。
化学反应机理的探究
化学反应机理题常以陌生反应为载体,通过反应历程图像、分步反应方程式等形式给予考生信息,考查考生对催化剂、活化能、焓变等基本概念的掌握情况。
【例5】CO和H2O可以在Fe(CO)5的催化作用下发生反应CO(g)+H2O(g)=CO2(g)+H2(g),其反应机理如图所示。OH-在此反应中的作用是 ;若参与反应的为C18O,则生成的二氧化碳成分为 (填“只有CO18O”“只有CO2” 或“CO18O和CO2”)。
【解题指导】
反应机理图通常是比较繁杂的,题目由于使用了Fe(CO)5催化剂而呈现典型的“循环式”。注意观察进入循环和离开循环的物质,分为四类情况:“只进不出”——反应物;“只出不进”——生成物;“先进后出”——催化剂;“先出后进”——中间产物。OH-在此反应中“先进后出”,所以是催化剂。
同位素标记法是研究反应机理的常用手段,Fe(CO)5吸收C18O成为Fe(CO)5(C18O),图示的位置将后进入的C18O标注在上方,但这6个CO在化学反應中是同等的,Fe(CO)5(C18O)在下一步反应可能成为Fe(CO)5(C18OOH-)也有可能成为Fe(CO)4(C18O) (COOH-),则生成的二氧化碳成分为CO18O和CO2都有。这里特别值得注意的是,同位素在化学性质上并无明显差异。
【答案】催化剂;CO18O和CO2
化学反应机理思维模型
1. 通观全局,重点分析“进入”和“离开”的物质,找准反应物、生成物、催化剂和中间产物;
2. 催化剂改变反应速率,不影响化学平衡;改变活化能,不影响焓变;
3. 同位素标记不影响元素的化学性质。
