基于对NOD小鼠颌下腺RORγt、Foxp3及其mRNA调节探讨白芍总苷治疗干燥综合征的作用机制
2021-04-07吴国琳卢雯雯熊福林
吴国琳,王 庆,卢雯雯,熊福林,高 丽,卞 华*
1浙江大学医学院附属第一医院,杭州 310003;2浙江省立同德医院,杭州 310012;3南阳理工学院 河南省张仲景方药与免疫调节重点实验室,南阳 473004
干燥综合征(sjogren’s syndrome,SS)是一种常见的风湿免疫性疾病,多发生于中青年女性,其发病率列风湿免疫性疾病第二位。常见临床症状为口干、眼干、关节疼痛、乏力等,严重者可影响生活质量。目前SS尚无确切的病因和发病机制,一般认为是在遗传、病毒感染和性激素异常等多种因素作用下,导致机体免疫功能异常,通过多种细胞因子和炎症介质造成淋巴细胞侵犯唾液腺和泪腺等外分泌腺而发病[1]。有研究证实T辅助细胞17(Thl7)/Treg细胞偏移及其免疫失衡与SS发病密切相关,而Th17/Treg之间的动态平衡可通过其相应的转录因子维甲酸相关孤独受体γt(retinoidrelated orphan receptor,RORγt)/叉状头转录因子3(forkhead transcription factor 3,Foxp3)介导[2]。白芍总苷(total glucosides of paeony,TGP)是从中药白芍中提取的一种糖苷类物质,是白芍的主要化学成分[3],在临床应用治疗SS能改善患者口干、眼干等症状,有较好临床疗效,且安全性较高[4]。本实验旨在通过研究白芍总苷对SS模型小鼠颌下腺Th17、Treg细胞的特异性转录因子ROR γt mRNA、FoxP3 mRNA的表达水平的影响,探讨白芍总苷治疗SS的可能作用机制。
1 实验材料
1.1 实验动物
选择8周龄的雌性非肥胖型糖尿病(non obese diabetes,NOD)小鼠24只,SPF级,购自上海斯莱克动物实验中心,合格证号:20130016000707。在无菌的恒定温度和湿度条件下饲养。实验方案经浙江大学医学院附属第一医院实验动物伦理委员会审批通过(批件号(2018)实动快审第(048)号)。
1.2 实验药物
白芍总苷胶囊(宁波立华制药有限公司生产,规格0.3 g/粒,批号20180718)用蒸馏水稀释成含生药量15 g/mL。硫酸羟氯喹片(由上海中西制药有限公司生产,规格:0.1 g/片,批号:180812),用蒸馏水稀释成含生药量3 mg/mL。
1.3 实验试剂
实验用反转录试剂盒(TAKARA公司);兔抗鼠RORγt、FoxP3多克隆抗体(美国SANTA CRUZ公司生产);RORγt、FoxP3原位杂交检测试剂盒(武汉博士德公司)。
2 实验方法
2.1 实验动物分组及给药
将24只NOD小鼠随机分为4组,即模型组、白芍总苷组、羟氯喹组以及联合组,每组各6只,另外选6只BALB/c小鼠为正常对照组。每组小鼠的给药量按动物与人等效剂量换算表计算。
白芍总苷组每日定时按照300 mg/kg剂量分别灌胃TGP稀释液0.4 mL,羟氯喹组每日按60 mg/kg剂量灌胃硫酸羟氯喹稀释液0.4 mL,联合组每日灌胃TGP 0.4 mL+羟氯喹0.4 mL。模型组和正常组灌胃等体积的生理盐水0.4 mL。
2.2 指标检测
各组小鼠在喂养并给药8周后,颈椎脱臼处死后,立即摘取双侧颌下腺组织进行指标检测。观察及检测指标如下。
2.2.1 颌下腺组织病理观察
将摘取的小鼠颌下腺组织放置于4%多聚甲醛中固定,然后包埋、切片、HE染色后,在光镜下观察组织的病理变化,分析各组小鼠颌下腺的淋巴细胞浸润程度,并根据Chisholm- Mason组织学评分方法将各组小鼠颌下腺病变轻重程度进行量化分析,评价标准见表1。
2.2.2 RT-PCR法检测颌下腺组织RORγt mRNA、FoxP3 mRNA的表达
2.2.2.1 检测步骤
以GAPDH为内参,用Trisol试剂盒提取颌下腺总RNA,然后取1 μL进行RT-PCR分析。GAPDH引物序列:上游5′-AAGGGTGGAGCCAAAAGGG-3,下游5′-TGGGGGTAGGA ACACGGAA-3;RORγt引物序列:上游5′-AAGCAGGAGCAATGGAAGTCG-3,下游5′- GAGAACCAGGGCCGTGTAGAG-3;FoxP3引物序列为:5′-GAGAAAGCGGATACCA AATGA -3,下游5′-GAGACAGAGATGGGCAAGAAG-3。本实验PCR反应参数为94 ℃ 5 min,再将反应条件变为94 ℃ 15 s,60 ℃ 45 s,然后循环扩增40次,于60 ℃检测荧光值。RORγt mRNA、FoxP3 mRNA及内参GAPDH分别在两个管中同时进行PCR反应,除探针和引物外,两管中加入的RNA模板和其他反应试剂均一致。
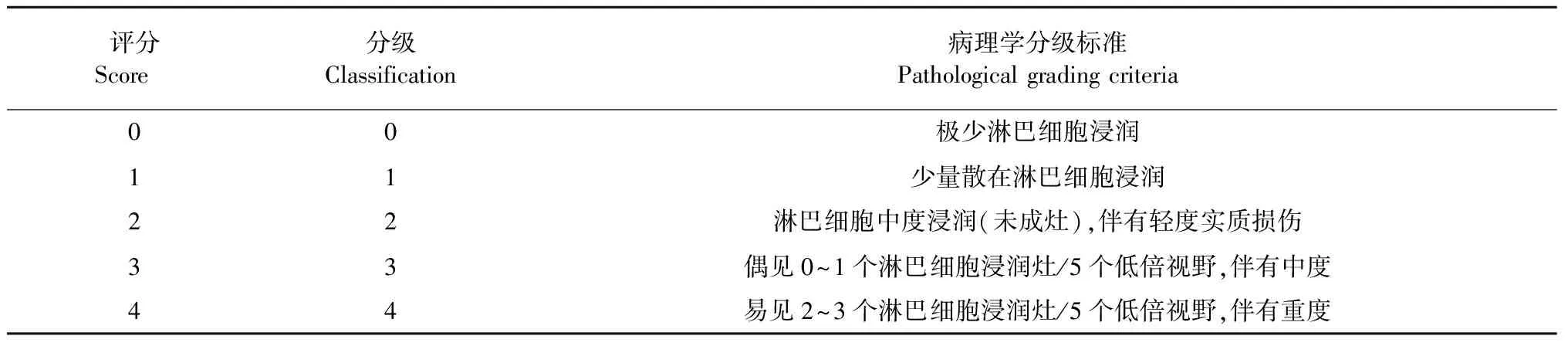
表1 SS模型小鼠颌下腺病理学评价标准
2.2.2.2 结果判断
通过ABI Stepone plus荧光定量PCR仪测定并取其循环阈值均值(CT值),结果采用相对定量分析法,即2-△△CT法进行mRNA相对表达量的计算,以各组△CT值进行统计学分析,本实验以模型组做为未处理组,与其他各组进行比较。具体计算公式如下:
△CT=目的基因CT值(实验组)-该组内参基因CT值
△△CT=(目的基因CT值—内参基因CT值)实验组-(目的基因CT值—内参基因CT值)模型组
△CT值越小表示RORγt mRNA、FoxP3 mRNA在颌下腺组织中的表达越高,而2-△△CT值越高,表明样本中RORγt mRNA、FoxP3 mRNA相对于模型组表达量越大。
2.3 统计学处理

3 结果
实验过程中,模型组和羟氯喹组各有1只小鼠死亡,经解剖后发现是因灌胃不当损伤食管引起。
3.1 各组小鼠颌下腺组织形态学观察
3.1.1 光镜下颌下腺病理观察
颌下腺病理观察显示(见图1),正常组颌下腺腺泡大小基本均一,腺泡及导管结构正常,间质中未见淋巴细胞浸润。模型组颌下腺腺泡大小不等,部分有破坏,间质有中度或重度淋巴细胞浸润,可见局部腺体萎缩及纤维组织增生。白芍总苷组、羟氯喹组以及联合组小鼠颌下腺病理显示腺泡大小不一,可见少量腺泡和导管结构破坏,有散在的单个淋巴细胞浸润,且联合组少于白芍总苷组和羟氯喹组。
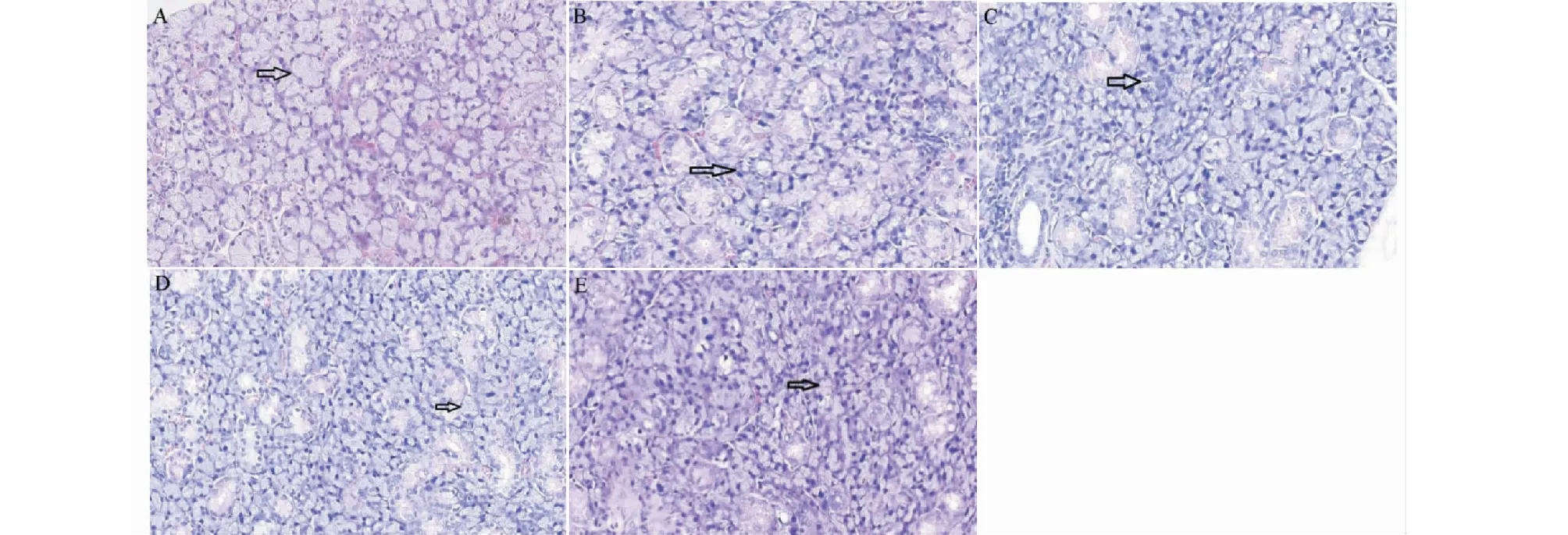
图1 各组小鼠颌下腺病理(HE 10×40)Fig.1 Submandibular gland pathology of mice in each group(HE 10×40)注:A:正常组;B:模型组;C:羟氯喹组;D:白芍总苷组;E:联合组。Note:A:The normal group;B:Model group;C:HCQ group;D:TGP group;E:Combined group.
3.1.2 各组小鼠颌下腺组织病理评分比较

表2 各组颌下腺组织病理评分比较
病理评分显示(见表2),正常组小鼠颌下腺组织病理评分显著低于其他实验组(P<0.05),模型组小鼠颌下腺组织病理评分明显高于其他组,统计有显著性差异(P<0.05)。联合组低于白芍总苷组和羟氯喹组,统计具有显著性差异(P<0.05)。
3.2 各组小鼠颌下腺RORγt mRNA、Foxp3 mRNA的表达比较
3.2.1 各组小鼠颌下腺RORγt mRNA、Foxp3 mRNA相对表达量△CT比较
由表3中可以看出,正常组小鼠颌下腺组织RORγt mRNA的△CT值显著低于其他实验组,模型组高于其他各组,且与正常组和联合组相比有显著统计学差异(P<0.05),而联合组低于模型组、羟氯喹组和白芍总苷组,统计有显著性差异(P<0.05)。
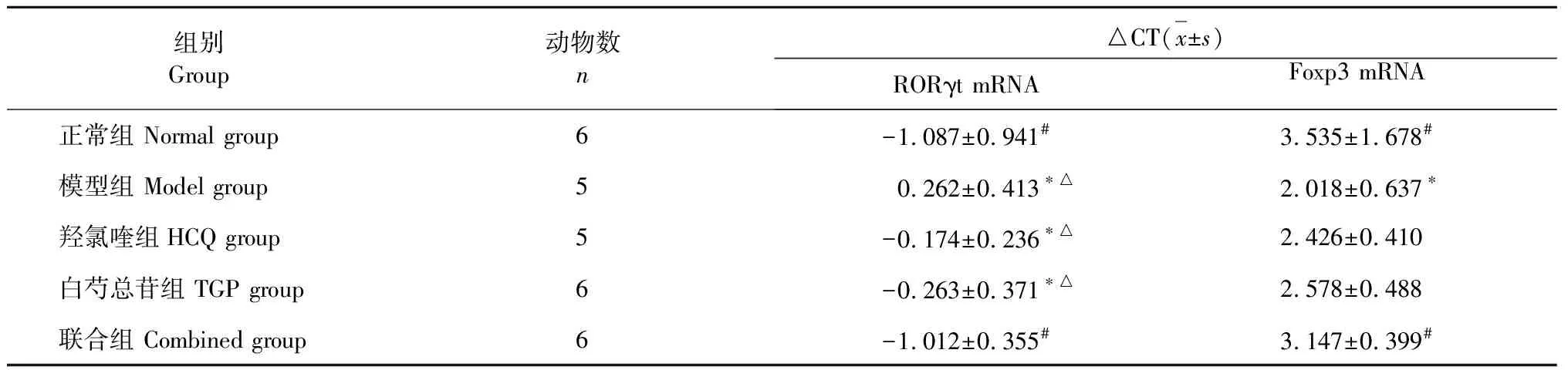
表3 各组颌下腺RORγt mRNA、Foxp 3 mRNA表达量△CT比较
各组小鼠颌下腺组织Foxp3 mRNA的△CT值比较发现,模型组明显低于其他组,且与正常组和联合组相比统计具有显著性差异(P<0.05),联合组虽然高于羟氯喹组和白芍总苷组,但无统计学意义(P>0.05)。
3.2.2 各组小鼠颌下腺RORγt mRNA、Foxp3 mRNA相对表达量2-△△CT值比较
从图2中看出,各组小鼠颌下腺组织RORγt mRNA表达量的2-△△CT值从高到低一次为:模型组>羟氯喹组>白芍总苷组>联合组>正常组;各组小鼠颌下腺组织FoxP3 mRNA表达量的2-△△CT值从高到低依次为:正常组>联合组>白芍总苷组>羟氯喹组>模型组。
4 讨论
SS的病因和发病机制虽然不明,但与机体自身免疫耐受被打破导致免疫稳态失衡有重要关系。近年来,辅助性T细胞(Th)的分化及其免疫平衡在SS发病中的作用逐渐受到关注,一般认为,Th17/Treg之间的动态平衡对维持免疫内环境的稳定具有重要作用,若此种平衡失调可引起全身或局部免疫应答异常,导致自身免疫性疾病的发生发展[2]。辅助性T细胞的分化方向取决于调控其分化的关键转录因子。研究证实,RORγt的表达激活促进前体细胞分化为Thl7细胞,是Th17细胞的特异性转录因子,维持Thl7细胞的分泌功能,对致病性Thl7细胞的分化起关键性作用。而Foxp3是控制Treg细胞分化的关键转录因子,研究发现pSS患者唇腺中Foxp3 mRNA表达降低,Foxp3参与了pSS的发病[5]。在SS的发病过程中,Thl7效应增强可能促进SS的发展及恶化,而调节性Treg细胞可抑制过度亢进的Thl7,以维持机体免疫耐受和免疫稳态,但Thl7/Treg免疫失衡可能促发或加剧SS的发生发展[6],提示转录因子RORγt/FoxP3介导Thl7/ Treg之间的免疫平衡与SS发病密切相关。
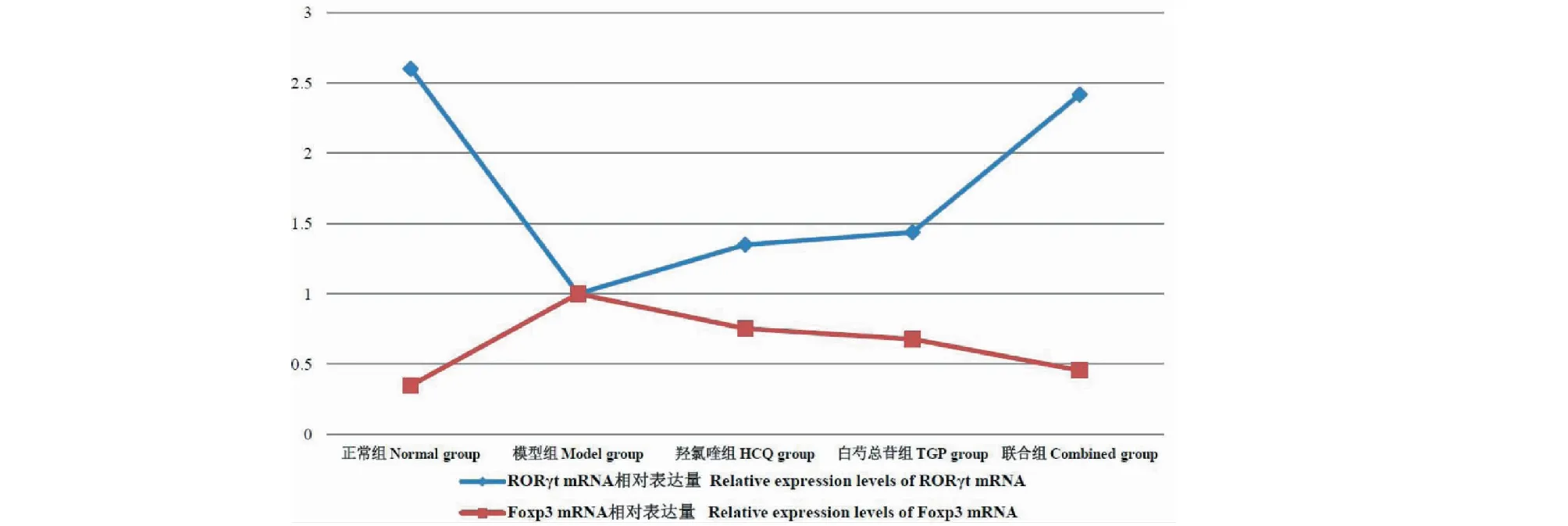
图2 各组小鼠颌下腺RORγt mRNA、Foxp3 mRNA相对表达量2-△△CT值Fig.2 Relative expression levels of RORγt mRNA and Foxp3 mRNA in submandibular glands of mice in each group 2-△△CT values
目前SS无有效治疗方法,治疗目标是缓解症状和预防并发症。而中西药协同治疗SS可有助于缓解SS患者口干、眼干、乏力、关节痛等症状,促进泪腺和唾液分泌功能,提高患者生活质量,避免西药不良反应,减少复发率,其优势已被广泛认可[7]。TGP治疗SS有明显的临床疗效,TGP联合HCQ治疗pSS效果显著,且副作用较少[8]。
NOD小鼠是目前最为理想的干燥综合征实验动物模型,广泛应用于SS的发病机制及疗效研究[9]。现代药理研究表明,白芍总苷能减轻NOD小鼠颌下腺淋巴细胞灶性浸润程度,可预防自发性涎腺炎的发生[10],也能促进NOD小鼠颌下腺水分子通道蛋白-5(AQP-5)的表达,改善口干多饮等症状,并能调节小鼠血清及颌下腺组织的Thl/Th2型细胞因子表达[11,12]。
本实验研究发现,模型组NOD小鼠颌下腺病理损害明显较正常组严重,经药物干预后均得到不同程度的改善,且联合组明显优于单纯羟氯喹组和白芍总苷组。同时发现,模型组NOD小鼠颌下腺RORγt mRNA的表达明显高于正常组,而Foxp3 mRNA的表达明显低于正常组,经药物干预后发现,联合组能明显降低颌下腺RORγt mRNA的表达,最接近于正常组,效果优于羟氯喹组和白芍总苷组。联合组颌下腺Foxp3 mRNA的表达低于模型组、羟氯喹组和白芍总苷组,且与模型组相比有显著性差异。实验结果表明,白芍总苷能改善干燥综合征NOD小鼠颌下腺的病理损害,并能有效下调RORγt mRNA的表达,上调Foxp3 mRNA的表达,由此我们推测,白芍总苷可能通过调节调控转录因子RORγtmRNA、FoxP3mRNA的表达,从而调节其相应介导的Thl7/Treg之间的免疫平衡而起到治疗SS的作用,将为今后进一步深入研究白芍总苷的免疫调节机制提供新思路。
