2-溴-4-氟乙酰苯胺在雄性大鼠体内的毒物动力学行为
2021-04-06朱狄峰童振轩洪雅雯赵剑岚
朱狄峰, 童振轩, 洪雅雯, 陈 超, 赵剑岚, 平 丽
(浙江大学 药学院 药物安全评价研究中心,杭州 310058)
通过构效关系分析合成相同母核、不同取代基团的化合物是目前研究开发新型农药的主要方式之一[1-2]。N-苯基酰胺类化合物作为重要的内吸性杀菌剂,被广泛用于农药、医药和化工等领域,常见的有甲霜灵 (metalaxyl)、苯霜灵 (benalaxyl)及噁霜灵 (oxadixyl) 等,这类化合物长期使用易产生抗性或出现药物敏感性下降的问题[3-4]。2-溴-4-氟乙酰苯胺 (2-bromo-4-fluoroacetanilide,BFAA,结构式见图式1) 属于新型N-苯基酰胺类含氟化合物,引入的氟原子可增强药物分子对生物膜的通透性,具有更优良的亲脂性和吸收速率,可以之为骨架合成N-苯基酰胺类化合物,用于杀菌、除草[5],同时其也是合成杀菌剂联苯吡菌胺 (bixafen) 的关键中间体和主要杂质[6]。此外,2-溴-4-氟乙酰苯胺还被作为磺胺类药物的原料和中间体,用于生产止痛剂和退热剂[7]。目前对2-溴-4-氟乙酰苯胺的研究主要集中在其化学合成方面。根据经济合作与发展组织 (OECD) 全球化学品信息平台信息,2-溴-4-氟乙酰苯胺无刺激性、无腐蚀性、无遗传毒性,属于低毒物质[8],但尚未见有关其在动物体内代谢及组织分布情况等的研究报道。毒物动力学研究对农药作用机制评价和毒理学风险评估具有非常重要的作用[9-10]。为探明2-溴-4-氟乙酰苯胺在生物体内分布及代谢情况,本研究利用超高效液相色谱-串联质谱 (UPLC-MS/MS) 方法,对大鼠给予2-溴-4-氟乙酰苯胺后的毒代动力学、组织分布及排泄过程进行研究,旨在为深入研究2-溴-4-氟乙酰苯胺的毒理学作用机制及其用药安全性评估提供依据。
1 材料与方法
1.1 仪器、药物和试剂
液相色谱系统为ACQUITY UPLC I-Class 超高效液相色谱仪,质谱系统为配备ESI 离子源的Xevo TQ 三重四极杆串联质谱仪,数据采集由MassLynx V4.1 软件控制并处理 (美国Waters 公司);Minispin离心机及5810R 离心机 (德国Eppendorf 公司);XS205 电子分析天平 (精度0.01 mg) 及PB1501-L电子天平 (精度0.1 g) (瑞士METTLER TOLEDO公司);Purelab OptionS7 超纯水系统 (英国ELGA LabWater 公司);JAC 4 020 超声波清洗器 (韩国KODO 技术研究有限公司);MTV-100 多管漩涡混合仪 (杭州奥盛仪器有限公司);Voetex 2 混匀器(德国IKA 公司)。
2-溴-4-氟乙酰苯胺 (2-bromo-4-fluoroacetanilide,BFAA) 及标准对照品 (纯度均为99.92%,北京新岸诺亚催化科技有限公司);内标 (IS) 为氯雷他定(loratadine,纯度100.0%,中国食品药品检定研究院)。试剂甲醇、乙腈和甲酸均为色谱纯;羧甲基纤维素钠和蓖麻油聚氧乙烯醚为化学纯;超纯水(自制)。
1.2 实验动物
动物实验方案由浙江大学药物安全评价中心动物实验委员会审定。SPF 级、约6~8 周龄的雄性SD 大鼠50 只,购于北京维通利华实验动物技术有限公司,许可证号:SCXK (京) 2016-0006。实验动物的饲养和使用遵守《实验动物管理条例》(1988 年) 和《浙江省实验动物管理办法》(2009 年),实验动物使用许可证号为SYXK (浙)2018-0001。动物房温度22.3~25.2 ℃,相对湿度45.2%~65.7%,每1 h 换气次数 ≥ 15 次,每12 h明/暗交替。实验动物的使用遵循3 R (reduction、replacement 和refinement) 原则,动物实验场地已通过国际实验动物评估和认可委员会 (AAALAC)的认证。
1.3 动物分组及处理剂量设计
根据体重 (不超过平均体重的20%) 随机筛选出45 只大鼠,分成3 个试验组群,分别进行吸收试验、组织分布试验和排泄试验。前期预试验结果显示,给予1 000 mg/kg 剂量2-溴-4-氟乙酰苯胺处理未见严重毒性反应,验证了其属于低毒性物质。按照OECD “化学品测试指南 (guidelines for the testing of chemicals)”[11]和环境保护部《化学品测试方法》[12]要求,以1 000 mg/kg 作为经口染毒的高剂量。吸收试验共用大鼠20 只,分为灌胃染毒低、中、高剂量组和静脉注射组,染毒剂量分别为200、500、1 000 和20 mg/kg,每组5 只;组织分布试验共用大鼠20 只,灌胃染毒剂量为1 000 mg/kg,分别设4 个采样时间点 (0.5、2、8 和24 h),每时间点5 只;排泄试验共用大鼠5 只,为1 个灌胃染毒组,剂量为1 000 mg/kg。
1.4 生物样本采集及处理
大鼠染毒前禁食12 h。灌胃染毒药物采用0.5%的羧甲基纤维素钠溶解,静脉注射染毒药物采用4%的蓖麻油聚氧乙烯醚溶解。
毒物动力学研究中,灌胃染毒组于0、5、10、20、30、40 min 及1、1.5、2、3、4、6、10、24、48 h 分别取血,静脉注射染毒组于0、5、10、20、40 min 及1、1.5、2、4、6、10、24、48 h 分别取血。血液样品经肝素钠抗凝后于3 000 r/min 下离心10 min 分离血浆。
组织分布研究中,动物染毒后分别于0.5、2、8 和24 h 收集心脏、肝脏、脾脏、肺、肾脏、脂肪、肌肉、脑、睾丸、胃和小肠,采用预冷的生理盐水冲洗净血液和其他干扰物质,用滤纸吸干并称重后,加入3 倍质量的生理盐水,匀浆。
排泄研究中,将染毒后大鼠独立放入代谢笼中进行采样,尿液和粪便采样时间均为0~12、12~24、24~48、48~72、72~96 和96~120 h。粪便用2 倍质量的50%甲醇处理后,离心分离上清液。
采用Michopoulos 等[13]报道的蛋白质沉淀法去除样品中的杂质。分别取生物样品 (血浆、组织匀浆、尿液和粪便上清液) 50 μL,加入150 μL 含内标氯雷他定 (5 ng/mL) 的甲醇沉淀蛋白,涡漩1 min,于10 000 r/min 下离心10 min,取上清液过0.22 μm 滤膜后,采用UPLC-MS/MS 进行分析。
1.5 标准生物样品和质控样品溶液配制
分别称取一定量2-溴-4-氟乙酰苯胺和内标氯雷他定对照品,用甲醇稀释配制成1 mg/mL 的标准储备液,试验时进一步用甲醇稀释获得2-溴-4-氟乙酰苯胺系列标准工作溶液。分别取空白血浆,心脏、肝脏、脾脏、肾脏及肌肉组织混合匀浆,肺、脂肪、胃、小肠、脑和睾丸组织混合匀浆,以及尿液和粪便上清液,加入含内标氯雷他定的2-溴-4-氟乙酰苯胺标准储备液,分别配制成0.2、0.5、2、8、20、50 和100 μg/mL的标准生物样品溶液;同时用含内标氯雷他定的甲醇配制0.4、5、40 和80 μg/mL 的生物质控样品溶液。
1.6 检测条件
色谱条件:样品通过ACQUITY UPLC BEH C18色谱柱 (2.1 mm × 100 mm,1.7 μm) 进行分离后,以含体积分数0.1%甲酸的水 (A) 和乙腈 (B)作为流动相进行梯度洗脱。梯度洗脱程序:0 min,V (A) : V (B) = 90 : 10;2~3.5 min,V (A) : V (B) =5 : 95;4~5 min,V (A) : V (B) = 90 : 10。流速为0.3 mL/min,进样量7 μL。自动进样器保持在6 ℃,柱温35 ℃。
质谱条件:采用正离子MRM 方式检测,通过分别注入200 ng/mL 的2-溴-4-氟乙酰苯胺和氯雷他定溶液至质谱仪,获得仪器优化参数为:毛细管电压3.0 kV;离子源温度150 ℃;脱溶剂气温度400 ℃;脱溶剂气流速700 L/h;碰撞气流速0.15 mL/min,气帘气流速50 L/h。MRM 检测离子 (m/z) 分别为232.00→111.07 (2-溴-4-氟乙酰苯胺) 和383.08→267.02 (氯雷他定),锥孔电压分别为32 和5 V,碰撞能量22 和32 eV。
方法学验证主要参考Commission Decision 2002/657/EC[14]和Commission Regulation (EU) 2006/401[15],考察了专属性、线性、精密度、准确度、重复性、定量限、检测限、回收率、基质效应和稳定性等。针对所建立方法进行了完整的方法学验证,均满足验证标准[14-16]要求。
1.7 数据统计分析
通过MassLynx V4.1 软件对血浆、组织、尿液和粪便样本的UPLC-MS/MS 检测数据进行采集和分析。血浆样本浓度采用Data Analysis System 3.1 software (DAS, version 3.1) 软件分析。采用非房室模型计算主要的动力学参数:药-时曲线下面积 (area under curve,AUC)、血药峰浓度 (Cmax)、血药浓度达峰时间 (tmax)、半衰期 (t1/2) 以及平均驻留时间 (tmr) 等,并对药物在组织中的分布及经尿液和粪便排泄情况进行分析。根据公式 1 计算各染毒剂量下SD 大鼠血浆中2-溴-4-氟乙酰苯胺的绝对生物利用度 (F)[16]。
式中,AUC(0-t)ig为灌胃染毒后给药时间内药-时曲线下面积,(mg/L)·h;AUC(0-t)iv为静脉注射染毒后给药时间内药-时曲线下面积,(mg/L)·h;miv为静脉注射染毒剂量,mg/kg;mig为灌胃染毒剂量,mg/kg。
2 结果与分析
2.1 检测条件的优化
前期分别考察了不同粒径、孔径和柱长的多种UPLC 色谱柱的分离效果,最终发现采用ACQUITY UPLC BEH C18三键键合烷基色谱柱能获得较好的峰形。对多种洗脱方法 [有机相包括甲醇、乙腈、二甲基亚砜 (DMSO) 及异丙醇等,水相包括不同浓度的甲酸-水、甲酸铵-水、三乙胺-水、三氟乙酸-水及乙酸铵-水等] 进行了筛选,发现采用乙腈作为有机相和在水相中加入体积分数0.1%的甲酸能明显改善分析物峰形。在正离子模式下对锥孔电压、碰撞能量、子离子对和母离子对等质谱条件进行了优化,最终得到1.6 节中各项优化后的质谱参数。在选定的UPLC-MS/MS条件下,2-溴-4-氟乙酰苯胺和内标氯雷他定的洗脱效果均良好,保留时间分别约为1.56 和1.42 min,典型色谱图见图1。标准曲线的线性范围为0.2~100 μg/mL。
2.2 血浆毒物动力学结果
采用200、500、1 000 mg/kg 剂量的2-溴-4-氟乙酰苯胺灌胃和20 mg/kg 剂量静脉注射染毒处理大鼠,通过所建立的UPLC-MS/MS 方法研究了2-溴-4-氟乙酰苯胺在大鼠血浆中的毒代动力学,测定了不同时间点的血药浓度。其药-时曲线见图2,不同剂量染毒后大鼠血浆中2-溴-4-氟乙酰苯胺的毒代动力学参数与剂量的关系见图3,其毒代动力学参数见表1。结果表明:大鼠灌胃染毒后药物可被迅速吸收。500 mg/kg 剂量灌胃染毒组药物吸收达到饱和,其Cmax值和 AUC(0-t)值分别为 (45.2 ±1.8) mg/L和 (393.3 ± 51.1) (mg/L)·h;1 000 mg/kg剂量灌胃染毒组 Cmax和AUC(0-t)值反而均出现下降趋势;表明该毒代动力学变化无剂量依赖性,表现为非线性动力学特征。其曲线下面积比[R_AUC(t-∞)]均大于98.5%,且1 000 mg/kg 剂量组清除率 (CL) 仅为 (0.6 ± 0.1) (L/h)/kg,提示给药时间内2-溴-4-氟乙酰苯胺即可大部分从动物体内消除。从图2 可知,不同染毒剂量下,2-溴-4-氟乙酰苯胺的Cmax值均在给药后4 h 开始下降,在6 h 后又出现上升趋势,随后再缓慢下降,该双峰现象 (double-peak phenomenon) 表明,2-溴-4-氟乙酰苯胺在动物体内可能存在重吸收或肠-肝循环(EHC)。200、500 和1 000 mg/kg 3 个剂量组大鼠血浆中2-溴-4-氟乙酰苯胺的F 值分别为64.2%、83.3% 和34.1%,表明随着剂量的大幅增加,1 000 mg/kg 处理下2-溴-4-氟乙酰苯胺在大鼠体内的绝对生物利用度较低剂量时下降较为明显。
2.3 药物在大鼠组织中的分布情况
结果见表2。其中,单次灌胃染毒后,2-溴-4-氟乙酰苯胺在大鼠组织中分布较广,且除肾脏和胃外均具有相似的组织分布趋势。给药0.5 h 后,2-溴-4-氟乙酰苯胺在各组织中的含量从大到小依次为:小肠>胃>脂肪>心脏>脾脏>肌肉>肾脏>脑>肝脏>睾丸>肺,各组织中总的药-时曲线下面积 (AUC(0-∞)) 从大到小依次为:小肠>脂肪>胃>心脏>肾脏>脾脏>肌肉>脑>肺>肝脏>睾丸,表明2-溴-4-氟乙酰苯胺主要分布在大鼠的小肠、胃和脂肪中,且小肠中含量最高,可达 (309.8 ± 39.5)mg/kg。同时,在大鼠脑组织中也发现了2-溴-4-氟乙酰苯胺,但含量较低,最高仅 (7.3 ± 1.3) mg/kg;另有极少量的2-溴-4-氟乙酰苯胺可到达睾丸;表明该化合物由于具有较高的脂溶性和较低的相对分子质量,因而可穿越血脑屏障和睾丸屏障。2-溴-4-氟乙酰苯胺在各组织样品中的 tmax值均为0.5 h,表明其在组织中扩散分布非常迅速;24 h后在大部分组织中均已检测不到该化合物,表明2-溴-4-氟乙酰苯胺总体上不蓄积。将血浆设为非靶向组织,计算各组织的靶向分配系数 (TDC)[17],发现所有待测组织的TDC 值均小于1.0,提示2-溴-4-氟乙酰苯胺对组织无明显的选择性。
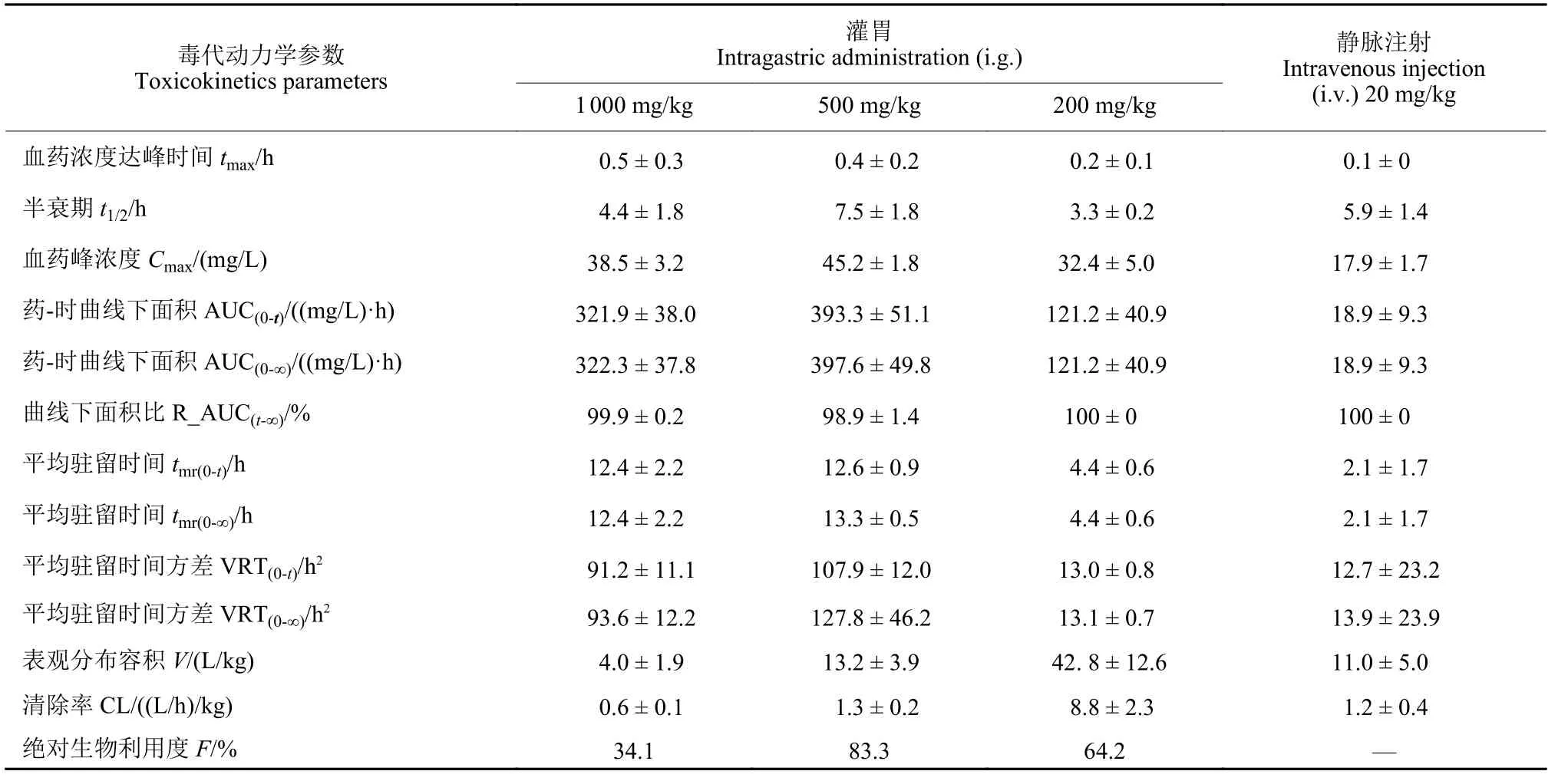
表1 2-溴-4-氟乙酰苯胺在大鼠血浆中的毒代动力学参数 (mean ± SD, n = 5)Table1 Toxicokinetics parameters of BFAA in rat plasma (mean ± SD, n = 5)
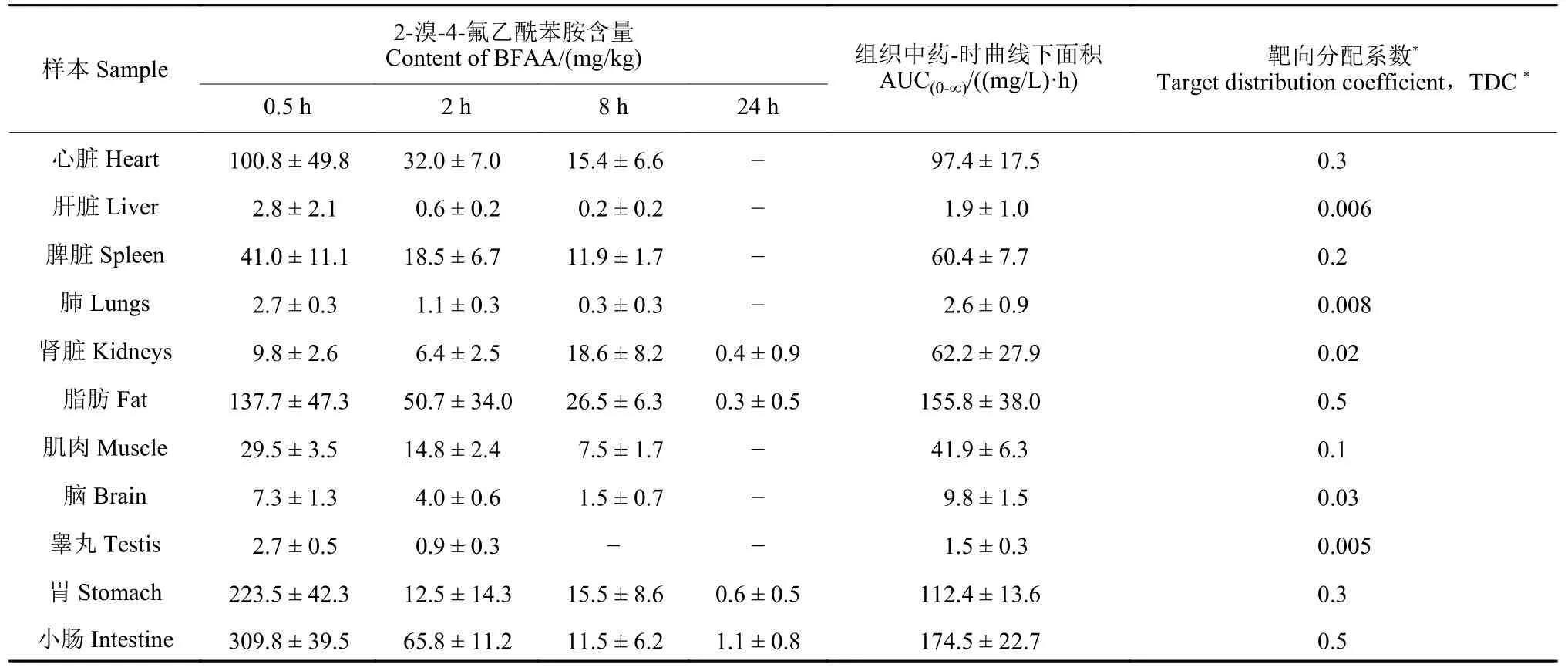
表2 不同染毒时间下大鼠各组织中2-溴-4-氟乙酰苯胺的含量 (mean ± SD, n = 5)Table2 Distribution of BFAA in rat tissues after administration (mean ± SD, n = 5)
2.4 大鼠对2-溴-4-氟乙酰苯胺的排泄状况
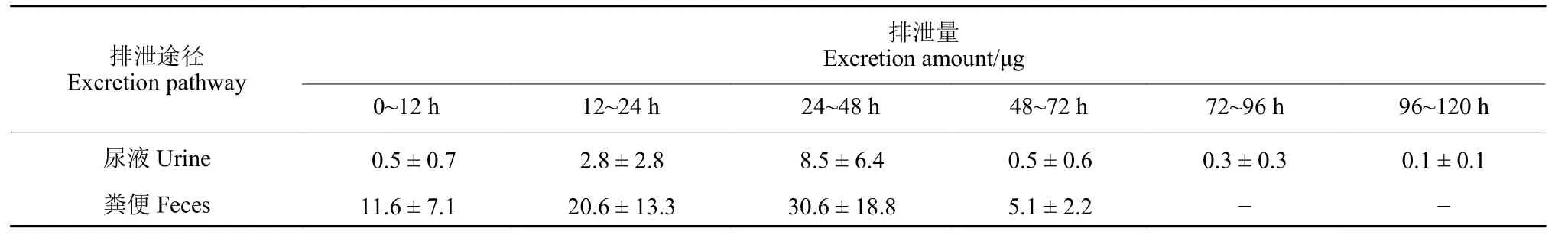
表3 不同时间段大鼠尿液和粪便中2-溴-4-氟乙酰苯胺的排泄量 (mean ± SD,n = 5)Table3 Excretion of BFAA in rat urine and feces after administration during different time periods (mean ± SD,n = 5)

表4 大鼠尿液和粪便中2-溴-4-氟乙酰苯胺的累积排泄量及排泄率 (mean ± SD,n = 5)Table4 Amount and rate of cumulative excretion of BFAA in rat urine and feces (mean ± SD, n = 5)
SD 大鼠灌胃给予1 000 mg/kg 剂量的2-溴-4-氟乙酰苯胺,5 d 内其在各时间段尿液和粪便中的排泄情况见表3。结果显示,该化合物在尿液和粪便内较在血液和组织中消除速度明显减慢。24~48 h 时间段内其在尿液中的排泄量达到峰值(8.5 μg),至120 h 尚有少量残留;其在粪便中的排泄量同样在24~48 h 时间段内达到峰值 (30.6 μg),随后下降,至72 h 后即无残留。2-溴-4-氟乙酰苯胺经尿液和粪便的排泄主要发生在0~48 h 内,分别占总排泄量的93%和92%。表4 显示了大鼠尿液和粪便中2-溴-4-氟乙酰苯胺的累积排泄量及排泄率情况,染毒后5 d,累积排泄量达到稳定,其中,经尿液排泄的2-溴-4-氟乙酰苯胺量为12.8 μg,经粪便排泄的量为67.9 μg,总计排泄量为80.6 μg,占总染毒量 (大鼠体重为271.4 ± 6.2 g) 的0.03%。2-溴-4-氟乙酰苯胺经尿液和粪便排泄率较低的原因可能与该药物在大鼠体内存在广泛的分解代谢有关,提示经尿液和粪便的排泄并非2-溴-4-氟乙酰苯胺母体化合物主要的体内消除途径。
3 结论与讨论
2-溴-4-氟乙酰苯胺是多种N-苯基酰胺类化合物合成的中间体,同时也是合成农药时的重要杂质。2-溴-4-氟乙酰苯胺可在钯催化剂作用下与多个化合物经多步反应获得中间体3, 4-二氯-5-氟-2-联苯乙酰胺,最后再经过酰化反应制得内吸性杀菌剂联苯吡菌胺[18]。由于该合成方式产率较低,因此存在较多杂质,其可能的杂质包括2-溴-4-氟乙酰苯胺、N-(2-乙烯基-4-氟苯基) 乙酰胺、3, 4-二氯-5-氟-2-联苯氨及3, 4-二氯-5-氟-2-联苯乙酰胺等。也有文献报道采用其他途径合成联苯吡菌胺,但产率均低于70%[6,19-20]。因此在采用联苯吡菌胺防治谷类作物病害时,应对其杂质给予重点关注。
2-溴-4-氟乙酰苯胺作为关键的农药中间体及最终产物的杂质,有必要就其对环境、动物和人类的毒性进行有效的安全性评估,但目前尚未见相关的毒理学和代谢过程研究报道。毒物动力学是整个毒理学评价的重要环节,在农药的风险评估中起着非常重要的作用。毒物动力学试验主要通过定量的方法来阐述化合物暴露和染毒剂量与时间之间的关系,可为化合物的各类毒性研究和评估提供剂量选择依据[21-22]。
因此,为了阐明2-溴-4-氟乙酰苯胺在动物体内的代谢动力学,本研究对其在大鼠体内的血浆毒物动力学、组织分布以及经尿液和粪便的排泄情况进行了考察。结果表明:大鼠灌胃染毒后药物可被迅速吸收,不同剂量下其血药浓度达峰时间均不超过30 min,500 mg/kg 剂量以上则药物吸收达到饱和,且血浆毒物动力学变化呈非线性动力学特征。2-溴-4-氟乙酰苯胺的生物利用度达到34.1%~83.3%,可能与引入的氟原子增强了药物分子对生物膜的通透性有关。其血浆的药-时曲线具有双峰现象,推测其在动物体内可能存在重吸收或肠-肝循环[23]。同时该现象进一步解释了2-溴-4-氟乙酰苯胺生物利用度相对较高的原因。2-溴-4-氟乙酰苯胺在大鼠组织中分布较广且非常快速,给药0.5 h 后即可达到浓度峰值,主要分布于小肠、胃和脂肪组织中。组织靶向分配系数结果显示,2-溴-4-氟乙酰苯胺对动物组织无明显的选择性,与血浆中的情形类似,组织中也未出现化合物蓄积。此外,2-溴-4-氟乙酰苯胺可透过睾丸屏障和血脑屏障,这可能与其较高的脂溶性和较低的相对分子质量有关,该结果对进一步研究评估药物的神经毒性和生殖毒性具有参考意义。研究还发现,2-溴-4-氟乙酰苯胺在尿液和粪便内较在血液和组织中消除明显减慢,排泄主要集中在染毒后48 h 内,且其母体化合物经尿液和粪便的排泄率非常低。参考同类化合物N-(4-羟基苯基) 乙酰胺[24]、苯肽胺酸[17]及4-溴乙酰苯胺[25],推测2-溴-4-氟乙酰苯胺在动物体内存在广泛的代谢途径,有可能主要通过去乙酰化、环羟基化、葡萄糖醛酸化或硫酸化等代谢方式排泄到体外。
有关2-溴-4-氟乙酰苯胺代谢产物的研究可通过动物体内提取的生物样本进行酶水解,高效液相色谱-紫外 (HPLC-UV)、核磁共振 (NMR) 及质谱 (MS) 检测结合同位素标记等多种手段进行分离和鉴定,同时还可通过体外肝代谢方法研究其代谢途径和机制,如采用亚细胞片段、基因重组酶、肝细胞培养、肝组织切片及离体肝灌流等方法[26]进行研究。为全面阐明2-溴-4-氟乙酰苯胺的代谢动力学,后续在其代谢产物定性定量、代谢途径及代谢机制等方面可进一步开展相关研究。
