在肺癌患者中联合应用IGRT和还原型谷胱甘肽的治疗效果
2021-03-25丁金泉李晓静温晓梅张群贵李为之黄立肖春晖曾莺婷
丁金泉 李晓静 温晓梅 张群贵 李为之 黄立 肖春晖 曾莺婷


【摘要】 目的:探討肺癌患者联合应用还原型谷胱甘肽和影像引导调强放射治疗(IGRT)的效果。方法:选取2019年1月-2020年12月本院60例肺癌患者,按照随机数字表法将其分为对照组和研究组,每组30例。对照组应用IGRT,研究组在对照组的基础上应用还原型谷胱甘肽。比较两组的近期临床疗效、炎症介质水平、生活质量评分、毒副反应发生情况。结果:研究组近期总有效率为80.00%高于对照组的46.67%,差异有统计学意义(P<0.05)。治疗前,两组各项生活质量评分比较,差异均无统计学意义(P>0.05);治疗后,两组各项生活质量评分均高于治疗前,且研究组均高于对照组,差异均有统计学意义(P<0.05)。治疗前,两组ACE、IL-6、TGF-β、IL-10、TNF-α水平比较,差异均无统计学意义(P>0.05);治疗后,研究组ACE、IL-10水平分别为(788.59±160.38)、(76.23±15.17)pg/mL,
均高于对照组的(581.89±140.18)、(65.06±14.81)pg/mL,IL-6、TGF-β、TNF-α水平分别为(58.36±20.61)、(4 067.26±278.24)、(51.62±20.72)pg/mL均低于对照组的(77.44±20.54)、
(4 987.39±304.17)、(87.05±22.01)pg/mL,差异均有统计学意义(P<0.05)。研究组骨髓抑制、放射性肺炎、放射性食管炎发生率分别为10.00%、3.33%、6.67%,均低于对照组的36.67%、26.67%、26.67%,差异均有统计学意义(P<0.05)。结论:相较于单独应用IGRT,联合应用IGRT+还原型谷胱甘肽治疗效果更佳,可以有效降低毒副反应的发生率以及患者机体中的炎症介质水平,提高治疗效果的同时提高患者的生活质量。
【关键词】 还原型谷胱甘肽 IGRT 肺癌 放疗 毒副反应
Therapeutic Effect of Combined Application of IGRT and Reduced Glutathione in Patients with Lung Cancer/DING Jinquan, LI Xiaojing, WEN Xiaomei, ZHANG Qungui, LI Weizhi, HUANG Li, XIAO Chunhui, ZENG Yingting. //Medical Innovation of China, 2021, 18(32): 0-014
[Abstract] Objective: To investigate the effect of combined reduced glutathione and IGRT in lung cancer patients. Method: A total of 60 lung cancer patients in our hospital from January 2019 to December 2020 were selected, and they were divided into control group and study group according to random number table method, 30 cases in each group. The control group was treated with IGRT, and the study group was treated with reduced glutathione on the basis of the control group. The recent clinical efficacy, changes in inflammatory mediators, quality of life scores, incidence of toxic reactions were compared between two groups. Result: The recent total effective rate in the study group was 80.00%, which was higher than 46.67% in the control group, the difference was statistically significant (P<0.05). Before treatment, there were no significant differences in all dimensions quality of life scores between two groups (P>0.05); after treatment, the all dimensions quality of life scores in both groups were higher than those before treatment, and those in the study group were higher than those in the control group, the differences were statistically significant (P<0.05). Before treatment, there were no significant differences in the levels of ACE, IL-6, TGF-β, IL-10 and TNF-α between two groups (P>0.05); after treatment, the levels of ACE and IL-10 in the study group were (788.59±160.38) pg/mL and
(76.23±15.17) pg/mL, which were higher than (581.89±140.18) pg/mL and (65.06±14.81) pg/mL in the control group, IL-6, TGF-β and TNF-α levels in the study group were (58.36±20.61) pg/mL, (4 067.26±278.24) pg/mL, and (51.62±20.72) pg/mL, which were lower than (77.44±20.54), (4 987.39±304.17), (87.05±22.01) pg/mL in the control group, the differences were statistically significant (P<0.05). The incidence of bone marrow suppression, radiation pneumonitis, and radiation esophagitis in the study group were 10.00%, 3.33%, and 6.67%, respectively, which were lower than 36.67%, 26.67%, 26.67% in the control group, the differences were statistically significant (P<0.05). Conclusion: Compared with IGRT alone, IGRT combined with reduced glutathione has a better therapeutic effect, which can effectively reduce the incidence of toxic reactions and the level of inflammatory mediators in the body of patients, improve the therapeutic effect and improve the quality of life of patients.
[Key words] Reduced glutathione IGRT Lung cancer Radiation therapy Toxic reaction
First-author’s address: Ganzhou Cancer Hospital, Ganzhou 341000, China
doi:10.3969/j.issn.1674-4985.2021.32.003
原发性支气管肺癌简称肺癌,是起源于气管、支气管黏膜或腺体的最常见的一种肺部原发性恶性肿瘤[1]。流行病学显示,全球范围内肺癌的死亡率、发病率均有升高趋势,目前临床中没有明确肺癌的病因,致病因素主要包括职业暴露、吸烟、遗传、肺部病史、空气污染、饮食、电离辐射等[2]。通常此类患者确诊时均处于中、晚期,仅能通过放化疗治疗。影像引导调强放射治疗(IGRT)是常用的治疗方式,其设备上自带锥体束CT,放疗前扫描可以通过电脑矫正误差,保证治疗的精确性,能延长患者的生存周期[3]。随着放疗的广泛应用,如何减轻放射性肺损伤成为临床的关注重点。还原型谷胱甘肽(GSH)是一种还原剂,具有抗氧化及调节代谢的作用,在机体的氧化还原中均有参与,对细胞膜中的蛋白质、巯基酶有保护作用。当机体的细胞组织发生氧化应激、衰老或感染时,其细胞中的生物合成能力会降低,此时适当地给予外源性的还原型谷胱甘肽具有中止细胞损害的效果。近几年,GSH主要作为抗氧化剂用于保肝、护肝的治疗中,有研究指出,将其用于大鼠放射性肺损伤模型中可以减少肺组织中炎性细胞的聚集,降低炎性因子的水平,从而降低急性放射性肺炎的发生风险[4]。本文主要探讨肺癌患者联合应用IGRT+GSH治疗的效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月-2020年12月本院60例肺癌患者。纳入标准:(1)确诊为肺癌;(2)KSP评分≥70分;(3)预计生存周期>6个月;(4)初次放疗。排除标准:(1)有精神病史;(2)合并真菌感染、高血压或糖尿病;(3)合并其他恶性肿瘤;(4)合并心、肝、肾等器官功能不全;(5)研究前3个月应用过免疫抑制剂、糖皮质激素;(6)合并凝血、免疫功能障碍;(7)肺癌已经转移;(8)合并肺气肿、肺源性心脏病等疾病[5]。按照随机数字表法将患者分为对照组和研究组,每组30例。本研究获得伦理会准许,患者均签订知情同意书。
1.2 方法 治疗前均给予患者常规检查。对照组应用IGRT治疗,确定计划靶区(PTV)、肿瘤靶区(GTV)、临床靶区(CTV),之后依据危及器官受量、肺功能确定放疗计划。放疗通过中心照射治疗,总剂量:50~66 Gy,剂量2.0 Gy/(次·d),5次/周
(周一到周五)。研究组在对照组的基础上应用还原型谷胱甘肽(生产厂家:山东绿叶制药有限公司,批准文号:国药准字H20030002,规格:0.6 g)
1.8 g+0.9%氯化钠溶液100 mL,混合均匀后在放疗前1 h,静脉滴注,1次/d。4周为一个疗程,两组共治疗4个疗程观察效果。
1.3 观察指标与判定标准 (1)比较两组近期(治疗4个疗程后)疗效。依据WHO制定相关标准进行判定,①未出现新病灶且所有靶病灶均完全消失,持续时间>4周代表完全缓解(CR);②靶病灶的最大直径和减少程度≥30%,持续时间>4周代表部分缓解(PR);③有新病灶出现,或靶病灶最大直径和增加程度≥20%代表进展(PD);④靶病灶最大直徑和减少程度<PR,或增大程度<PD代表稳定(SD)。总有效=CR+PR。(2)比较两组治疗前后生活质量,通过SF-36生活质量量表进行评估,其主要包含8个维度,即社会功能、生理功能、精神健康、生理职能、活力、总体健康、躯体疼痛、情感职能,每个维度均为百分制,分数与生活质量呈正相关。(3)比较两组治疗前后的炎症介质水平,包括血管紧张素转换酶(ACE)、白细胞介素-6(IL-6)、转化生长因子-β(TGF-β)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α),抽取患者5 mL空腹静脉血采用酶联免疫吸附法进行检测。(4)比较两组的毒副反应发生情况,包括骨髓抑制、放射性肺炎、放射性食管炎。
1.4 统计学处理 采用SPSS 18.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 兩组一般资料比较 研究组女14例,男16例;年龄37~68岁,平均(55.41±2.16)岁;疾病类型:9例肺鳞癌,21例肺腺癌;TNM分期:4例Ⅱ期,16例Ⅲ期,10例Ⅳ期。对照组女12例,男18例;年龄37~68岁,平均(55.64±2.10)岁;疾病类型:11例肺鳞癌,19例肺腺癌;TNM分期:5例Ⅱ期,17例Ⅲ期,8例Ⅳ期。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组近期临床疗效比较 研究组近期总有效率为80.00%高于对照组的46.67%,差异有统计学意义(字2=6.426,P<0.05),见表1。
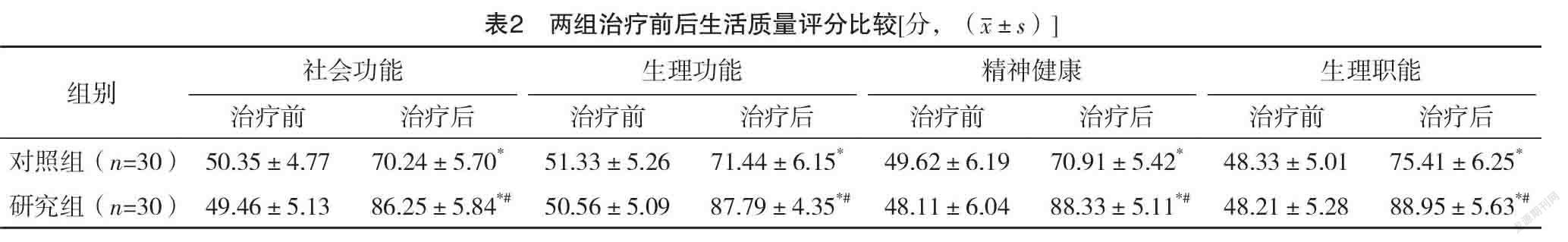
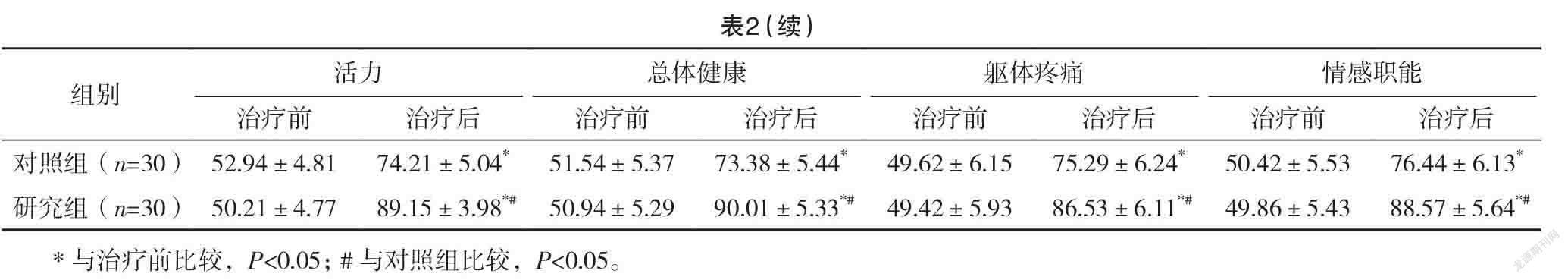
2.3 两组治疗前后生活质量评分比较 治疗前,两组各项生活质量评分比较,差异均无统计学意义(P>0.05);治疗后,两组各项生活质量评分均高于治疗前,且研究组均高于对照组,差异均有统计学意义(P<0.05)。见表2。
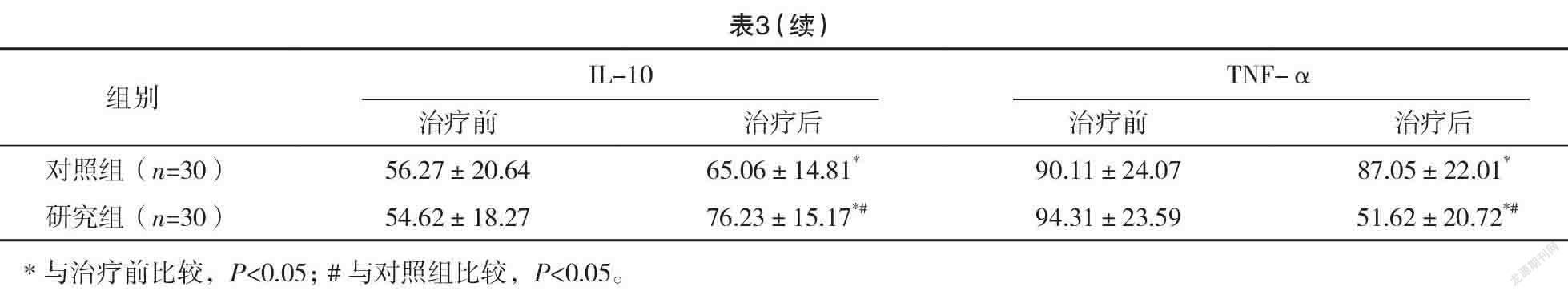
2.4 两组治疗前后炎症介质水平比较 治疗前,两组ACE、IL-6、TGF-β、IL-10、TNF-α水平比较,差异均无统计学意义(P>0.05)。治疗后,两组ACE、IL-10水平均高于治疗前,TGF-β、IL-6、TNF-α水平均低于治疗前,且研究组ACE、IL-10水平均高于对照组,TGF-β、IL-6、TNF-α水平均低于对照组,差异均有统计学意义(P<0.05)。见表3。
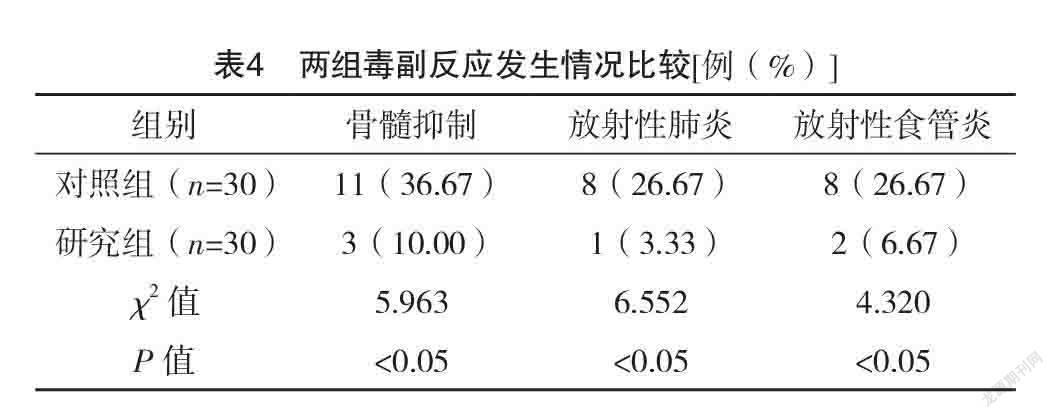
2.5 两组毒副反应发生情况比较 研究组骨髓抑制、放射性肺炎、放射性食管炎发生率均低于对照组,差异均有统计学意义(P<0.05),见表4。
3 讨论
肺癌是常见的一种恶性肿瘤,依据组织病理学特点不同,可以分为小细胞癌和非小细胞癌,其中非小细胞肺癌主要包含鳞癌、腺癌两个亚型。肺癌没有传染性但具有一定的遗传易感性和家族聚集性。肺癌患者的临床症状和肿瘤的类型、大小、发生部位、发展阶段、有无并发症、转移等密切相关,部分患者可能没有明显的疾病症状,当疾病发展到一定阶段才出现;而有症状的患者最常出现的症状为喘鸣、咳嗽、发热、胸痛、咯血等,严重的会导致呼吸衰竭。较多患者确诊时均处于中晚期,往往失去了最佳的手术时机,具有较高的病死率,且中晚期患者的自然生存期相对较短,严重威胁患者的生命安全[6]。目前针对中晚期的肺癌患者多给予放、化疗,但放、化疗均会损伤患者的机体,因此临床中需要深入研究,找到能降低不良反应发生率同时也能保证疗效的方法[7]。
放疗治疗肺癌时其放射线会引发并发症,临床中常见的并发症就是放射性肺炎,主要发生原因是正常肺组织受到放射线的损伤发生特殊炎症[8]。放射治疗时放射线损伤正常组织无法避免,损伤后会导致肺组织的毛细血管通透性增加,引发免疫因子浸润、肺泡水肿,从而导致不可逆的肺组织损伤[9]。相关研究指出,肺组织正常单次最高的承受放射性物质的量小于5 Gy,总量低于50 Gy,如果治疗时超出上述剂量,会损伤正常的肺组织引发炎症[10]。一旦发生放射性肺炎,会对靶区剂量造成限制,导致患者的局部控制率较低,且其会引发呼吸困难、咳嗽等症状,严重影响患者的生活质量[11]。
谷胱甘肽其活性状态就是还原型谷胱甘肽(GSH),其在哺乳动物体内广泛分布,是一种低分子多肽物质,其主要功能基团是巯基,具有整合解毒,维持、修复细胞膜的生物功能,保护细胞膜,抗氧化,减轻细胞损伤的作用,常用于降低放疗导致的心肌毒性、放射性黏膜炎以及神经毒性的治疗中[12]。同时其对机体中氧自由基的清除以及蛋白质的合成有利,可以有效避免器官组织的过氧化损伤,从而保护细胞[13]。另外,巯基能结合碘乙酸、铅等毒素,达到整合解毒的效果,有利于机体中有毒物质的排泄,从而降低放疗导致的细胞组织损伤[14]。相关研究表明,放疗药物的毒性损害肝脏时,会诱导大量氧自由基的生存,导致肝脏过氧化损伤,同时会抑制肝脏中谷胱甘肽的合成,加速其消耗,导致肝脏形成了恶性损伤循环[15]。有研究证实,针对肺癌放疗治疗患者,给予外源性GSH,可以有效改善患者体内的谷胱甘肽含量,GSH可以结合放疗药物的代谢物,从而达到整合解毒的效果,能有效提高患者肝细胞的抗氧化能力,具有保护肝细胞,增强肝脏代谢活性的作用[16]。另外,其活性物质巯基可以结合肝脏中的自由基,从而加速氧自由基的清除,降低肝脏的过氧化损伤[17]。以往有研究证实,肾脏对谷胱甘肽的利用能力和其对放疗药物毒性的抵抗作用呈正相关[18]。另有研究表明GSH联合顺铂应用于恶性肿瘤的治疗中,在不影响治疗效果的同时可以降低顺铂导致的肝肾损伤[19]。本结果显示:研究组骨髓抑制、放射性肺炎、放射性食管炎发生率均低于对照组,差异均有统计学意义(P<0.05),表明IGRT治疗后的肺癌患者应用GSH治疗可以有效降低发生毒副反应的概率,有利于治疗效果的提高。放射性肺损伤是放射性治疗后最严重的一种并发症,对患者的生存质量有严重影响[20]。靶细胞损伤产生会增加细胞因子的合成,细胞中炎症介质的相互传导会引发肺组织损伤[21]。有研究指出,放射性肺损伤的发生与多种细胞因子的相互作用有关,且有研究证实放射性肺损伤的发生和ACE、IL-6等细胞因子水平密切相关。ACE是一种外肽酶,能反映血管内皮细胞的功能,有研究指出,肺癌患者治疗中ACE的水平表达越低就代表肺部损伤越严重,患者的死亡风险更大、治愈率更低[22]。IL-6在放射性肺损伤的进展中有参与,是重要的一种促炎性因子,主要由肺成纤维细胞、肺泡巨噬细胞、T细胞以及肺泡Ⅱ型商品细胞产生。TGF-β有调节免疫功能以及细胞的生长分化的作用;TNF-α是重要的延续反应细胞因子,与IL-6一样在放射性肺损伤的进展中有重要作用[23]。IL-10是重要的一种多功能负性调节因子,也是最重要的一种抗炎性细胞因子。本研究结果显示:治疗后,研究组ACE、IL-10水平均高于对照组,TGF-β、IL-6、TNF-α水平均低于对照组,差异均有统计学意义(P<0.05)。表明IGRT治疗后的肺癌患者应用GSH治疗可以减低患者机体中的炎性因子水平,有利于降低并发症发生率。
生活质量能综合反应放疗患者的生存状态,同时也可以用于治疗方式是否可取的评估中[24]。结果还显示:研究组近期总有效率为80.00%高于对照组的46.67%,差异有统计学意义(P<0.05)。治疗后,研究组生理功能、躯体疼痛、社会功能、总体健康评分均高于对照组,差异均有统计学意义(P<0.05)。表明IGRT治疗后的肺癌患者应用GSH治疗可以提高治疗效果和患者的生活质量。
综上所述,相较于单独应用IGRT,联合应用IGRT+还原型谷胱甘肽治疗效果更佳,可以有效降低毒副反应的发生率以及患者机体中的炎症介质水平,提高治疗效果的同时提高患者的生活质量,值得推广和应用。
参考文献
[1] Hussain T,Al-Attas O S,Alamery S,et al.The plant flavonoid,fisetin alleviates cigarette smoke-induced oxidative stress,and inflammation in Wistar rat lungs[J/OL].Journal of Food Biochemistry,2019,43(3):e12962.
[2] Luengo A,Abbott K L,Davidson S M,et al.Reactive metabolite production is a targetable liability of glycolytic metabolism in lung cancer[J].Nature Communications,2019,10(1):5604.
[3]李洪振,高献书,亓昕,等.寡转移CRPC原发灶与转移灶全覆盖放疗的疗效和毒性反应分析[J].中华泌尿外科杂志,2021,42(2):122-126.
[4] Fereidoonnezhad M,Mirsadeghi H A,Abedanzadeh S,et al.
Synthesis and biological evaluation of thiolate gold(I) complexes as thioredoxin reductases (TrxRs) and glutathione reductase (GR) inhibitors[J].New Journal of Chemistry,2019,43(33):13173-13182.
[5] Marcen M,Cebrian G,Ruiz-Artiga V,et al.Protective effect of glutathione on Escherichia coli cells upon lethal heat stress[J].Food Research International,2019,121:806-811.
[6]贾春雷,乔俏,韩凝,等.诊断级CT系统对鼻咽癌患者调强放射治疗中摆位误差的评估[J].中国医科大学学报,2020,49(1):93-96.
[7] Xu Y,Bankhead A,Tian X,et al.Deletion of Glutathione S-Transferase Omega 1 Activates Type I Interferon Genes and Downregulates Tissue Factor[J].Cancer Research,2020,80(17):530.
[8]何天宇,李思涵,李光.磁共振增强扫描序列在合并阻塞性肺炎或肺不张肺癌放疗靶区勾画价值[J].中华放射肿瘤学杂志,2020,29(5):369-373.
[9] Yang H,Xiang S,Kazi A,et al.The GTPase KRAS suppresses the p53 tumor suppressor by activating the NRF2-regulated antioxidant defense system in cancer cells[J].Journal of Biological Chemistry,2020,295(10):3055-3063.
[10]代元飛.图像引导放疗(IGRT)在肺部恶性肿瘤治疗中的应用价值[J].名医,2019,7:158.
[11] Bruntz R C,Belshoff A C,Zhang Y,et al.Inhibition of Anaplerotic Glutaminolysis Underlies Selenite Toxicity in Human Lung Cancer[J].Proteomics,2019,19(21-22):1800486.
[12]李崇尧,陈莹莹,宋鹏,等.增塑剂DIDP对肝脏氧化应激损伤及VitE拮抗作用研究[J].生态毒理学报,2019,14(6):170-178.
[13] Hong B J,Park W Y,Kim H R,et al.Oncogenic KRAS Sensitizes Lung Adenocarcinoma to GSK-J4-Induced Metabolic and Oxidative Stress[J].Cancer Research,2019,79(22):5849-5859.
[14]李娟,何娟,毛恩强,等.还原型谷胱甘肽对重症患者使用万古霉素致药物性肾损伤的保护作用[J].中华危重病急救医学,2020,32(7):819-823.
[15] Gorrini C,Mak T W.Glutathione Metabolism:An Achilles’ Heel of ARID1A-Deficient Tumors[J].Cancer Cell,2019,35(2):161-163.
[16]金磊,郭洁,刘昊,等.汉防己甲素通过促进HIF-1α降解增强p53缺陷型非小细胞肺癌的放疗敏感性[J].中国肿瘤临床,2020,47(20):24-30.
[17] GUO W W,ZHANG Z T,WEI Q C, et al.Intracellular Restructured Reduced Glutathione-Responsive Peptide Nanofibers for Synergetic Tumor Chemotherapy[J].Biomacromolecules,2020,21(2):444-453.
[18] Safaeipour M,Jauregui J,Castillo S,et al.Glutathione Directly Intercepts DNA Radicals to Inhibit Oxidative DNA-Protein Cross-Linking Induced by the One-Electron Oxidation of Guanine[J].Biochemistry,2019,58(46):4621-4631.
[19]许锦彪,邱峰.局限期小细胞肺癌胸部放疗剂量和分割方式研究进展[J].中华放射肿瘤学杂志,2019,28(6):463-466.
[20] Demecsová L,Zelinová V,Liptáková L,et al.Indole-3-butyric acid priming reduced cadmium toxicity in barley root tip via NO generation and enhanced glutathione peroxidase activity[J].Planta,2020,252(3):46.
[21]李娟,张海英,胡伟刚,等.应用射野角度和多目标优化提高肺癌放疗计划的执行效率[J].中国癌症杂志,2019,29(3):48-53.
[22]张惠姗,王捷忠,張伟,等.局部晚期非小细胞肺癌患者放化疗的预后相关因素分析[J].福建医科大学学报,2019,53(4):32-37.
[23] QIN Z,DU T,ZHENG Y,et al.Glutathione Induced Transformation of Partially Hollow Gold-Silver Nanocages for Cancer Diagnosis and Photothermal Therapy[J/OL].Small,2019,15(35):e1902755.
[24]王珍珍,李啸天,阮翘,等.18F-FMISO PET/CT对非小细胞肺癌放疗前后乏氧情况的监测及疗效评价[J].中华核医学与分子影像杂志,2019,39(5):262-265.
(收稿日期:2021-10-08) (本文编辑:张明澜)
