1,25二羟维生素D3对哮喘小鼠的Rac1-IL33-ILC2通路的作用
2021-03-19杨国建
杨国建,李 敏,2
(1.西南医科大学,四川 泸州 646000;2.四川省医学科学院·四川省人民医院儿科,四川 成都 610072)
支气管哮喘是多种细胞及细胞因子参与的慢性疾病。其发病机制十分复杂,Th1辅助细胞(Th1)和Th2辅助细胞(Th2)的亚群失衡、调节性T细胞(Tregs)和TH17辅助细胞(Th17)的亚群失衡,致Th2表达亢进,分泌大量的Th2 型细胞因子(IL-4、IL-5 和 IL-13)引起气道炎症而导致相应的病理变化;近年来研究发现,1,25二羟维生素D3[1,25-(OH)2-D3]、2型固有淋巴细胞等在哮喘的发生、发展中有重要作用[1]。本实验通过1,25-(OH)2-D3干预后哮喘小鼠的行为学表现是否改善,以及肺组织中C3 肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)、白细胞介素-33(interleukin,IL-33)和2型固有淋巴细胞(type 2 innate lymphocytes,ILC2)的表达变化,判断1,25-(OH)2-D3对哮喘小鼠的Rac1,IL-33及ILC2有无影响。现报道如下。
1 资料与方法
1.1 一般资料小鼠由成都达硕实验动物有限公司提供。所有动物均饲养于四川省人民医院动物实验室。2019年4月,选取7 周龄SPF级BALB/c雌性小鼠30只,体重(22.3±1.5)g,采用随机数字表法分为对照组、哮喘组和干预组,每组10只。
1.2 方法
1.2.1造模及实验干预 参照经典哮喘小鼠建模方法[2,3]略加修改。在实验第1、8和15天,将致敏液0.2 ml(含100 μg,氢氧化铝2 mg)分别腹腔注射至哮喘组和干预组小鼠;从第22天开始,每天用1% 鸡卵蛋白与生理盐水的混合溶液2 ml(含鸡卵蛋白20 mg)雾化吸入30分钟,连续14天以构建哮喘模型,干预组于雾化前半小时腹腔注射1,25-(OH)2-D3液0.08 ml(含1,25-(OH)2-D3 0.08 μg),每天1次,共14次,哮喘组给予生理盐水等量代替。对照组则使用等量生理盐水替代致敏液、1% 鸡卵蛋白和1,25-(OH)2-D3行腹腔注射和雾化。雾化结束当天对各组小鼠采取断头处理,取相同部位肺组织进行相关检测。
1.2.2肺组织标本HE染色 取小鼠部份左肺组织制备病理切片后行HE染色,在普通光镜下观察气道组织的形态学变化。
1.2.3蛋白免疫印迹法检测Rac1和IL-33的蛋白定量 取左肺组织,充分剪碎研磨得到组织悬液,用蛋白免疫印迹法检测Rac1和IL-33蛋白表达水平
1.2.4流式细胞仪检测ILC2细胞数目 将小鼠右肺组织经物理研磨和过滤后,离心分离,制备单细胞混悬液,取约1×106细胞于1.5 ml EP管中,加入ILC2抗体孵育,上机检测ILC2细胞数目。
1.3 统计学方法应用SPSS 22.0软件进行统计分析。计量资料以均数±标准差表示,符合正态分布的数据比较采用t检验。使用直线相关分析判定Rac1、IL-33和ILC2之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 行为学及病理形态变化雾化后哮喘组小鼠出现烦躁、在笼内来回走动、毛发竖起、点头呼吸、呼吸加快加深、前肢缩抬、二便失禁等症状。干预组的上述表现在程度和持续时间上明显减少。对照组仅在注射生理盐水5 min内出现烦躁不安,但无其他表现,并很快恢复正常。小鼠气道组织病理形态学变化HE染色图见图1所示,哮喘组小鼠气道壁充严重充血及伴有水肿,管腔狭窄且肺泡腔缩小;对照组支气管壁光滑完整,上皮细胞排列整齐;干预组气道壁光滑,管腔狭窄且肺泡腔缩小减轻明显。证实小鼠哮喘模型构建成功。
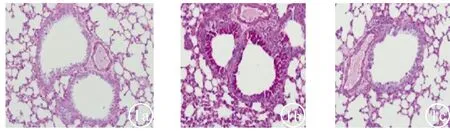
图1 小鼠气道组织HE染色图(×400) a:对照组;b:哮喘组;c:干预组
2.2 三组小鼠Rac1和IL-33比较哮喘组和干预组的Rac1值较对照组明显降低,但用1,25-(OH)2-D3干预后的干预组Rac1增加,仍低于对照组;哮喘组和干预组的IL-33值较对照组明显增加,但用1,25-(OH)2-D3干预后的干预组IL-33较哮喘组有降低,仍高于对照组,差异有统计学意义(P<0.05),见表1和图2。
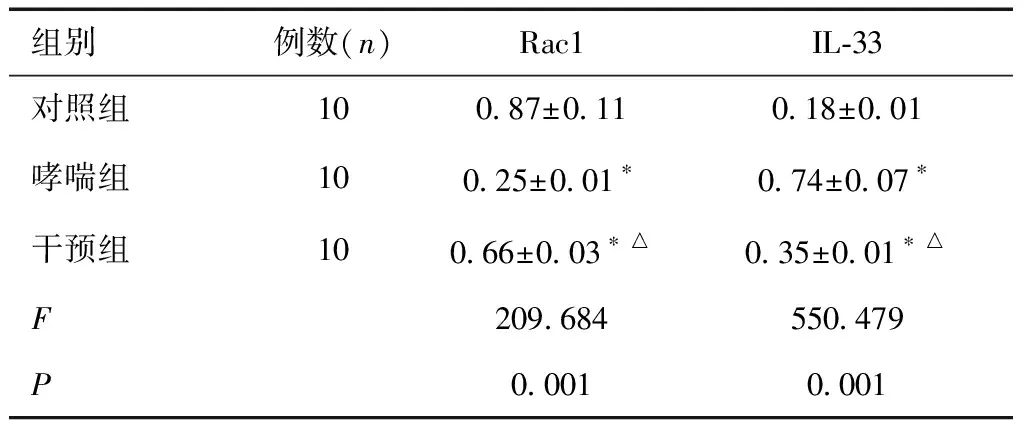
表1 三组小鼠Rac1和IL-33比较
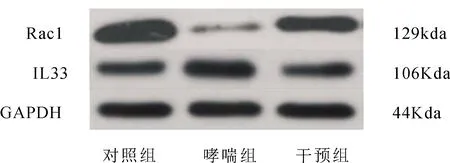
图2 三组Rac1和IL-33比较
2.3 三组小鼠ILC2计数结果分析如表2和图3所示,哮喘组和干预组的ILC2的数量较对照组明显增加。但经1,25-(OH)2-D3干预后的干预组ILC2数量明显降低,仍高于对照组,差异有统计学意义(P<0.05)。
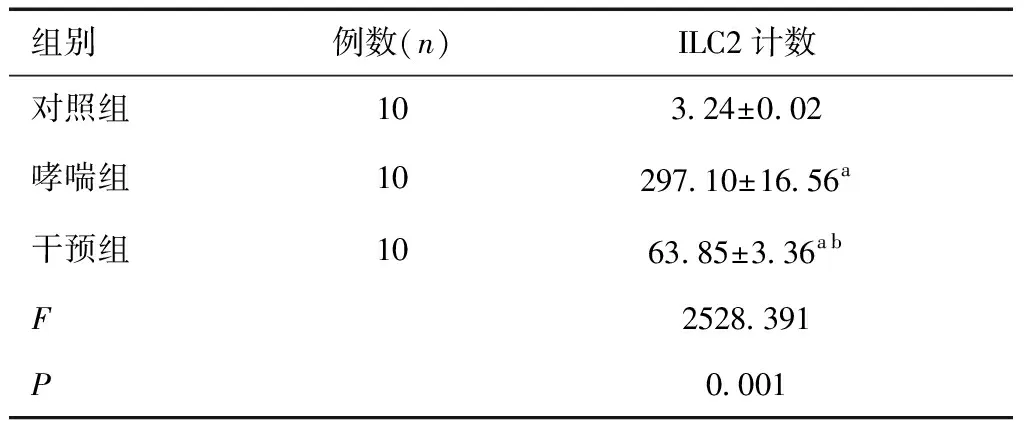
表2 三组小鼠ILC2计数比较 (104/ml)
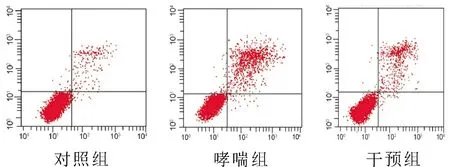
图3 三组ILC2计数结果
2.4 Rac1、IL-33、ILC2之间的相关性分析三组小鼠中,Rac1和IL-33之间、Rac1和ILC2之间呈负相关关系(r=-0.954、r=-0.957,P<0.05);IL-33和ILC2之间为正相关关系(r=0.984,P<0.05)。
3 讨论
ILC2是一类不同于 T 细胞、B 细胞的淋巴细胞。在受到外来抗原,如病毒以及其他微生物或寄生虫刺激时,气道组织中多种细胞包括上皮细胞、树突状细胞、肺泡巨噬细胞可产生IL-33,IL-33进一步可激活ILC2使其呈活化状态,活化的ILC2一方面可促进 Th2 细胞的增殖,维持哮喘机体的 Th2 极化状态[4],另一方面分泌大量的Th2 型细胞因子IL-5、IL-9和IL-13,引起气道内嗜酸性粒细胞浸润和聚集、杯状细胞分化和粘液产生、上皮细胞过度增生、气道平滑肌收缩和气道纤维化,最终导致支气管高反应。Rac1是一种小GTP酶,在气道上皮细胞吞噬清除凋亡细胞和抗炎症环境形成的过程中起着不可或缺的作用。Rac1的表达能够加强吞噬活性或吞噬途径的抗炎症功能。已有实验研究表明,用OVA(鸡卵蛋白)或 HDM(屋尘螨)作为抗原诱导和激发的小鼠哮喘模型中,在小鼠的支气管上皮细胞中选择性地删除 Rac1,会导致上皮细胞吞噬凋亡细胞的清除能力障碍,使 Th2 免疫应答增强和哮喘炎症加重[5,6]。另有研究表明,哮喘小鼠的气道上皮细胞中Rac1的表达水平明显低于正常小鼠;将正常小鼠气道上皮细胞中Rac1选择性删除后,在外来抗原刺激时,IL-33 的表达水平会显著增加,并大量激活ILC2[7~9]。本研究发现哮喘组较对照组Rac1显著下降,IL-33水平增高,ILC2 数目显著升高,且Rac1与IL-33、ILC2都呈明显的负相关关系。而IL-33和ILC2呈明显的正相关性,证实哮喘小鼠确实存在Rac1-IL33-ILC2通路的免疫变化。
1,25-(OH)2-D3能抑制成纤维细胞的功能,抑制平滑肌细胞的增值,通过调节气道平滑肌相关基因的转录,使气道重塑和炎症反应减轻[10,11]。研究表明,1,25-(OH)2-D3能减少呼吸道上皮细胞 IL-33 的表达[12],抑制ILC2活化[13],但1,25-(OH)2-D3对气道上皮细胞中Rac1的作用未知。本研究在成功建立哮喘模型后发现,应用1,25-(OH)2-D3进行干预的干预组其气道炎症明显减轻;并且IL-33及ILC2的数目均较哮喘组显著下降,Rac1显著上升。因此推测,1,25-(OH)2-D3可能通过上调哮喘小鼠 Rac1 的表达水平,抑制IL-33的产生,使之水平降低,进而抑制ILC2的活化,减轻哮喘气道炎症,从根本上控制哮喘的发生和发展。
综上,1,25-(OH)2-D3可通过调节哮喘小鼠的部份免疫变化来改善气道炎症,希望在未来能进一步研究该机制,为1,25-(OH)2-D3治疗哮喘提供更多依据。
