头足类鞘亚纲繁殖力研究进展
2021-03-18林东明宣思鹏陈新军
林东明,宣思鹏,陈新军,5
(1.上海海洋大学海洋科学学院,上海 201306;2.大洋渔业资源可持续开发省部共建教育部重点实验室,上海 201306;3.国家远洋渔业工程技术研究中心,上海 201306;4.农业农村部大洋渔业开发重点实验室,上海201306;5.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛 266071)
头足类是古老而高等的海生软体动物,自寒武纪出现至今已有5亿年[1]。现生头足类动物分为鹦鹉螺亚纲(Nautiloidea)和鞘亚纲(Coleoidea),其中鹦鹉螺亚纲仅鹦鹉螺目(Nautiloidea)鹦鹉螺科(Nautilidae)下的异鹦鹉螺属(Allonautilus)和鹦鹉螺属(Nautilus)2个属,共7个种;而鞘亚纲分为十腕总目(Decabrachia)和八腕总目(Octobrachia)2个总目,共8个目、46个科、147个属,约756种[2]。在海洋生态系统中,头足类处于食物链中上层,既是各种浮游生物、鱼类、甲壳类等的捕食者,也是许多大型鱼类、哺乳类和海鸟等的主要食物来源[1,3]。此外,因其生长速度快、世代更替周期短、资源量丰富等特点,头足类也已经成为世界海洋渔业资源开发利用的重要捕捞对象,近十年来头足类渔业的年平均渔获量占世界年渔获总量的5.2%左右[4]。
头足类对环境波动变化的敏感性高,年间资源量变化大。个体繁殖力作为反映生殖机能强弱及其后代繁衍能力的重要表征指标之一,对研究群体资源量变化规律具有重要的理论和实践意义[5]。同时,个体繁殖力在一定程度上表征了后代的数量大小[6],并且个体间(或群体间)因其栖息环境的变化还存在显著性差异[7],可见开展头足类的繁殖力特性研究对于海洋生态系统研究也具有重要意义。为此,本文基于国内外学者对头足类繁殖力的研究情况、头足类繁殖力的定义类别及其估算方法、鞘亚纲下八腕目、乌贼目和枪形目中常见种类的繁殖力大小及种间繁殖力差异的影响因子等进行了概括与分析,旨在深入认知头足类繁殖力特性,为我国在世界头足类资源生物学、开发利用、评估管理等方面的研究与政策制订提供科学支持与借鉴。
1 头足类繁殖力的定义及其测定方法
类似于海洋鱼类,头足类的繁殖力测定以估算其生殖系统中的配子数量为参考。其中,雌性个体的配子发生于卵巢,成熟配子暂存于输卵管或者卵巢腔,个体繁殖力以计数卵巢卵母细胞和成熟卵子为对象[8];雄性个体的配子发生于精巢,精荚腺组装精荚,成熟精荚暂存于精荚囊(或称作尼氏囊)中,个体繁殖力以计数精荚为对象[8]。
1.1 雌性繁殖力
一般地,根据不同种类的产卵策略类型及其研究目的,雌性个体的繁殖力可以定义为潜在繁殖力(potential fecundity,PF)[7,9]、最大潜在繁殖力(maximum potential fecundity,MPF)[7]、实际繁殖力(actual realized fecundity,ARF)[7]、有效繁殖力(effective fecundity,EF)[10]、相对繁殖力(relative fecundity,RF)[7,9]、相对实际繁殖力(relative actual realized fecundity,RARF)[11]等(表1)。其中,潜在繁殖力是指卵巢中卵径大于0.05 mm的卵母细胞数量和输卵管或卵巢腔中成熟卵子数量之和[7,9]。该定义兼顾了头足类卵巢卵母细胞的非同步发育及其间歇性产卵情况的发生,基本体现了雌性个体生命周期内所能产生的所有卵母细胞,被认为在一定意义上代表了个体繁殖力的理论值[7]。
最大潜在繁殖力和实际繁殖力是潜在繁殖力定义的延伸。前者为繁殖产卵期个体的理论排卵数量,定义为繁殖期内个体的潜在繁殖力与卵巢空滤泡数量之和再减去输卵管中的成熟卵子数量[12]。最大潜在繁殖力,适用于间歇性产卵、多次产卵和连续性产卵等种类的繁殖力估算,表征个体繁殖期内所能产生并排出的卵子数的理论值。后者,则定义为繁殖个体在产卵前和产卵中之间、以及产卵中与产卵后之间等潜在繁殖力的差值,可用于表征个体在某一个发育阶段的产卵数量情况[7,11]。
有效繁殖力,定义为头足类物种雌性个体在某一段繁殖期内或生命周期内可以成功排出并完成授精的卵黄卵母细胞和成熟卵子的数量之和[10]。该定义适用于间歇性产卵和连续产卵个体的繁殖力研究,并且对于人工养殖环境下繁殖个体的繁殖力研究尤为适用,表征了个体的实际且有效排出并授精的配子数目[13]。理论上,有效繁殖力表征为可以自然排出卵巢并完成授精的卵子数,直接体现了个体潜在繁殖力的有效部分[10]。部分学者也将该繁殖力定义为绝对繁殖力[14-16]。
相对繁殖力,是指雌性个体潜在繁殖力与其体质量或胴长的比值[7,9],部分学者也有表示为有效繁殖力与其体质量或胴长的比值[14-16]。因此,相对繁殖力也称为体质量相对繁殖力,或称为胴长相对繁殖力[16-18]。同时,为了更好地反映个体的繁殖力情况及其繁殖投入水平,部分学者在相对繁殖力的基础上,提出了潜在繁殖投入指数(index of potential reproductive investment,PRI)的概念,将其定义为相对繁殖力与单个成熟卵子重量的乘积[7,9]。该指数适用于评估雌性个体在整个产卵时期的潜在生殖投入水平。相对于性腺指数(gonad somatic index,GSI),潜在繁殖投入指数更能体现出不同属种之间生殖投入的差异性[7,9]。
1.2 雄性繁殖力
相比较于雌性繁殖力,头足类物种雄性个体繁殖力的研究相对缺乏,这可能与雄性个体配子大小及其配子组装机制密切有关。头足类雄性的配子产生于精巢,数量大、外形结构小,并且肉眼难以辨识[3,8]。配子产生后在精荚复合体里组装成管状的精荚,而后存储于精荚囊(或者称为尼氏囊)[8]。其中,精荚的结构相对复杂,主要由精团、胶合体和放射导管等3部分组成[3](图1)。

图1 头足类精荚结构示意图(引自JEREB和ROPER[3])Fig.1 Spermatophoreofcephalopodspecies(from JEREBandROPER[3])
因此,雄性个体的繁殖力以精荚囊中的精荚为计数对象,所计数的精荚数量即为潜在繁殖力[19-20]。然而,基于精荚囊所计数的精荚数目表征了雄性个体在某一个发育时期所产生的即时繁殖力,部分学者也称之为实际繁殖力[11]。相对繁殖力则计算为潜在繁殖力与体质量的比值。此外,因为雄性个体的配子组装在精荚的精团中,精团大小与精荚长度密切相关[3];所以精荚长度指数(精荚长度与个体胴长的比值[21])也被用于表征雄性个体的繁殖力大小,并用于属种间繁殖力的分析比较[22-23]。
2 鞘亚纲种类繁殖力大小
2.1 雌性繁殖力
2.1.1 八腕目
八腕目雌性个体的潜在繁殖力,目前已报道的最大值在百万粒卵母细胞以上,最小繁殖力则在百粒左右(表 2)。其中,快蛸(Ocythoetuberculata)的潜在繁殖力最大,最高值达117万粒卵母细胞[24-25];次之为真蛸(Octopus vulgaris),其潜在繁殖力的最大值达63万余粒卵母细胞[26]。哈勃氏蛸(O.hubbsorum)[19]、水孔蛸(Tremoctopusviolaceus)[24]等的潜在繁殖力最大值也相对较高,分别为42余万粒卵母细胞和30余万粒卵母细胞。在深海和南大洋等海域栖息的种类,如爱尔斗蛸(Eledonemoschata)[27]、球形深海多足蛸(Bathypolypussponsalis)[28]等,其潜在繁殖力则均在500粒卵母细胞以内。
在有效繁殖力方面,目前已报道的八腕目有效繁殖力最大值是4.8万粒卵母细胞,为船蛸属的船蛸(Argonautaargo)[16]。然而,SALMAN和AKALIN[25]报道快蛸的输卵管载卵量最大值可达20余万粒成熟卵子。因为输卵管载卵量表征某一时期的实际排卵量[7,10,13],所以快蛸的有效繁殖力应该大于或等于20万粒卵母细胞。多形艾爱尔斗蛸(Adelieledonepolymorpha)、蒂尔氏近爱尔斗蛸(Pareledoneturqueti)、沙氏近爱尔斗蛸(Pareledonecharcoti)等的有效繁殖力相对较低,均在百粒卵母细胞以内[14],这可能与其自身较低的潜在繁殖力相关(表2)。
在相对繁殖力方面,基于潜在繁殖力计算所得的船蛸相对繁殖力最大,其中体质量相对繁殖力高达975粒·g-1[16];哈勃氏蛸也有较高的体质量相对繁殖力,最高值可达到186粒·g-1[19];爱尔斗蛸的相对繁殖力较低,其体质量相对繁殖力平均值仅为0.95粒·g-1[27]。基于有效繁殖力计算的蛸类的相对繁殖力均较低,一定程度上说明蛸类的单位有效繁殖力比较低。其中,沙氏近爱尔斗蛸、蒂尔氏近爱尔斗蛸、多形艾爱尔斗蛸等每克体质量的繁殖力均小于1粒[14]。
2.1.2 乌贼目
乌贼目种类的繁殖力普遍较低,最大潜在繁殖力均在万粒以内(表3)。目前已经报道的数据显示,乌贼(Sepiaofficinalis)是乌贼目中潜在繁殖力最大的一个种类,其潜在繁殖力最大值为8700粒卵母细胞[12]。潜在繁殖力最大值大于1000粒卵母细胞的种类还有粉红乌贼(Sepia orbignyana)[33]、虎斑乌贼(Sepiapharaonis)[34]、太平洋僧头乌贼(Rossiapacifica)[35]、巨粒僧头乌贼(Rossia macrosoma)[35-36]等。粗壮耳乌贼(Sepiola robusta)[23]、斯氏耳乌贼(Sepiola steenstrupiana)[23]等种类的潜在繁殖力最大值则仅在300粒卵母细胞以内。
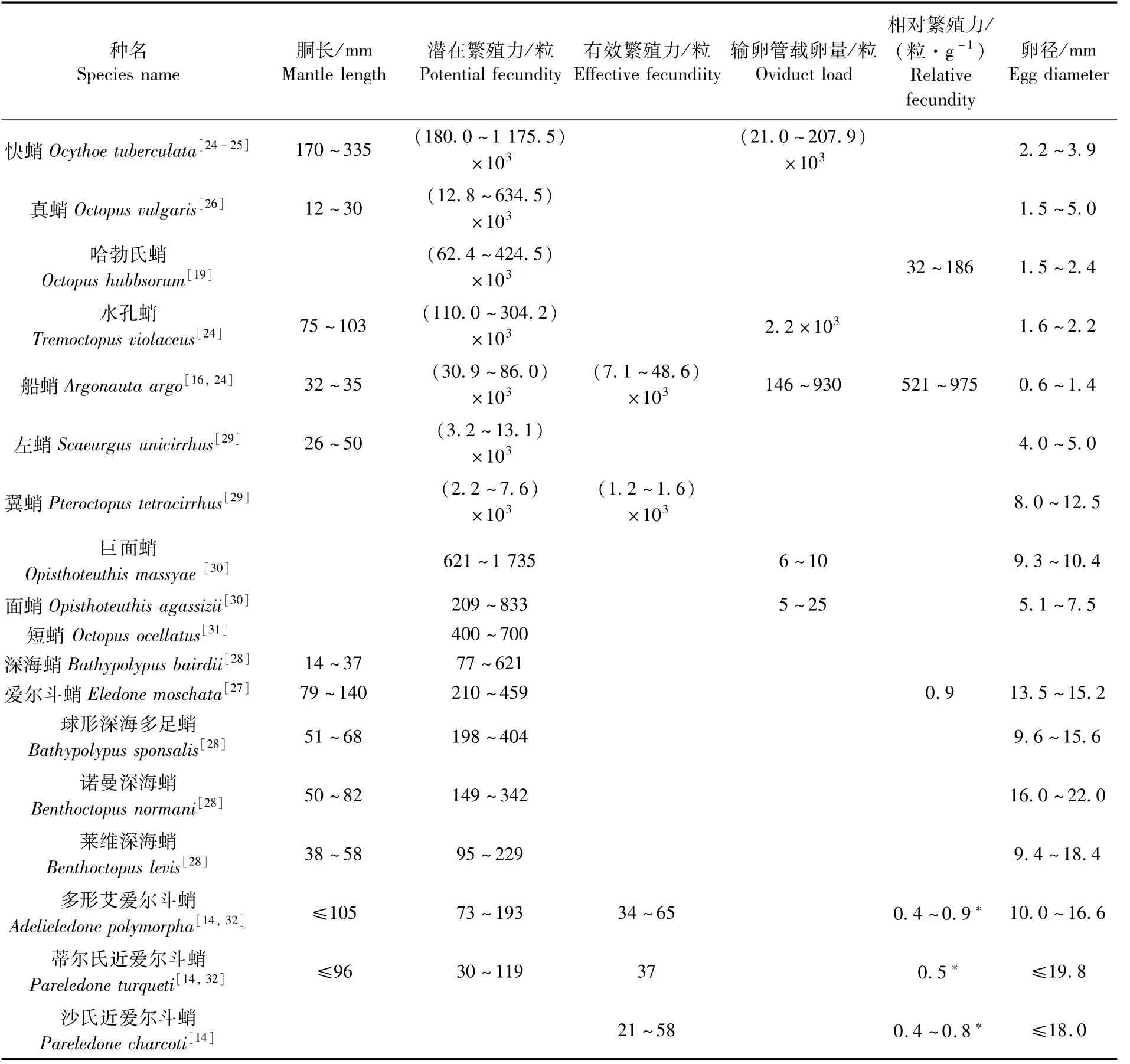
表2 八腕目雌性个体繁殖力特性Tab.2 Fecundity characteristics of female individuals in species of Octopoda
在有效繁殖力方面,乌贼目种类的输卵管载卵量少,已经报道的种类输卵管载卵量均在百粒卵子及以内(表3)。因此,这些种类的有效繁殖力也不高。其中,数据显示乌贼的有效繁殖力最大,高达3 000余粒卵母细胞[12];其他种类如小乌贼(Sepietta oweniana)[21]、大西洋耳乌贼(Sepiola atlantica)[22]等的有效繁殖力则均在300粒卵母细胞以内。
在相对繁殖力方面,大西洋耳乌贼的体质量相对繁殖力最大,其最大值可达 268.8粒·g-1[22];其次为中耳乌贼[23]、斯氏耳乌贼[23]、小乌贼[21]等种类,其体质量相对繁殖力最大值在170~190粒·g-1。乌贼[18]、太平洋僧头乌贼[35]等种类的体质量相对繁殖力相对较低,在10粒·g-1以内。
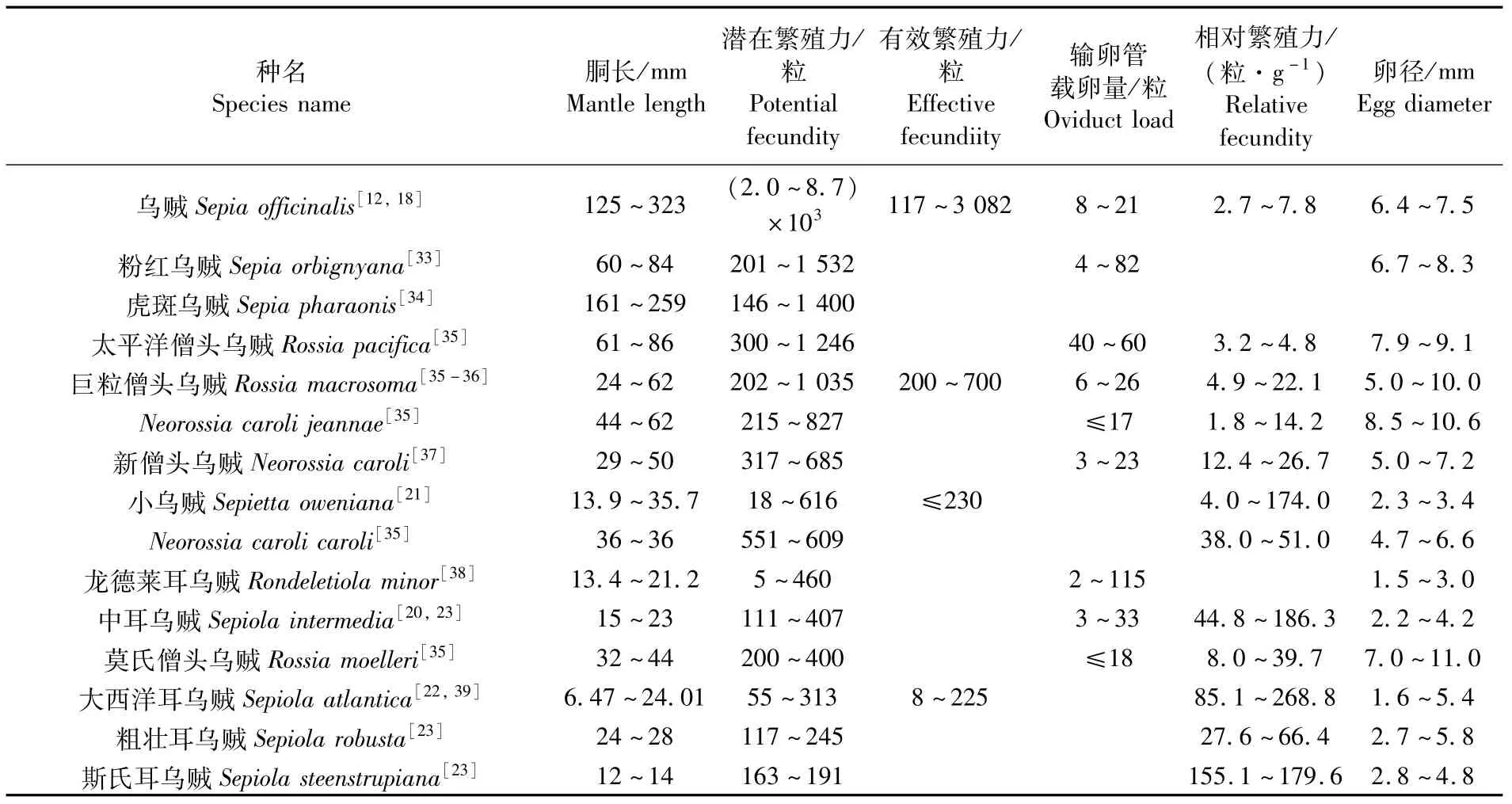
表3 乌贼目雌性个体繁殖力特性Tab.3 Fecundity characteristics of female individuals among species of Sepioidea
2.1.3 枪形目
已经报道的枪形目种类繁殖力数据显示,除了莱氏拟乌贼(Sepioteuthis lessoniana)[40-41]外,其他种类的潜在繁殖力最大值均在4 000粒卵母细胞以上(表4)。其中,茎柔鱼(Dosidicus gigas)潜在繁殖力最大,最大值高达3 247万粒卵母细胞[9];其次为柔鱼(Ommastrephes bartramii),其潜在繁殖力最大值达700万粒卵母细胞[3,42]。此外,潜在繁殖力最大值超过百万粒卵母细胞的种类还有菱鳍乌贼(Thysanoteuthis rhombus)[11]、鸢乌贼(Sthenoteuthis oualaniensis)[43-45]、南极褶柔鱼(Todarodes filippovae)[46]、阿根廷滑柔鱼(Illex argentines)[7,47-49]、安哥拉褶柔鱼(Todarodes angolensis)[46]等。
与潜在繁殖力一致,枪形目种类的体质量相对繁殖力相对较高(表4)。其中,大西洋武装乌贼(Abraliopsis atlantica)体质量相对繁殖力高达10 800粒卵母细胞·克-1[50];其次为大西洋鸟柔鱼[51]和魏氏钩腕乌贼[Abralia(Asteroteuthis)veranyi][52-53]的体质量相对繁殖力也很大,两者体质量相对繁殖力最大值均超过5 000粒·g-1。值得注意的是,有些种类的体质量相对繁殖力相对较低,如鸢乌贼、枪乌贼(Loligo vulgaris)和鱼钩乌贼(Ancistrocheirus lesueurii)等种类的体质量相对繁殖力均在500粒·g-1以内(表4)。这种相对较低的体质量相对繁殖力可能是物种具有多次产卵且产卵期间保持体细胞生长的特性所致[43,54]。
枪形目种类的输卵管载卵量具有属种特殊性,柔鱼的输卵管载卵量最大,其最大载卵量高达200 万粒卵母细胞[3,42];小钩腕乌贼(Abraliopsis pfefferi)的输卵管载卵量最小,其最大载卵量仅为130粒卵母细胞[50]。通常,枪形目种类产卵之前暂存成熟卵子于输卵管[2];因而,输卵管载卵量可表征这些种类的实际繁殖力大小。同时,枪形目种类的产卵策略多表现为间歇性的、多次的产卵活动[54],其有效繁殖力将是实际繁殖力的数倍以上。比如,茎柔鱼有效繁殖力高达1400万粒卵母细胞,是其输卵管载卵量最大值的10倍以上[9],这也是目前报道的枪形目种类中有效繁殖力最大者(表4)。
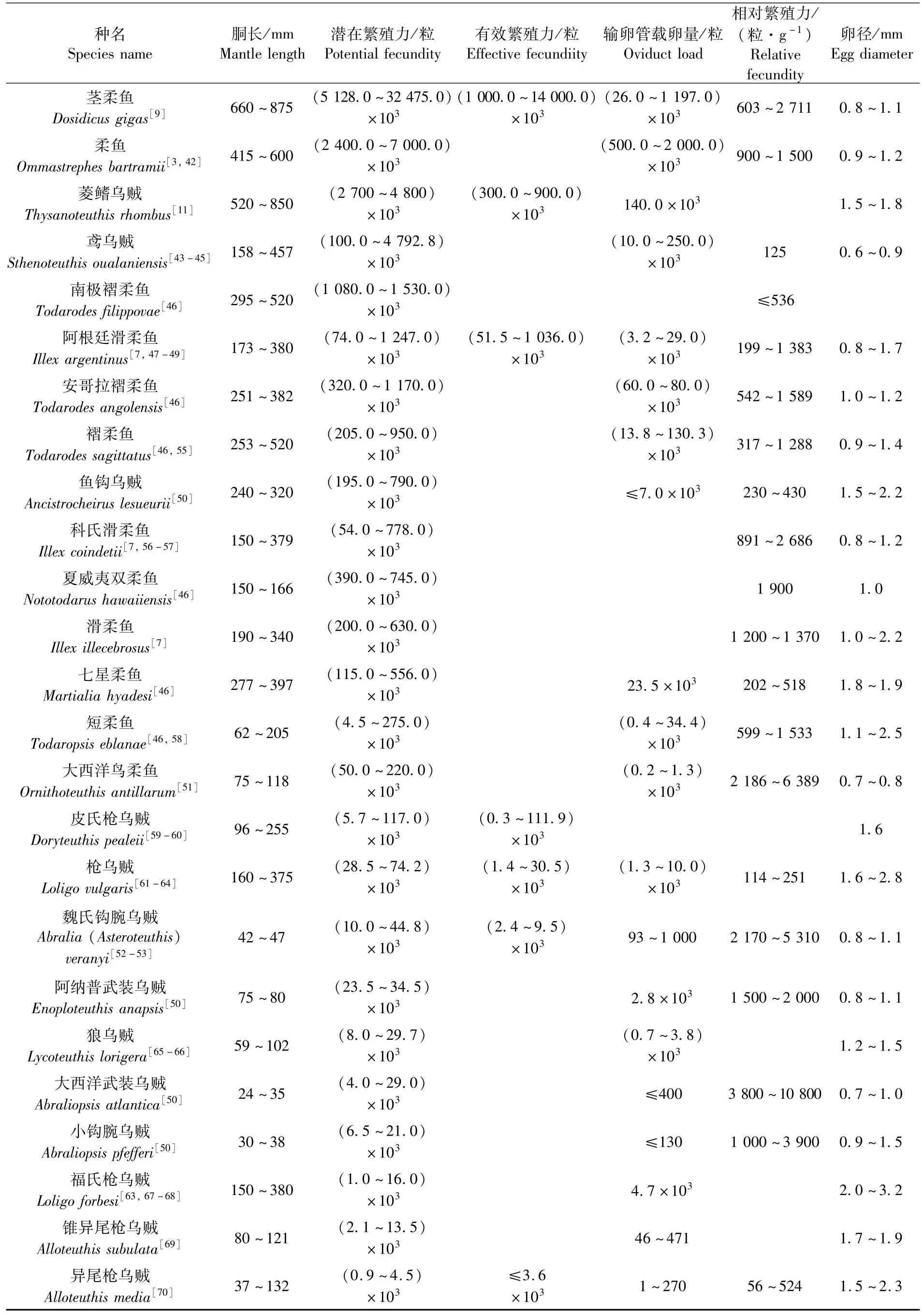
表4 枪形目雌性个体繁殖力特性Tab.4 Fecundity characteristics of female individuals among species of Teuthoidea
2.2 雄性繁殖力
相比较于雌性,鞘亚纲种类雄性个体的繁殖力研究报道相对较少(表5)。八腕目种类中,真蛸的潜在繁殖力最高,其最大值达633条精荚[26];其次,爱尔斗蛸[27]、巨面蛸(Opisthoteuthis vossi)[30]、哈勃氏蛸[19]等种类的潜在繁殖力也相对较 高,在 150 ~300 条精荚之间。左蛸(Scaeurgus unicirrhus)、 翼 蛸 (Pteroctopus tetracirrhus)等种类的潜在繁殖力则很小,其最大值分别为11条精荚和6条精荚[29],然而,两者的精荚较长,最大长度分别为44.0 mm 和51.0 mm[29]。
乌贼目中,小乌贼[21]、大西洋耳乌贼[22]和粉红乌贼[33]等种类的潜在繁殖力较高,其最大值在1 000~1 300条精荚之间(表5)。虎斑乌贼和多氏乌贼(Sepia dollfusi)的繁殖力也相对较高,其潜在繁殖力最大值分别为530条和430条精荚[71]。其他属种,如巨粒僧头乌贼和新僧头乌贼(Neorossia caroli)等种类的繁殖力相对较低,其潜在繁殖力最大值分别为150条和71条精荚[37]。然而,与其他种类相比较,巨粒僧头乌贼和新僧头乌贼的精荚较长[37],其最大值分别为18.8 mm和18.4 mm(表5)。
枪形目中,目前已报道的数据显示,柔鱼[3]、阿根廷滑柔鱼[72-73]、科氏滑柔鱼(Illex coindetii)[56-57]、茎柔鱼[74-75]等种类的潜在繁殖力相对较高,其最大值在1 500~1 700条精荚之间,精荚长度在12~53 mm之间(表5)。福氏枪乌贼(Loligo forbesi)[63,67]、枪乌贼[62-63]等种类也具有较高的潜在繁殖力,其最大值在1 000条精荚左右。菱鳍乌贼的潜在繁殖力最小,为15~20条精荚;然而,精荚长度则很长,可达100 mm[11]。

表5 头足类鞘亚纲雄性繁殖力特性Tab.5 Fecundity characteristics ofmale individuals among species of Coleoidea(Cephalopoda)
3 头足类繁殖力变化规律
现生头足类属种,除鹦鹉螺属外,均为生命后期繁殖产卵,产卵后便死去。因此,它们的繁殖力往往与其个体大小、配子大小及其栖息环境等密切相关。
3.1 与个体大小的关系
一般地,头足类雌雄性个体繁殖力与其个体大小密切相关,表现出一定的线性关系。其中,既有的研究发现,八腕目的船蛸[16]、真蛸[26]、爱尔斗蛸[27]和特维尔切蛸(Octopus tehuelchus)[79],乌贼目的乌贼[12]、大西亚耳乌贼[22]、巨粒僧头乌贼[37]和新僧头乌贼[36],枪形目的枪乌贼[63-64]、福氏枪乌贼[63,68]、异尾枪乌贼[70]、莱氏拟乌贼[40-41]、茎柔鱼[9,80]、鸢乌贼[81]、阿根廷滑柔鱼[49]等种类的潜在繁殖力均与其个体胴长成正相关关系。个别种类潜在繁殖力则与其体质量呈正相关关系,如八腕目的真蛸[26]、哈勃氏蛸[19]、负蛸[19]、巨面蛸[30],乌贼目的乌贼[12]、小乌贼[21],枪形目的枪乌贼[61]、莱氏拟乌贼[41]等。这些结果说明了头足类的体型越大,其繁殖力也会越大。
同时,头足类的生殖系统位于空间有限的胴体腔后端,性腺开始发育后该系统增大迅速。因此,生殖系统的大小也是影响其繁殖力高低的因素之一。如,莱氏拟乌贼[41]、短蛸[82]等种类的雌性个体潜在繁殖力与其卵巢重呈正相关关系,爱尔斗蛸[27]的相对繁殖力与卵巢重呈负相关关系。但是研究也发现部分种类的繁殖力大小与卵巢重没有显著相关性,如毛利蛸[83]、快蛸[25]等。这可能是这些种类卵巢卵母细胞同步发育的拮抗效应(antagonistic effects),引起部分卵母细胞因相互挤压或营养供给不足等部分退化[83]。
3.2 与配子大小的关系
通常地,头足类繁殖力与其配子大小存在一定的相关性,并且这种相关性与栖息环境关系密切[28]。其中,八腕目种类雌性个体的潜在繁殖力与卵子大小呈显著的负相关关系(Pearson’sr=-0.88,F=45.07,P<0.001)(图2-A),其成熟卵子直径跨度范围从1 mm至40 mm,随之的潜在繁殖力少则数百粒,多则可以超过100万粒[28]。一般地,卵子较小、繁殖力较大的种类多栖息在沿岸、近海等较浅水域,如快蛸[24-25]、真蛸[26]、哈勃氏蛸[19]、船蛸[16,24]等;而栖息在南极、深海的种类繁殖力较低、卵子直径也相对较大,如球形深海多足蛸、莱维深海蛸、沙氏近爱尔斗蛸等[14,28]。
枪形目种类雌性个体繁殖力与其成熟卵子直径也呈显著的负相关关系(Pearson’sr=-0.33,F=4.22,P=0.044)(图2-B)。大洋性生活习性的茎柔鱼[9]、柔鱼[3,42]、鸢乌贼[43-45]等种类繁殖力很高,但成熟卵子直径多在1 mm左右;而栖息在近海、大陆架和大陆坡折等水域的异尾枪乌贼[70]、福氏枪乌贼[63,67-68]等种类的繁殖力相对较低,成熟卵子直径则较大,在2 mm及以上。然而,与八腕目、枪形目不同,乌贼目种类的雌性个体繁殖力与成熟卵子直径呈弱正相关关系(Pearson’sr=0.37,F=3.59,P=0.087)(图2-C)。其中,栖息在大陆架、大陆坡底层水域的僧帽乌贼属下的种类个体繁殖力相对较高,并且卵子直径也较大,一般在9 mm以上[35-36];而在近海底层栖息的耳乌贼属的种类个体繁殖力较低、卵子直径平均在3 mm左右[20,23,38]。
此外,头足类雄性个体的繁殖力与精荚长度也存在一定的相关性。如,真蛸[26]、爱尔斗蛸[27]、大西洋耳乌贼[22]、小乌贼[21]、巨粒僧头乌贼[37]等种类的精荚长度与胴长呈显著正相关。这可能与精荚的形成及其结构以及存储精荚的精荚囊大小等密切相关。头足类中较大的雄性个体具有较大的精荚腺和精荚囊,这样可以封装并存储较长的精荚[14]。
3.3 与栖息环境的关系
头足类对环境变化波动的敏感性很高,因此分布海域的水温、初级生产力等是影响这些种类繁殖力大小的主要环境参数[28]。通常地,在热带、温带海域,头足类鞘亚纲种类的雌性个体具有较高的潜在繁殖力,而在高纬度海域其潜在繁殖力则偏低(图3)。这可能与这些种类的繁殖策略相关,并且水温和饵料丰度是关键影响因素。其中,低纬度海域的水温较高,饵料生物丰富,水文环境变化波动大且相对复杂,其繁殖策略倾向于r策略[35,84]。纬度较高的海域水温偏低,水文环境变化波动相对较小,其繁殖策略则多倾向于K策略[7]。

图2 头足类鞘亚纲种类雌性个体潜在繁殖力与卵子大小的关系Fig.2 Relationship between fecundity and egg size for female Teuthoidea
头足类鞘亚纲潜在繁殖力的纬向变化很可能是对栖息环境的进化性适应,以保持种群的持续繁衍[28,85]。一般地,高纬度、冷水域属种的潜在繁殖力偏低,但是卵黄积累多、卵径也较大、卵子孵化时间长[86]。如,KUEHL[14]和BARRATT等[32]研究发现南极海域的沙氏近爱尔斗蛸、多形艾爱尔斗蛸和蒂尔氏近爱尔斗蛸等的最大潜在繁殖力均小于70粒;然而,这些种类的成熟卵子卵径可达19 mm[14,32],卵子孵化时间则可能在30~41个月[1],以提高受精卵的孵化成功率及孵化仔鱼的存活率[87]。低纬度水温较高的海域,既有研究发现茎柔鱼具有最大的潜在繁殖力,高达3 247万粒卵母细胞,成熟卵径平均值在1.0 mm,卵子孵化的时间则在2~4周,所孵化的仔鱼小、数量多,以增加后代的有效存活数量[3,9]。
分布海域广的种类,其潜在繁殖力也因栖息海域不同而存在较大的差异。如,短柔鱼(Todaropsis eblanae)在北海冷水域的群体,其最大潜在繁殖力为2.8万粒卵母细胞[58],而在西非外海热带水域的群体其最大潜在繁殖力可达27.5万粒卵母细胞[46]。同时,头足类的繁殖力特性也与栖息水层密切相关。栖息在大洋海域光合作用层以上的种类,其繁殖力较大、卵子直径≤2.0mm,如武装乌贼科、大洋性柔鱼科和船蛸属等种类[7,11,46]。底栖性的种类也表现出相同的繁殖力特性,如近海栖息的有须蛸类繁殖力在10万粒卵母细胞及以上、平均卵径为2~3 mm,而深海或南大洋栖息的无须蛸类繁殖力为数百粒卵母细胞或百粒卵母细胞以下、平均卵径则在10 mm及以上[13,25,28,87]。
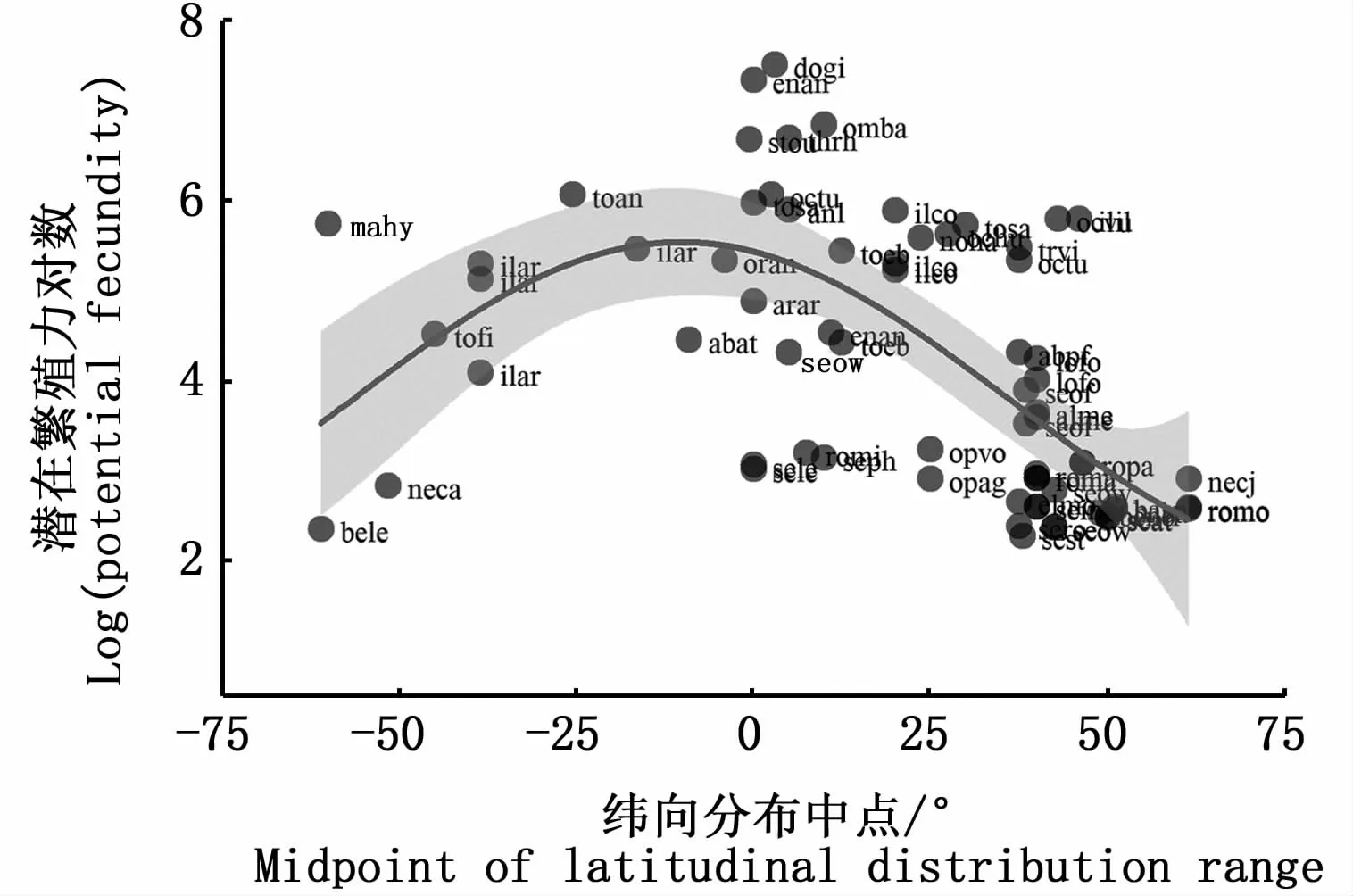
图3 头足类鞘亚纲雌性个体潜在繁殖力与其纬向分布中点的关系Fig.3 Relationship between potential fecundity and m idpoint of latitudinal distribution range for female Teuthoidea
头足类鞘亚纲雄性个体的潜在繁殖力也与其栖息环境存在一定的相关性。如,LAPTIKHOVSKY等[29]研究发现,左蛸和翼蛸的潜在繁殖力因栖息水域的水文条件变化而差异明显,并且在水文条件良好时其精荚也比较长;HERNÁNDEZGARCÍA[57]发现栖息在高纬度海域的科氏滑柔鱼雄性个体产生的精荚长度较短,但是生产的精荚数量较多。同时,这些种类雌性个体繁殖力也因繁殖季节不同而差异显著。比如,小乌贼在夏季的潜在繁殖力显著低于秋季时所产生的精荚数量[21];哈勃氏蛸雄性个体的潜在繁殖力在春季、秋季时增加显著[19]等。
4 小结与展望
繁殖力是生物个体生殖能力的重要表征,对海洋生物资源群体的理论研究和生产实践具有重要的指导意义[5]。目前,头足类繁殖力研究已经形成了多种繁殖力的定义及其测定方法,每种繁殖力均有其重要的生物学意义,代表了这些种类配子发生及后代繁衍的生活史策略。一般地,潜在繁殖力兼顾了配子发生的同步发育和异步发育情况,可以在一定意义上表征个体繁衍后代数量的理论值。有效繁殖力则反映了个体繁殖力的有效成分,代表了个体所能繁衍后代数量的实际值。但是,除了鹦鹉螺种类外,头足类大多表现为生殖系统一次性发育、终生一次繁殖[1]。为了实现生殖力的最优化和最大化,这些种类已经在产卵策略上进化出了瞬时终端产卵(simultaneous terminal spawning)、间歇性终端产卵(intermittent terminal spawning)、多次产卵(multiple spawning)、连续产卵(continuous spawning)以及多轮产卵(polycyclic spawning)等[54]。这些产卵策略决定着生殖系统配子的发生及其成熟排放模式,并最终决定了个体的繁殖力大小。在繁殖力分析上,需要考虑多种繁殖力分析方法的应用,以深入认知这些种类的繁殖力特性。
头足类行雌雄异体的有性生殖,雌雄性各自产生配子以形成授精卵来繁衍后代[3]。相比较于雌性个体,有关头足类雄性个体的繁殖力及成熟配子排放模式等方面的研究仍相当有限。多数的鞘亚纲种类雄性个体生殖系统先行发育成熟,且往往先行传送精荚于未繁殖产卵的雌性个体[1,8]。从资源补充量来看,雄性个体精荚数量多少及其排放方式都可能对群体的繁衍后代总数量及其质量产生重要影响,加强雄性繁殖力特性的研究对于全面掌握头足类基础生物学特征将大有裨益。
头足类繁殖力水平与体型呈显著的线性关系,并且与配子大小亦存在密切相关性。从能量分配角度看,体型越大的个体其生殖投入越高[88],而与配子大小的关系则反映了头足类在繁殖力水平与单个配子能量投入之间的权衡[89-91]:高繁殖力、小配子、单配子能量投入低,反之则繁殖力水平低、配子大、单配子能量投入高。然而,在终生一次繁殖的生活史策略下,部分头足类倾向于增加单配子能量投入,而非产生更多配子以实现繁殖力水平最大化[26]。此外,头足类对栖息环境的波动变化甚为敏感,在繁殖力特性上表现为繁殖力的纬向递减、配子的纬向趋大的趋势,以提升孵化仔鱼的存活率,维持种群补充量。因而,有关头足类繁殖力水平、配子大小、单配子能量投入等与海洋环境关系的生态学研究将显得尤为重要,潜在繁殖力投入指数[7,9]的研究将可能是该领域研究的一个重要方向。
伴随着近海渔业资源的衰退及大洋性渔业资源管理的日趋规范,头足类作为世界海洋渔业的重要生物资源,其可持续开发利用必将是资源评估与管理的重要内容,也必将成为相关的渔业管理组织评估管理的重要对象。繁殖力作为后代繁衍的重要表征指标,可以反映种群数量变动及其资源量补充过程[92-93]。目前,MACEWICZ等[94]已经通过监测渔业逃脱的卵子数量(即亲体被捕获前所排出的卵子)建立乳光枪乌贼(Doryteuthis opalescens)资源评估与管理模型,有效且快速地评估乳光枪乌贼繁殖力,为乳光枪乌贼资源的持续开发提供了监测管理途径。开展基于繁殖力特性的头足类资源评估将推动头足类资源生物学的研究,也必将为头足类渔业资源的可持续开发利用及相关的政策制订提供科学支持与借鉴。
