拟穴青蟹CYP302a1基因的克隆及表达模式分析
2021-03-18张林姿张凤英刘志强马春艳马凌波
张林姿,赵 明,张凤英,王 伟,刘志强,马春艳,谌 微,王 珂,马凌波
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,农业农村部远洋与极地渔业创新重点实验室,上海 200090)
节肢动物中,周期性蜕皮对节肢动物的生长、繁殖和形态发生起着重要作用。周期性蜕皮受到多种环境和自身因素的影响,其中最主要的是由类固醇激素浓度控制,而蜕皮激素(ecdysone,Ecd)是最重要的类固醇激素[1-3]。蜕皮激素首先由BUTENANDT和KARLSON[4]1954年从蛾蛹中分离得到,随后Ecd的化学结构也被阐明[5]。昆虫中蜕皮激素的主要活性形式是20-羟基蜕皮酮(20-hydroxyecdysone,20E),其诱导和调节蜕皮周期中一系列生命进程的变化[1]。1965年HUBER和HOPPE[5]发现前胸腺为Ecd的主要分泌合成器官,现已证明,节肢动物周期性蜕皮主要是由类固醇蜕皮激素的周期性波动调节的[6-7]。此外,Ecd的浓度变化也与再生、变态、卵子发生等[8-13]密切相关。因此,对Ecd的代谢调控研究具有重要意义。
甲壳动物的Ecd主要由Y器官(Y-organ,YO)合成分泌[14],其合成与昆虫类似。Ecd的合成可以分为两个阶段:首先,食物中的胆固醇在肠道吸收后,通过血淋巴运输到YO,胆固醇在Neverland基因、“黑盒子”(包括CYP307a1/CYP307a2)基因编码酶的作用下催化成为5βdiketol(3D2,22,25dE),此过程在所有十足目物种中保持一致[15];然后,5β-diketol在多种细胞色素 P450 (包 括 CYP306Al、CYP302Al 和CYP315Al)的催化下转化为Ecd。随后,Ecd释放到外周组织,由20-羟化酶(CYP314A1)催化而成其主要的活性形式 20-羟基蜕皮酮(20-hydroxyecdysone,20E)[16-17]。
CYP302A1催化C22的羟基化,是Ecd合成通路中的重要催化酶。在果蝇(Drosophila melanogaster)中通过敲除CYP302a1(dib)基因获得的dib突变胚胎,发现其Ecd和20E滴度非常低,且通过表型分析发现dib突变胚胎在一些后期形态发生过程存在严重缺陷,如头部退化及肠发育异常等,证明CYP302a1基因在蜕皮激素合成中起重要作用[18];而在家蚕(Bombyx mori)中发现CYP302a1基因的表达变化与血淋巴内蜕皮类固醇滴度的变化密切相关[19]。甲壳动物中目前仅有三疣梭子蟹(Portunus trituberculatus)克隆获得CYP302a1基因,研究发现,CYP302a1基因在YO的表达量显著高于其他组织,且在蜕皮周期中YO的表达变化与Ecd的滴度变化相同,而CYP302a1的表达高峰期早于蜕皮激素高峰期,说明CYP302a1基因在三疣梭子蟹的蜕皮激素合成中起着重要作用[20]。
拟穴青蟹(Scylla paramamosain)隶属于梭子蟹科(Portunidae),青蟹属,广泛分布于我国东南沿海地区,营养价值丰富、经济价值较高,是我国重要的海水经济蟹类之一[21-22]。蜕皮调控是甲壳动物研究中的热点问题之一,目前甲壳动物蜕皮激素合成通路的相关报告较少,因此,对拟穴青蟹蜕皮调控通路的解析具有重要意义。本研究通过序列分析,结合组织分布、幼体时空表达、蜕皮周期变化规律对拟穴青蟹的CYP302a1基因进行了克隆鉴定,以期为相关研究提供基础数据支撑。
1 材料与方法
1.1 实验材料
拟穴青蟹溞状幼体Ⅰ期至仔蟹Ⅰ期不同发育时期样本取自东海水产研究所海南琼海养殖基地,不同时期幼体样本的鉴定参考曾朝曙等[23]关于幼体的形态学描述,幼体取样选取两次蜕皮中间的时间点进行收集。用于组织表达分析的样本分别取自琼海基地养殖的卵巢发育Ⅲ期的雌性和精巢发育处于精母细胞期的雄性青蟹,性腺发育分期参考上官步敏等[24]和YE等[25]的研究。不同蜕皮时期的雄蟹取自江苏省南通维尔思水产科技有限公司,暂养于实验室循环水养殖系统,选取体质量(BW)为25~55g的雄性拟穴青蟹,参考徐宾朋[26]的研究,将拟穴青蟹蜕皮周期分为蜕皮后期(A、B期)、蜕皮间期(C期)、蜕皮前期(D)和蜕皮期(E)4个阶段。取每个蜕皮时期的YO组织,每个时期5只蟹,加RNA保存液(生工生物工程(上海)股份有限公司)保存至-80℃,用于RNA提取。
1.2 实验方法
1.2.1 拟穴青蟹CYP302a1的cDNA克隆
从转录组测序结果中获得了拟穴青蟹CYP302a1的cDNA序列,通过分析发现其具有完整的开放阅读框(ORF),在ORF两端设计引物(CYP302a1-F: GGCAGGTGTCTGAAGGAACA,CYP302a1-R:ACATATTCACCTCAGCTAGTGC),以YO的cDNA为模板对其进行了验证。除试剂盒提供的引物外,本研究中使用的其他引物均委托上海杰李生物技术有限公司合成。
1.2.2 序列分析
使用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找序列的开放阅读框并翻译,在 GenBank 上下载多个物种的CYP302a1基因的氨基酸序列,使用DNAMAN软件进行比对,分析其与其他物种的相似性;利用ExPASy ProtParam (https://web.expasy.org/protparam)预测蛋白质的分子量和等电点;使用Signal 5.0 Server(http://www.cbs.dtu.dk/services/SignalP)预测蛋白质是否存在信号肽;利用在线TMHMM 工具(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白质是否存在跨膜区域。
1.2.3 系统进化树的构建
在GenBank数据库中下载节肢动物中多个物种的CYP302a1基因的氨基酸序列及P450家族的其他参与20E合成及代谢的基因编码的氨基酸序列,包括CYP306A1、CYP307A1、CYP315A1、CYP314A1、CYP18A1。 使用MEGA7[27]对所选序列进行比对,邻接法构建发育树,Bootstrap设置为1 000,使用在线工具Interactive Tree Of Life(https://itol.embl.de)对进化树进行注释修饰[28]。
1.2.4Sp-CYP302a1基因的组织表达和时空分布分析
提取成体雌蟹的表皮、中肠、胸神经节、血淋巴、肌肉、YO、心脏组织;成体雄蟹的表皮、血淋巴、中肠、肝胰腺、心脏、精巢、YO组织;雄性蟹不同蜕皮时期的YO和心脏,从溞状幼体I期到仔蟹Ⅱ期不同幼体发育时期样本的总RNA,使用总RNA提取试剂盒(北京艾德莱生物技术有限公司)提取RNA,提取后使用分光光度计进行定量,1%的琼脂糖凝胶电泳检测RNA的完整性。对符合要求的RNA使用DNAase I处理后进行反转录(上海TOYOBO)。荧光定量使用试剂为SYBR green PCR master mix(大连TAKARA)。反应体系和程序均参考ZHAO等[29]的方法进行。
由于18S rRNA在拟穴青蟹的多种不同样本中能稳定表达,适合作为拟穴青蟹基因表达分析的内参基因,本研究使用18S rRNA作为内参基因[30],Sp-CYP302a1的 特 异 性 引 物 为Sp-CYP302a1-Q-F(TCTCACAGAGAGTGCCGAGA)和Sp-CYP302a1-Q-R(ATGCAGGCAACCAATCAACG),采用标准曲线法进行分析计算检测Sp-CYP302a1基因在各个样本中的相对表达量。
1.2.5 统计分析
表达量所有数据均以平均值±标准差(mean±SD)表示,使用SPSS 17.0软件对数据one-way ANOVA分析,用Duncan氏法进行比较,取P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 拟穴青蟹Sp-CYP302a1序列及进化树分析
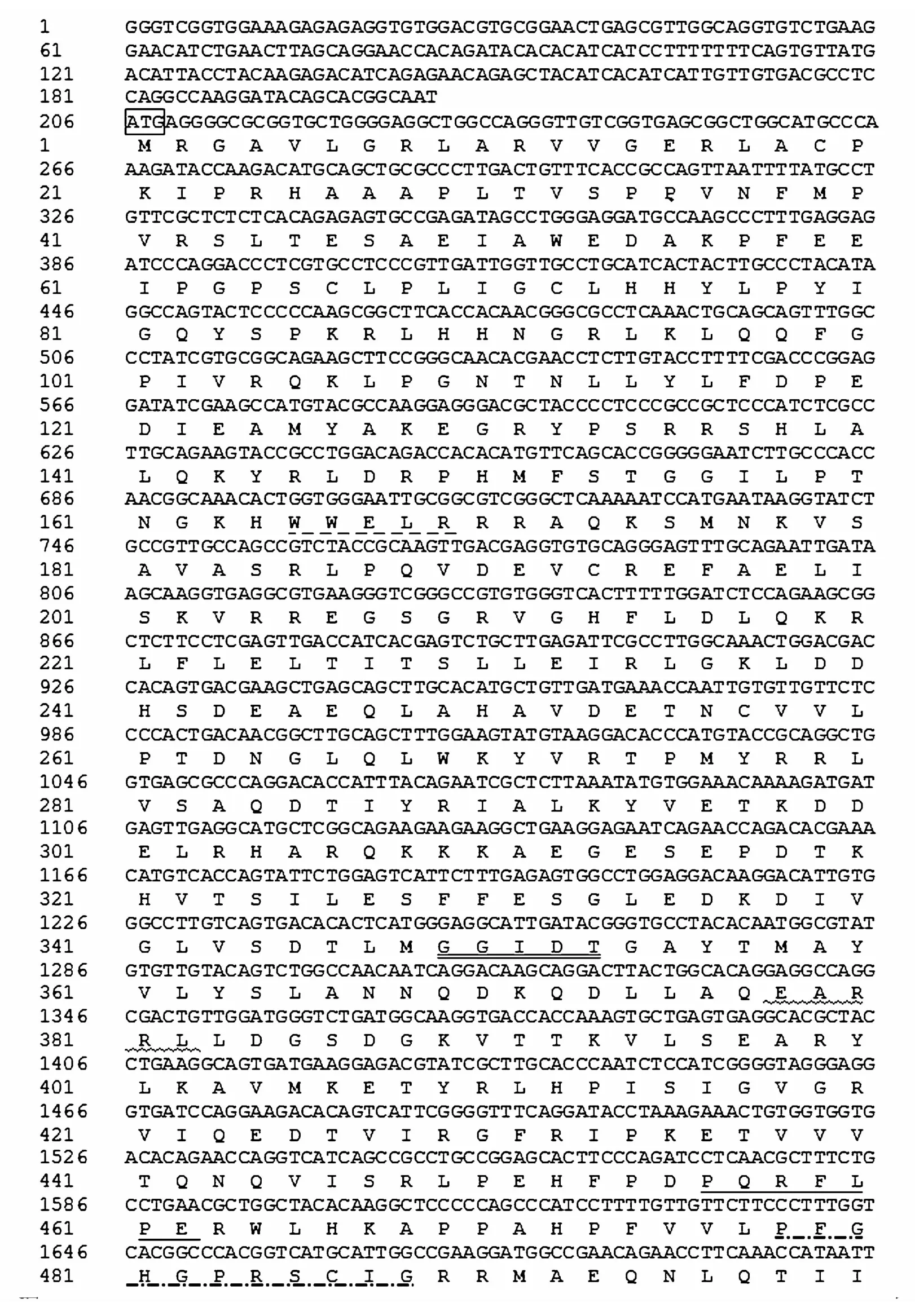
本研究克隆获得了拟穴青蟹CYP302a1基因,命名为Sp-CYP302a1(GenBank 接 收 号:MN782363)。Sp-CYP302a1的cDNA 序列长为3 032 bp,开放阅读框(OFR)为1 617 bp,可编码538个氨基酸。此外,有205 bp的5′UTR和1 210 bp的3′UTR。ExPASy ProtParam预测结果显示蛋白分子式为C2729H4344N780O782S17,平均分子质量为61.14 kDa,等电点(pI)为8.76,带负电荷的氨基酸(天冬氨酸+谷氨酸)67个,带正电荷氨基酸(精氨酸 +赖氨酸)73 个。其中,预测的CYP302a1蛋白的大小与其他脊椎动物和无脊椎动物细胞色素P450(56~62 kDa)的大小一致[31]。Signal 5.0 Server和TMHMM分析发现其氨基酸序列无信号肽序列和跨膜结构域。序列分析显示该氨基酸序列含有helix-K、helix-C、helix-I、PERF及heme-binding共5个P450特征保守区域[32](图1)。
多序列比对分析发现,Sp-CYP302a1的氨基酸序列与三疣梭子蟹的一致度最高(91%),其次为凡纳滨对虾(Penaeus vannamei)、木黄蜂(Orussus abietinus)和欧洲熊蜂 (Bombus terrestris),一致度分别为56% 、46% 和46%,。有4个保守区域的非保守序列与三疣梭子蟹及凡纳滨对虾完全一致,包括helix-C、helix-K、helix-I和heme-binding;多处非保守区域的氨基酸序列与三疣梭子蟹和凡纳滨对虾一致性极高甚至完全一致,包括氨基酸108~111、204~214、288~343 和384 ~401 等(图2)。而Sp-CYP302a1的氨基酸序列与其他所比对物种一致度极低。
系统进化树显示不同的CYP基因分别聚为一类,分别为CYP306a1、CYP307a1、CYP315a1、CYP314a1、CYP302a1和CYP18a16个大类。Sp-CYP302a1与其他物种的CYP302a1聚为一类,且Sp-CYP302a1与三疣梭子蟹的进化关系最近,其次为凡纳滨对虾(图3)。
2.2 Sp-CYP302a1基因的表达模式分析
qRT-PCR检测结果显示,Sp-CYP302a1基因在拟穴青蟹成体蟹不同组织中的表达差异较显著。Sp-CYP302a1在雌性和雄性蟹中的组织分布较为相似,在所检测的组织中均有表达,但在YO中的表达量明显高于其他组织,其他组织中表达量均较低,统计学检验为差异显著(P<0.05);此外,Sp-CYP302a1在雌性拟穴青蟹中表达量明显比雄性个体中高(图4)。
在幼体发育过程中,CYP302a1基因在溞状幼体Ⅲ期(Z3)最高,而在其他时期均相对较低(图5)。

作者选用雄性拟穴青蟹的YO来检测Sp-CYP302a1在蜕皮周期中表达的变化,以期初步揭示其在拟穴青蟹蜕皮调控中的作用。在一个蜕皮周期内,Sp-CYP302a1表达量呈显著变化,在蜕皮后期(A、B期)表达量最低,随后开始上升,至蜕皮前期(D期)达到最大值,随后开始下降,但在蜕皮期(E期)的表达量仍高于A期和B期(图6)。
3 讨论
细胞色素P450基因CYP302a1已从多个节肢动物中克隆并证明其在蜕皮调控中具有重要作用[19-20,33]。本研究从拟穴青蟹中获得的基因CYP302a1具有细胞色素P450基因的5个保守结构域(图2),证明Sp-CYP302a1属于P450家族基因,此外Sp-CYP302a1序列推导的氨基酸序列与三疣梭子蟹和凡纳滨对虾的CY302A1聚为一小支(图3),而后与其他物种的CY302A1聚为一支,而 P450 其他成员基因编码的氨基酸CYP306A1、CYP307A1、CYP315A1、CYP314A1、CYP18A1分别聚为一支,结构域和进化聚类结果初步证明所获得的为拟穴青蟹CYP302a1基因。
雌性和雄性拟穴青蟹Sp-CYP302a1基因均在YO中具有明显高于其他组织的表达(图4),与YO是甲壳动物蜕皮激素合成的主要器官的论断相吻合[14],这也与三疣梭子蟹的结果一致[20]。此外,Sp-CYP302a1在雌性拟穴青蟹中表达量明显比雄性个体中高,在果蝇中也发现了这种现象,这显示蜕皮激素的浓度可能在不同性别中具有差异,蜕皮激素在不同性别的功能值得进一步深入探索。此外,Sp-CYP302a1在幼体发育过程中的Z3时期出现表达量峰值,而在其他时期Sp-CYP302a1的表达量相对较低,在实际生产过程中,Z1和Z2期主要以轮虫为饵料,自Z3期开始会增加卤虫幼体作为其生物饵料,这些现象是否具有一定联系值得进一步探讨。
蜕皮激素与甲壳动物的蜕皮活动紧密联系,是蜕皮活动的重要调控因子,对凡纳滨对虾[34]、罗氏沼虾(Macrobrachium rosenbergii)[35]、三疣梭子蟹[36]等的相关研究表明其在蜕皮周期中呈规律性变化,且分别在蜕皮前期的不同亚期达到高峰。Sp-CYP302a1在蜕皮周期YO中的表达呈现显著变化,在蜕皮前期出现峰值,这与其他甲壳动物中蜕皮周期内蜕皮激素的浓度变化趋势及三疣梭子蟹的CYP302a1表达模式一致[20],表明CYP302a1在拟穴青蟹蜕皮激素的合成中也具有重要作用。

图2 拟穴青蟹CYP302a1氨基酸序列与其他物种CYP302a1序列比对Fig.2 Alignment of the deduced am ino acid sequence of S.paramamosa in CYP302a1w ith other species

图3 节肢动物部分P450家族基因系统进化树Fig.3 Phylogenetic tree of part arthropod P450 fam ily

图4 Sp-CYP302a1基因在不同组织中的表达Fig.4 Tissue distribution analysis of Sp-CYP302a1

图5 Sp-CYP302a1基因在不同发育阶段中的表达Fig.5 Exp ression pattern of Sp-CYP302a1during different larval development stages

图6 Sp-CYP302a1在雄蟹蜕皮周期YO中的相对表达Fig.6 Relative expression of Sp-CYP302a1 in YOduring molting cycle in male S.paramamosain
综上,本研究首次从拟穴青蟹中克隆获得Sp-CYP302a1基因的cDNA序列,通过生物信息学及表达模式综合分析初步证明Sp-CYP302a1参与了Ecd的合成,研究结果可为拟穴青蟹蜕皮相关研究提供基础数据。
