新疆艾比湖野鸟H1N2亚型禽流感病毒的分离鉴定及全基因组序列分析
2021-03-10李培东刘庆庆肖陈城陈创夫依再提古丽热依木江王一帆李亚玲
李培东,刘庆庆,肖陈城*,陈创夫*,王 丹,依再提古丽·热依木江,王一帆,朱 雅,王 勇,李亚玲
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.第八师玛纳斯河湿地自然保护区管理站,新疆石河子 832000)
禽流感(avian influenza,AI)又称欧洲鸡瘟,属于正黏病毒科A型流感病毒属,于1878年(意大利)初次报道[1]。禽流感病毒(AIV)根据其表面蛋白的抗原性已鉴定出16种HA亚型和9种NA亚型,除蝙蝠起源的流感样病毒H17N10亚型和H18N11亚型外,所有的AIV亚型最初都是在禽类宿主中分离出来的[2]。世界上第1次分离得到AIV是在1901年,而在1955年才确定AIV与人类以及哺乳动物流感病毒之间存在着关联,在1970年左右发现水禽是AIV的基因库[3]。自AI被报道以来,世界上许多国家和地区都陆续发生了AI的疫情,给当地的养禽业带来了巨大的经济损失,甚至对人类健康也造成了一定的威胁。
本研究对2017年采集自新疆艾比湖自然保护区野鸟的粪便棉拭子进行了AIV的分离与鉴定,从其中一个棉拭子样品中分离到了1株野鸟源的H1N2亚型AIV,并对其进行了全基因组的序列分析,旨在调查野鸟中存在的AIV,为AI的防制提供依据。
1 材料与方法
1.1 主要试剂总RNA急速抽提试剂盒购自上海飞捷生物技术有限公司;普通琼脂糖DNA回收试剂盒、2×Taq PCR MasterMix购自天根生化科技(北京)有限公司;pMDTM19-T Vector Cloning Kit、反转录酶(SMART MMLV Reverse Transcriptase)、dNTP、Permix TaqTM、DNA Marker购自TaKaRa。
1.2 病毒的分离取2017年采集自新疆艾比湖自然保护区野鸟的粪便棉拭子100 μL,以注射器注射至9日龄鸡胚的绒毛尿囊腔;接种后每日观察鸡胚死亡情况,48 h后收取尿囊液,将收取的尿囊液进行血凝试验初步鉴定。
1.3 提取病毒RNA及反转录取200 μL鸡胚病毒尿囊液,应用总RNA急速抽提试剂盒并根据其说明书步骤提取病毒总RNA。将提取的病毒总RNA依据SMART MMLV Reverse Transcriptase说明书反转为cDNA,放-20℃冰箱备用。
1.4 PCR鉴定及产物纯化参照自HOFFMANN等[4]设计的通用引物(由上海生工合成)和反应条件进行PCR扩增。根据聚合酶说明书配制50 μL反应体系。PCR反应程序:预变性95℃ 5 min;变性95℃30 s、退火55℃ 30 s、延伸72℃ 2 min 30 s,进行30个循环;终延伸72℃ 10 min,4℃保存。
配制1%琼脂糖凝胶,将PCR产物进行琼脂糖凝胶电泳后切胶。根据普通琼脂糖DNA回收试剂盒,对PCR产物进行纯化。
1.5 PCR产物克隆在微量离心管中加入pMD19-T Vector 0.2 μL、纯化后的DNA 2.3 μL和Solution Ⅰ 5 μL配制10 μL反应体系,16℃连接过夜。
依据pMDTM19-T Vector Cloning Kit说明书将连接产物转化到DH5α感受态细胞中,并将其涂布到含氨苄的LB固体培养基中培养过夜。挑取单个菌落,接种到LB液体培养液中进行摇菌,并对菌液进行PCR鉴定。
1.6 序列测序及分析将含有目的片段的菌液送至上海生工进行测序,测序结果用NCBI进行对比分析,并用MAGA 7.0软件绘制系统进化树。
2 结果
2.1 病毒分离经血凝试验和PCR检测,本试验从2017年采集自新疆艾比湖自然保护区野鸟的粪便棉拭子中分离得到1株H1N2亚型AIV,并命名为:A/Wide Bird/Ebinur Lake/40/2017(H1N2)。
2.2 分离株全基因组序列测序结果将测序后的病毒全基因序列在NCBI网站上经BLAST比对,结果显示各基因片段分别与H1、H2、H4、H7多种亚型的AIV高度同源(表1)。
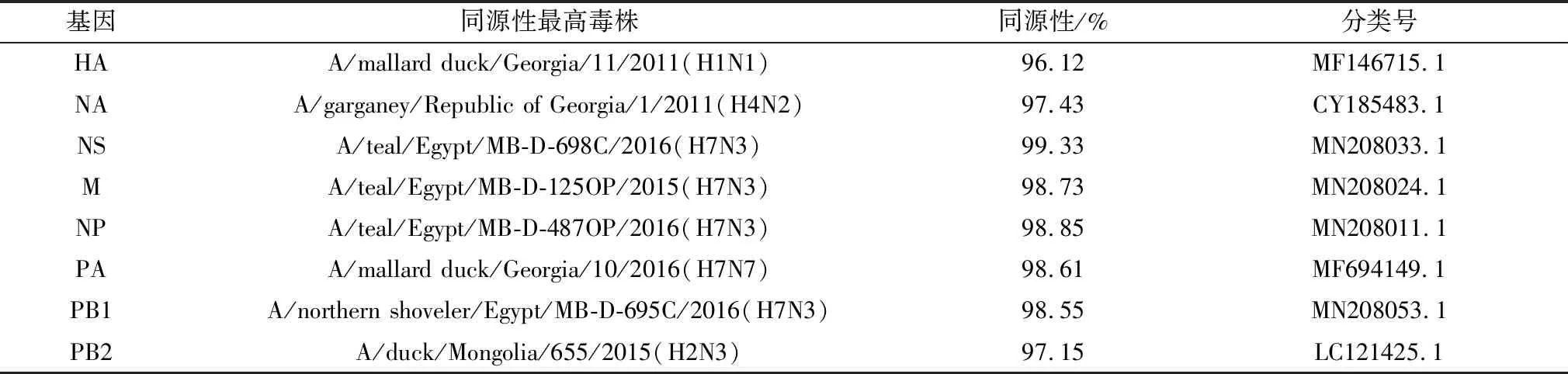
表1 A/Wide Bird/Ebinur Lake/40/2017(H1N2)株BLAST比对分析结果
2.3 基因组进化分析
2.3.1HA基因序列分析 分离株A/Wide Bird/Ebinur Lake/40/2017(H1N2)HA基因全长1 805 bp,编码区30~1 731 bp,共1 701 bp,编码566个氨基酸。在NCBI网站经BLAST比对分析后该毒株HA基因与毒株A/mallard duck/Georgia/11/2011(H1N1)的HA基因同源性最高,其核酸的一致性为96.12%。在MAGA 7.0上绘制系统进化树如图1,分析得知其属于欧亚谱系。
该毒株的裂解位点为NIPSIQSR↓GLFGAIAGF,不含有多个连续的碱性氨基酸,符合低致病性AIV氨基酸的序列特征。毒株A/Wide Bird/Ebinur Lake/40/2017(H1N2)有7个潜在的糖基化位点,分别为27NNS29、28NST30、40NVT42、104NGT106、304NSS306、498NGT500和557NGS559,并未出现核苷酸突变。但其与同源性最高毒株A/mallard duck/Georgia/11/2011(H1N1)相比出现了10个氨基酸突变,其位点分别为13I-G、15S-L、137T-A、138S-N、154L-S、202A-T、203S-N、212A-T、218V-I和232V-A,其全部位于HA1。

图1 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株HA基因遗传进化树
2.3.2NA基因序列分析 毒株A/Wide Bird/Ebinur Lake/40/2017(H1N2)NA基因全长1 484 bp,编码区为51~1 461 bp,共1 410 bp,共编码469个氨基酸。在NCBI网站经BLAST比对分析后该毒株NA基因与毒株A/garganey/Republic of Georgia/1/2011(H4N2)的NA基因同源性最高,其核酸的一致性为97.43%。在MAGA 7.0上绘制系统进化树如图2,分析得知其属于欧亚谱系。该毒株NA基因有7个潜在的糖基化位点,分别为61NIT63、69NNT71、86NWS88、146NGT148、200NAT202、234NGT236、403NWS405。其与NA基因同源性最高的毒株A/garganey/Republic of Georgia/1/2011(H4N2)相比,存在7个氨基酸变异,分别为18T-A、86N-D、125N-S、126S-P、141N-D、192A-V和212A-V,增加一个潜在糖基化位点,即86NWS88。NA 分子中与流感病毒抗达菲类药物相关的274( H-Y) 氨基酸位点没有发现突变[5],且294为N,预测对奥司他韦类药物敏感[6]。
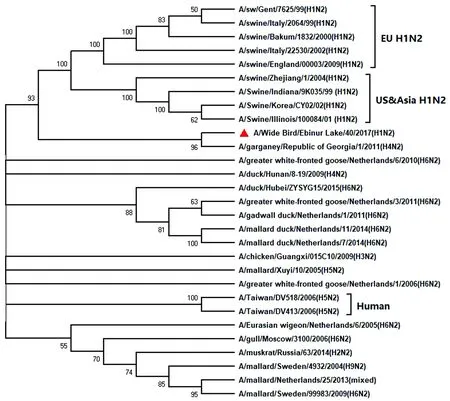
图2 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株NA基因遗传进化树
2.3.3病毒内部基因序列分析及进化 该毒株内部基因序列分析及进化显示,NS基因与毒株A/teal/Egypt/MB-D-698C/2016(H7N3)有较高的同源性(图3),其核酸的一致性为99.33%;M基因与毒株A/teal/Egypt/MB-D-125OP/2015(H7N3)有较高的同源性(图4),其核酸的一致性为98.73%;NP基因与毒株A/teal/Egypt/MB-D-487OP/2016(H7N3)有较高的同源性(图5),其核酸的一致性为98.85%;PA基因与毒株A/mallard duck/Georgia/10/2016(H7N7)有较高的同源性(图6),其核酸的一致性为98.61%;PB1基因与毒株A/northern shoveler/Egypt/MB-D-695C/2016(H7N3)有较高的同源性(图7),其核酸的一致性为98.55%;PB2基因与毒株A/duck/Mongolia/655/2015(H2N3)有较高的同源性(图8),其核酸的一致性为97.15%。无疑,该毒株与其他亚型病毒发生了重组。
内部基因序列分析显示,NS蛋白中92D突变为E可导致病毒对干扰素产生抗性[5],而在分离株中并未检测到该突变。除此之外,42S、149A均未出现与感染哺乳动物或致病性增强的突变[7]。但是本分离株NS基因与毒株A/teal/Egypt/MB-D-698C/2016(H7N3)相比139D突变为139G,该突变是否会对毒株的致病力产生影响尚未可知。M2离子通道蛋白未发生突变31S-N,显示对金刚烷胺和金刚乙氨敏感[8]。但是本分离株与毒株A/teal/Egypt/MB-D-125OP/2015(H7N3)相比,M2蛋白发生突变77L-R。NP基因与毒株A/teal/Egypt/MB-D-487OP/2016(H7N3)相比出现4个氨基酸变异,分别为105L-V、119V-I、193I-L、364R-Q。PA基因97T-I、515T-A,PB1基因198K-I、317M-K、436Y-H,均未发生使该分离株毒力增强的突变[9]。PB2基因中与宿主特异性和病毒复制能力有关的627E和701D并未发生突变[10-11],但PB2蛋白与毒株A/duck/Mongolia/655/2015(H2N3)相比出现2个氨基酸变异,分别为639D-N、464M-L。
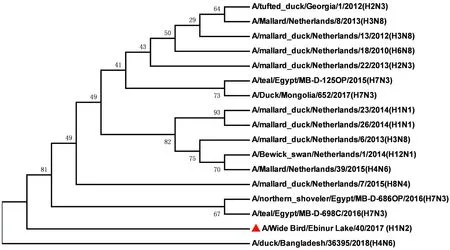
图3 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株NS基因遗传进化树

图4 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株M基因遗传进化树
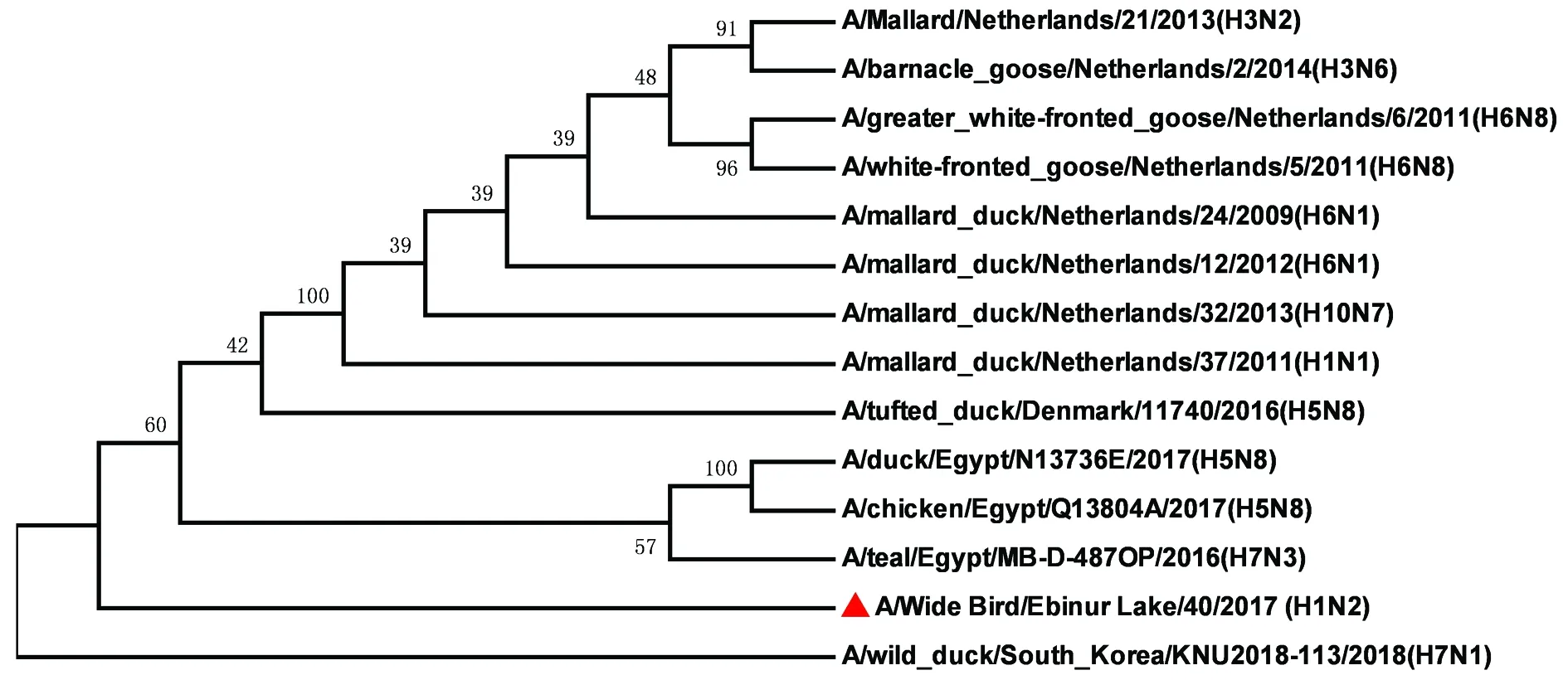
图5 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株NP基因遗传进化树
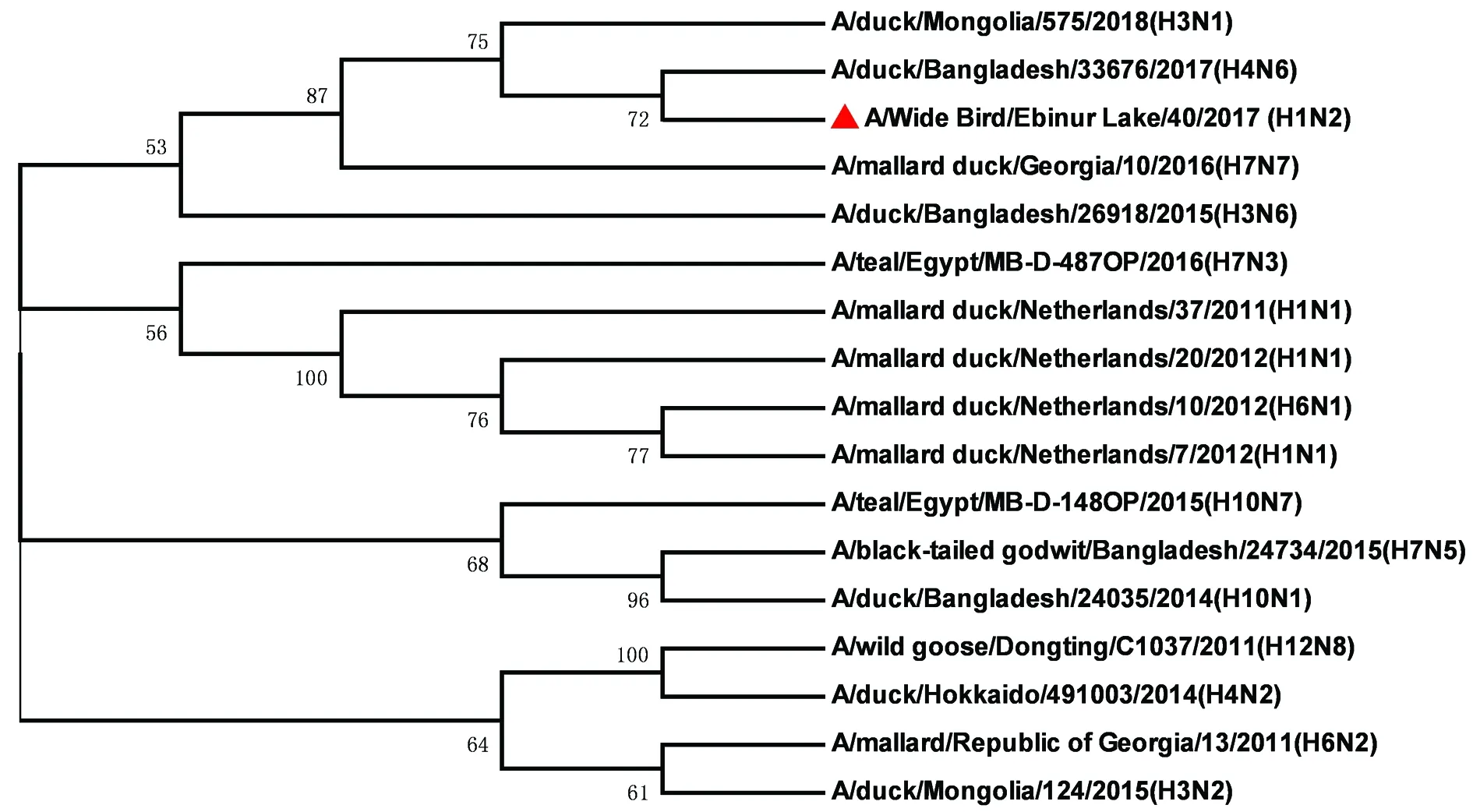
图6 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株PA基因遗传进化树
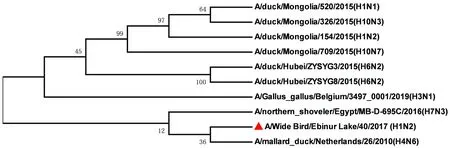
图7 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株PB1基因遗传进化树

图8 A/Wide Bird/Ebinur Lake/40/2017(H1N2)AIV分离株PB2基因遗传进化树
3 讨论
AIV基因组由8个节段的单股负链RNA构成,编码8种病毒蛋白[12-18]。HA是一种表面糖蛋白,它对流感病毒的毒力、免疫原性和种间传播有着重要的意义。HA蛋白合成后信号肽被信号肽酶切除形成HA0,在宿主蛋白酶作用下裂解而激活为HA1和HA2,分别主要介导病毒与细胞膜的接触吸附和促使病毒与细胞膜融合来完成病毒入侵细胞的过程[19]。低致病性AI的HA裂解位点由呼吸道和消化道的胰蛋白酶样蛋白酶识别,而高致病性AI携带多个连续的碱性氨基酸,使其被无处不在的糖蛋白样蛋白酶切割,导致全身性感染和高死亡率[20]。而NA酶活性的强弱会影响唾液酸受体的切割,进而影响病毒的复制使病毒表现出宿主特异性;NA基因的突变、插入或缺失都会导致酶活性的改变,使病毒突破种间障碍来引起流感的大暴发[21]。本实验室分离的毒株HA裂解位点为NIPSIQSR↓GLFGAIAGF,不含有多个连续的碱性氨基酸;NA颈部没有氨基酸缺失,符合低致病性AI的特征。除此之外,本分离株NS蛋白中92D,M2离子通道蛋白31S,PA基因中97T、515T,PB1基因中198K、317M、436Y,PB2基因中627E和701D均未发生突变。
艾比湖位于新疆博州地区精河县城以北35 km处,面积大约600 km2,是新疆第一大咸水湖[22],更是候鸟的一个重要栖息地。秋季候鸟在新疆大致有3条迁徙路线,分别是东南亚路线、印巴路线和北非路线,而艾比湖位于这3条路线的枢纽位置,是中亚鸟类迁徙的主要驿站[22]。野生水禽带毒的现象十分普遍,更被认为是AIV的自然储库。调查表明艾比湖鸟类资源不仅数量众多,而且种类丰富,几乎占全疆的55%[23]。在野鸟迁徙过程中,病毒可以在不同野鸟体内进行不断地进化和重配。而野鸟和家禽之间也可能存在病毒传播[23],当AIV由野鸟传播到家禽的时候,病毒的变异或进化速度往往会明显加快,其结果往往是导致家禽致死病的发生,甚至是带来灾难性的后果[24]。因此,检测艾比湖及周边地区野鸟的AIV带毒情况,对预防AI的发生具有十分重要的意义。
本研究从新疆艾比湖自然保护区野鸟采集的粪便棉拭子中分离出了1株H1N2亚型的低致病性AIV。经对分离株的基因分析得知,其存在与多种亚型AIV的重配现象。而其PB2基因更是与鸭源AIV的PB2基因同源性最高,有感染家禽的潜力,值得进行进一步研究。
