BTV-16四结构蛋白的共表达与病毒样颗粒的制备
2021-03-10黄超华花群义曹琛福史卫军阮周曦林彦星叶奕优陈金顶
黄超华,花群义,曹琛福,史卫军,阮周曦,林彦星,叶奕优,陶 虹,王 潇,陈金顶*
(1.华南农业大学 兽医学院,广东 广州 510642;2.深圳海关动植物检验检疫技术中心,广东 深圳 518045)
蓝舌病(bluetongue,BT)是一种虫媒性传染病,属于世界动物卫生组织(Office International des Epizooties,OIE)规定及时上报的动物疫病。BT的流行和暴发会带来巨大的经济损失。目前疫苗免疫是预防BT的主要有效手段[1-2]。蓝舌病病毒(bluetongue virus,BTV)病毒样颗粒(virus-like particles,VLPs)疫苗由于具有DIVA (disabled infectious single animal)性质基因工程苗的特点,因而成为BT疫苗研究的热点之一[3-4]。该VLPs由BTV的4种结构蛋白 VP2、VP3、VP5和VP7组装而成,其中60个VP3二聚体组装形成直径为55 nm的BTV病毒亚核心,其外层为VP7三聚体构成的二十面体结构,两者共同构成BTV CLPs[5]。VP2是BTV型特异性抗原,是BTV血清型的主要决定因素,能引起血凝,诱导产生中和抗体[6]。而VP5是BTV唯一的糖基化蛋白,在VP2免疫中和反应中起到了重要的增强作用[7]。VP5与VP2一样以三聚体形式存在,VP5三聚体最终形成球形基序与VP2三聚体形成的三脚蛋白复合体共同构成BTV VLPs的外衣层结构[3,8-10]。
流行病学调查和有关的病毒分离报道显示,我国存在的BTV血清型非常多,其中1和16型为主要血清型。目前我国虽然在BT疫苗研究上取得了诸多进展,如灭活疫苗、DNA疫苗、重组痘病毒载体疫苗和重组腺病毒疫苗等均能产生中和抗体,对动物有一定的免疫保护作用[11-12],但在BTV VLPs疫苗方面研究较少。本试验通过基因工程技术获取具有4个独立启动子的载体,构建具有BTV-16型4种结构蛋白基因VP2、VP3、VP5和VP7的重组杆状病毒并进行真核表达,以期为BTV VLPs疫苗的研发奠定基础。
1 材料与方法
1.1 主要材料pFastBac-Dual质粒购自Invitrogen公司产品;感受态细胞DH5α和DH10Bac购自Invitrogen公司;BTV-16型绵羊阳性血清和昆虫细胞Sf9由本实验室保存;Cellfectin®Ⅱ Reagent、SF-900Ⅲ培养基、PureLinkTMHiPure质粒纯化试剂盒购自Invitrogen公司;限制性内切酶以及Taq酶、BacPAKTMBaculovirus Rapid Titer Kit购自TaKaRa公司;Rabbit Anti-SheepIgG H&L(HRP)购自Abcam公司;TMB显色试剂盒购自上海生工公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司。
1.2 引物的设计与合成分别根据BTV-16 S2、L3、S6和S7基因参考序列设计并合成各自的特异性引物用于构建重组质粒的筛选和鉴定;根据F4序列设计并合成F4序列特异性引物用于载体的改造;参照Bac-to-Bac昆虫杆状表达系统操作说明,合成1对公用引物M13-F和M13-R,用于重组杆粒的筛选和鉴定。具体引物序列见表1。
1.3 pFastBac-Dual载体的改造为共表达BTV结构蛋白VP2、VP5、VP3和VP7,对载体pFastBac-Dual进行改造,使其具有4个多克隆位点(multiple cloning site,MSC),并且每个多克隆位点均具有各自独立的启动子。分析载体pFastBac-Dual的全序列,发现在载体的3 510碱基处为Bsp1407Ⅰ酶切位点且是唯一的,3 985碱基处为SnaBⅠ酶切位点且是唯一的,同时在3 510~3 985碱基处没有任何元件,因此可作为改造区域对载体进行改造。

表1 所用引物序列
由于原载体已有2个多克隆位点,各自的启动子分别为Polyhedrin和P10,因此本研究通过Bsp1407Ⅰ和SnaBⅠ双酶切载体pFastBac-Dual,切除3 510~3 985碱基处的序列,随后插入一段合成的序列F4(该序列含3 510~3 985碱基的序列和2个多克隆位点,且该2个多克隆位点具有各自独立的启动子),该序列共1 347 bp,其组成如图1所示,从而完成载体的改造。改造后的载体命名为pF4,整个载体图谱见图2,其中MSC1和MSC2为2个新插入的多克隆位点,其启动子分别为P10和Polyhedrin,而MSC3和MSC4为原有的2个多克隆位点,其启动子分别为P10和Polyhedrin。
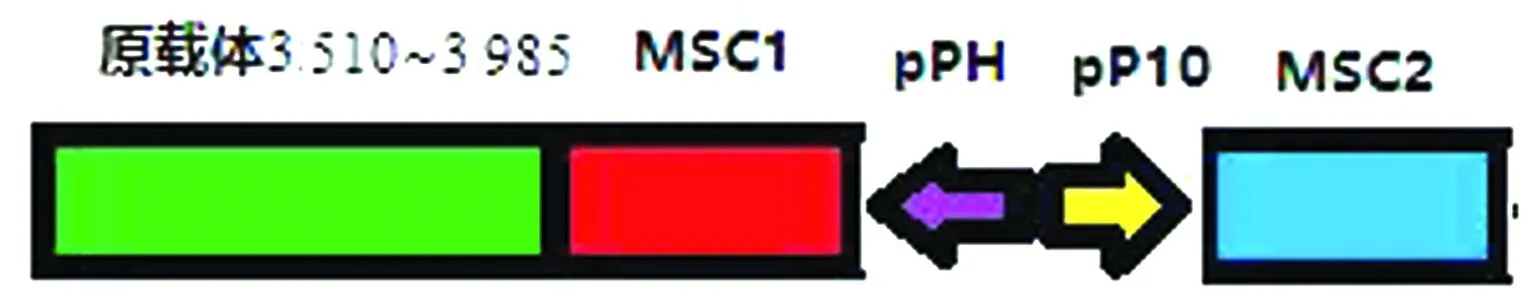
图1 合成序列F4组成
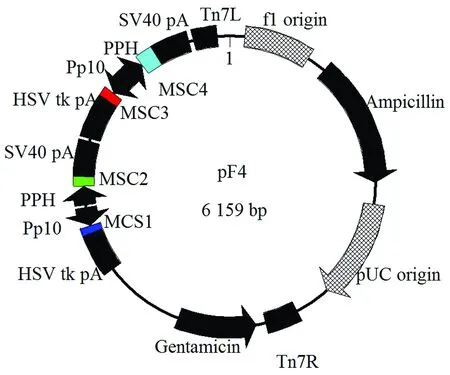
图2 pF4图谱
1.4 pF4-VP2-VP5-VP3-VP7的构建通过NCBI 基因库比对找到与BTV-16的4个结构蛋白VP2、VP5、VP3和VP7同源性较高的基因序列(AB686226.1、KF664138.1、KP339226.1和JX007-928.1),并以此为参考序列,通过上海生工公司合成VP2、VP5、VP3和VP7基因序列从而获得重组质粒pUC-VP2(VP2序列的5′和3′端分别有酶切位点EcoRⅠ和SalⅠ)、pUC-VP5(VP5序列的5′和3′端分别有酶切位点XhoⅠ和SphⅠ)、pUC-VP3(VP3序列的5′和3′端分别有酶切位点NcoⅠ和 NheⅠ)和pUC-VP7(VP7序列的5′和3′端分别有酶切位点AatIⅠ和Eco81Ⅰ)。按照常规的分子克隆技术,即双酶切、T4连接、转化感受态细胞、菌落PCR和双酶切鉴定等方法,依次将VP2、VP5、VP3和VP7基因插入到改造后的载体pF4的4个多克隆位点,其中VP2插入到MSC4,VP5插入到MSC3,VP3插入到MSC1,VP7插入到MSC2,从而构建重组质粒pF4-VP2-VP5-VP3-VP7,质粒图谱见图3。
1.5 重组杆粒Bacmid-VP2-VP5-VP3-VP7的提取通过热转化的方式将重组质粒pF4-VP2-VP5-VP3-VP7转化入感受态细胞DH10Bac中,平铺于含卡那霉素、四环素、IPTG和Bluo-gal的LB平板上,37 ℃培养48 h;挑取单个白色菌落划线于新的上述平板并继续培养48 h。挑取单个白色菌落,进行菌落PCR鉴定,确定VP2-VP5-VP3-VP7是否转座成功。鉴定结果为阳性的,过夜大量培养,并用PureLinkTMHiPure质粒纯化试剂盒大量提取纯化重组杆粒Bacmid-VP2-VP5-VP3-VP7。
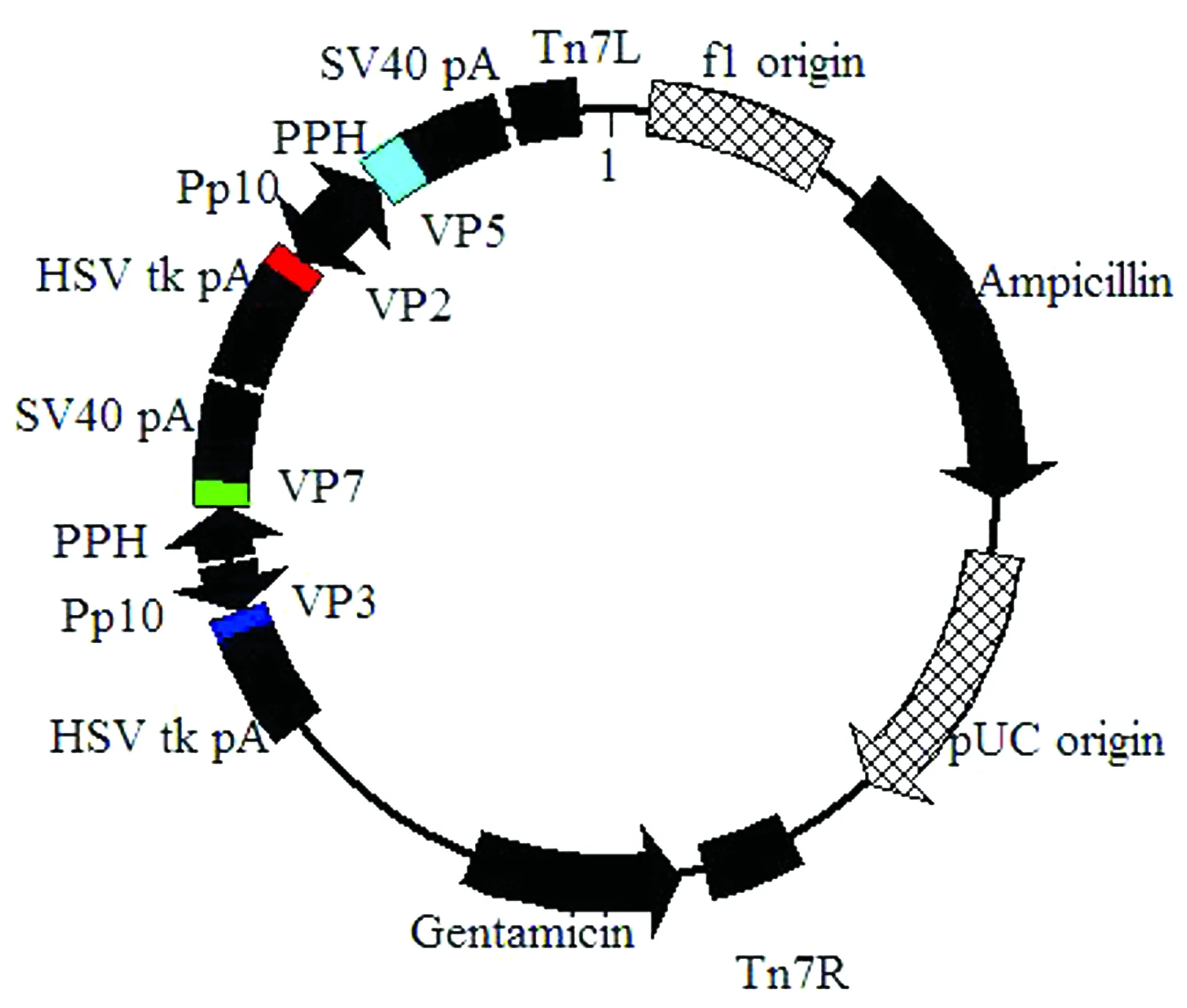
图3 pF4-VP2-VP5-VP3-VP7图谱
1.6 构建重组杆状病毒rBac-VP2-VP5-VP3-VP7用转染试剂盒Cellfectin®Ⅱ Reagent将重组杆粒Bacmid-VP2-VP5-VP3-VP7转染Sf9细胞,设空白对照,持续观察细胞病变情况。在细胞病变明显时,收集细胞培养上清,即P1代重组杆状病毒rBac-VP2-VP5-VP3-VP7,并继续传代以提高重组杆状病毒的滴度。使用TaKaRa公司的BacPAKTMBaculovirus Rapid Titer Kit测定重组杆状病毒的滴度。
1.7 BTV VLPs的纯化将无血清培养的Sf9细胞转瓶至75 cm2细胞培养瓶中(60%~80%),贴壁1 h 后,接入适量的重组杆状病毒,72 h时弃细胞培养液,加入1 mL细胞裂解液冰上裂解15 min,并反复冻融3次使细胞充分裂解,12 000 r/min,4 ℃离心10 min收集细胞裂解上清。按照前述方法大量接毒、裂解细胞、离心收集细胞裂解上清,并用Millipore超滤管进行离心浓缩。采用蔗糖梯度离心纯化浓缩后的细胞裂解上清中的BTV VLPs,蔗糖梯度离心条件参考相关文献[13]。
1.8 4种结构蛋白的抗原性鉴定取少量纯化产物进行SDS-PAEG和Western blot分析,其中Western blot 分析时,以Protein-Free T20 (PBS) Blocking Buffer室温封闭1 h;洗涤后加入绵羊BTV-16阳性血清(1∶500稀释),37 ℃孵育1 h;洗涤后加入Rabbit Anti-Sheep IgG H&L(HRP)(1∶5 000稀释),37℃孵育45 min,洗涤后显色。
1.9 BTV VLPs电镜观察取少量蔗糖梯度离心纯化的样品,采用醋酸铀负染法对样品进行负染并固定在载网上,在TEM电镜下观察VLPs形态。
2 结果
2.1 pFastBac-Dual载体的改造由上海生工公司合成F4序列,获得重组质粒pUC-F4。用Bsp1407 Ⅰ和SnaBⅠ双酶切载体pFastBac-Dual和重组质粒pUC-F4,获得具有黏性末端的pFastBac-Dual和F4片段。通过连接、转化、鉴定(菌落PCR、双酶切和测序),构建了改造后的载体pF4。用F4序列特异性引物进行菌落PCR可得到1 347 bp左右的目的条带,以Bsp-1407Ⅰ和SnaBⅠ双酶切提取的质粒可得到4 853 bp 大小的原载体条带和1 347 bp大小的目的条带,结果见图4。并对改造后的载体pF4进行全基因测序,确认载体pF4包含4个克隆位点和4个独立的启动子,且全序列未发生突变,所有元件完整。
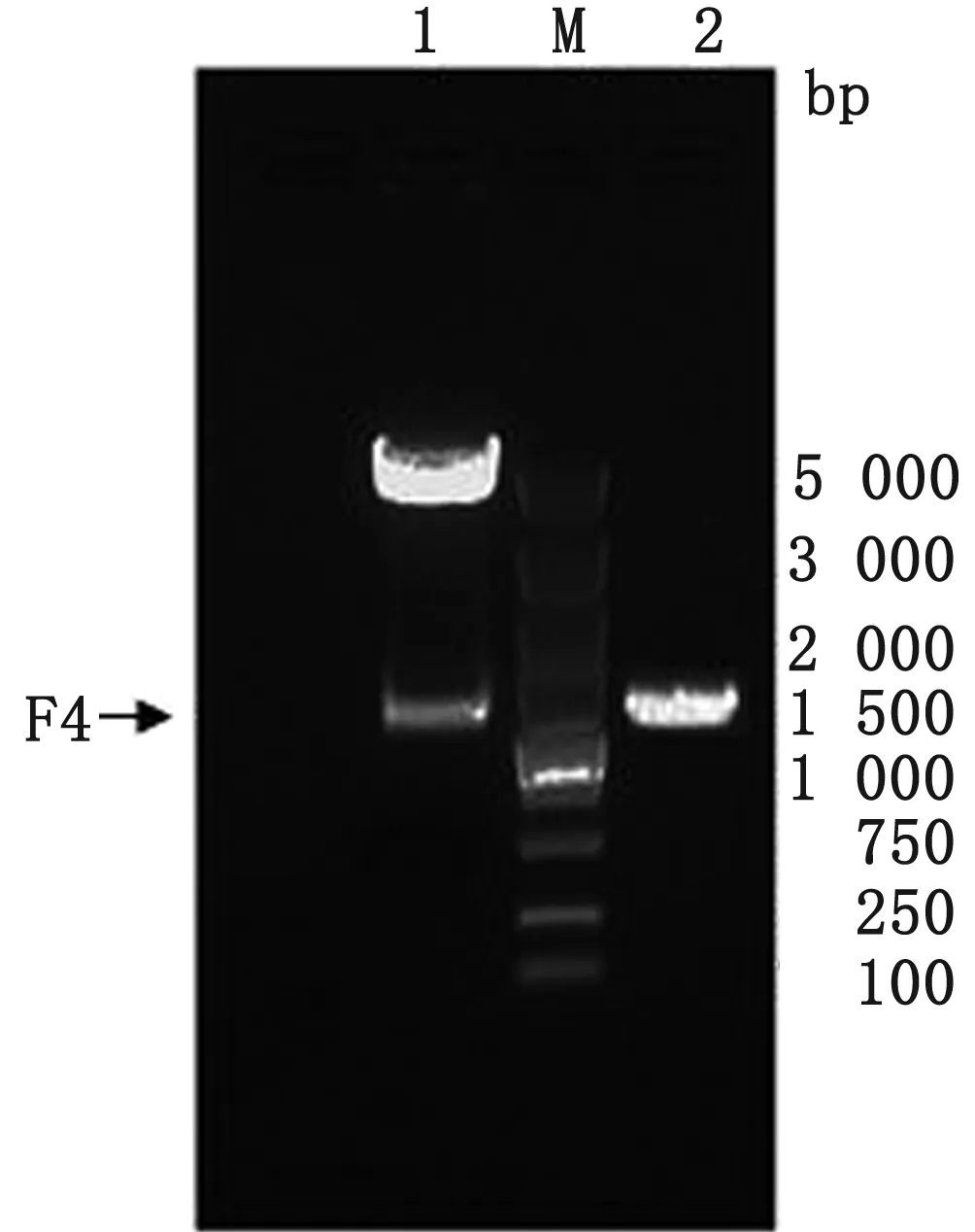
M.DL5000 DNA Marker;1.Bsp1407Ⅰ和SnaBⅠ双酶切; 2.菌落PCR
2.2 重组质粒pF4-VP2-VP5-VP3-VP7的构建按照常规的分子克隆技术,依次将VP2、VP5、VP3和VP7插入到载体pF4中,从而构建了重组质粒pF4-VP2-VP5-VP3-VP7。构建鉴定结果见图5。
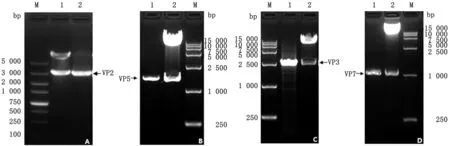
A.重组质粒pF4-VP2的鉴定结果(M.DL5000 DNA Marker;1.双酶切;2.菌落PCR);B.重组质粒pF4-VP2-VP5的鉴定结果(M.DL15000 DNA Marker;1.菌落PCR;2.双酶切);C.重组质粒pF4-VP2-VP5-VP3的鉴定结果(M.DL15000 DNA Marker;1.菌落PCR;2.双酶切);D.重组质粒pF4-VP2-VP5-VP3-VP7的鉴定结果(M.DL15000 DNA Marker;1.菌落PCR;2.双酶切)
2.3 重组杆粒Bacmid-VP2-VP5-VP3-VP7的提取将重组质粒pF4-VP2-VP5-VP3-VP7转化入DH10Bac发生转座,通过蓝白斑和菌落PCR筛选出转座成功的菌落,并用质粒纯化试剂盒大量提取纯化重组杆粒Bacmid-VP2-VP5-VP3-VP7。分别以VP2特异性上下游引物、VP3特异性上下游引物、VP5特异性上下游引物和VP7特异性上下游引物进菌落PCR,可以获得2 900,2 700,1 500,1 000 bp的目的条带分别对应VP2、VP3、VP5和VP7;为进一步确认是否转座成功,分别以VP2-F+M13-R、M13F+VP2-R引物组合进行PCR鉴定,电泳结果显示分别可以获得3 600,12 000 bp的目的条带,与预期的结果相符,结果见图6。
2.4 重组杆状病毒rBac-VP2-VP5-VP3-VP7的获得用转染试剂盒将重组杆粒Bacmid-VP2-VP5-VP3-VP7转染Sf9细胞,转染后48~72 h可以观察到明显的细胞病变:与正常Sf9细胞相比,细胞数量变少,体积变大且发生臌胀、变得容易脱落,并有少量细胞破碎,见图7。转染后超过72 h,Sf9细胞大量破碎。
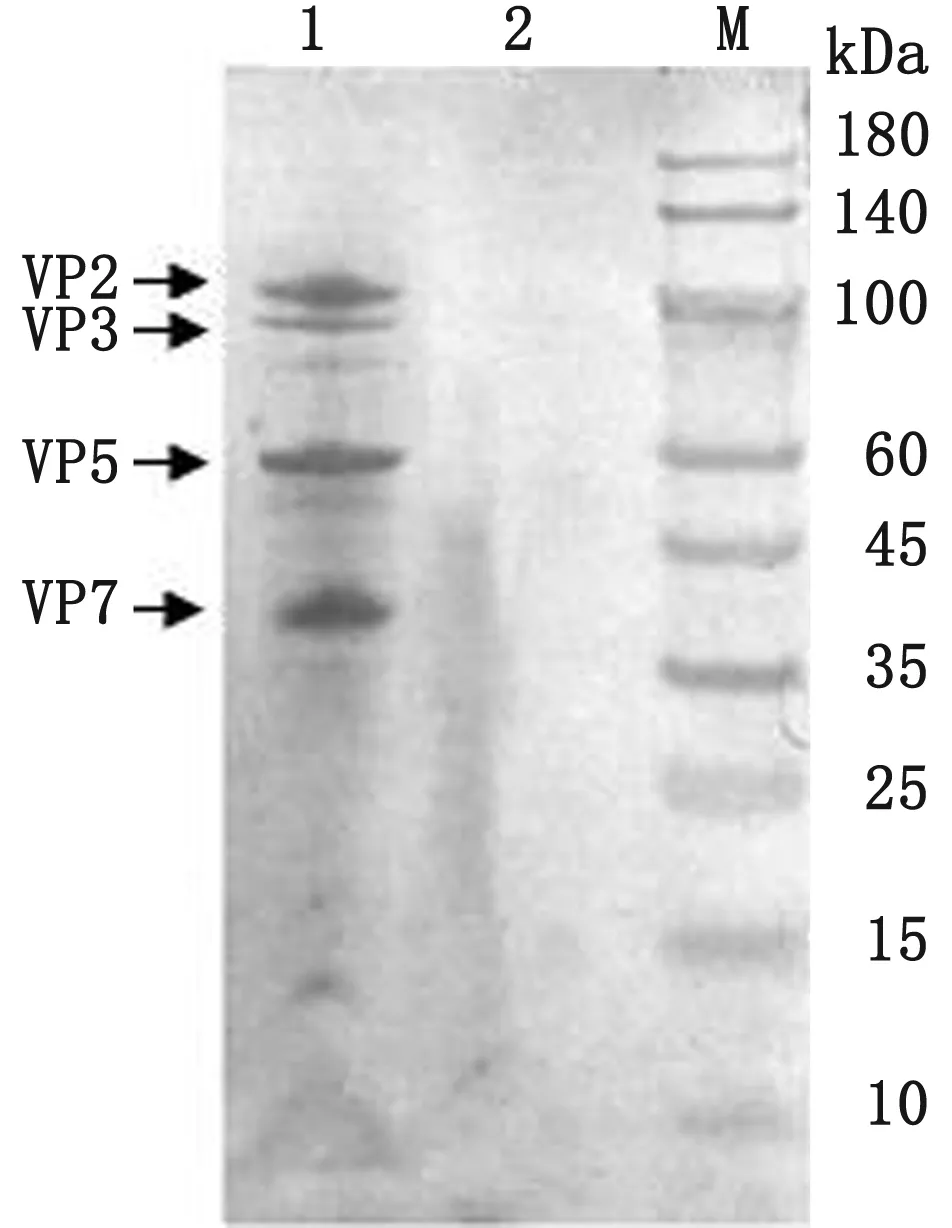
2.5 BTV VLPs的纯化及SDS-PAGE和Western blot 分析通过蔗糖梯度离心纯化得到BTV VLPs,取少量纯化产物进行SDS-PAGE(图8)和Western blot(图9)分析,结果均出现4条分别为110,100,60,38 kDa左右的主要条带,所对应的蛋白分别为VP2、VP3、VP5和VP7,说明本研究构建的重组杆状病毒可以在Sf9细胞中共表达BTV-16的4种结构蛋白并且具有免疫原性。
2.6 电镜观察结果取少量纯化产物通过醋酸铀负染固定于载网上,在透射电镜下观察其形态。结果显示,纯化的样品中存在数量较多的中空颗粒,大小形态略有不同,其中也有部分中空颗粒直径为75~85 nm,颗粒侧壁较厚,且表面的突起不明显,其形态、大小与文献报道的BTV VLPs一致。图10为透射电镜下不同视野观察到的具有典型形态的BTV-16的VLPs,并有少量中空颗粒直径为60~70 nm,颗粒表面有非常明显的突起,其形态、大小均与文献报道的杆状病毒表达系统获得的BTV CLPs一致。
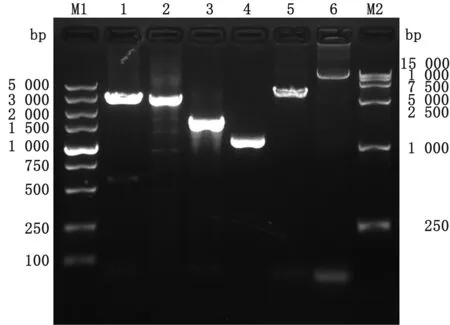
M1.DL5000 DNA Marker;1.引物组合(VP2-F+VP2-R)菌落PCR结果;2.引物组合(VP3-F+VP3-R)菌落PCR结果;3.引物组合(VP5-F+VP5-R)菌落PCR结果;4.引物组合(VP7-F+VP7-R)菌落PCR结果;5.引物组合(VP2-F+M13-R)菌落PCR结果;6.引物组合(M13-F+VP2-R)菌落PCR结果;M2.DL15000 DNA Marker
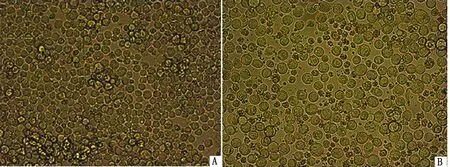
A.正常Sf9细胞;B.重组杆粒Bacmid-VP2-VP5-VP3-VP7转染Sf9细胞
3 讨论
VLPs的制备均是通过构建的表达载体在原核细胞或真核细胞中共表达多个病毒结构蛋白,使结构蛋白在体外实现自组装、形成具有原病毒类似形态结构的中空颗粒。目前,用于制备VLPs的表达体系包括昆虫杆状病毒/昆虫细胞表达体系(Bac-to-Bac)、植物细胞表达体系、哺乳动物细胞表达体系以及原核表达体系。其中昆虫杆状病毒/昆虫细胞表达体系最为常用,只有少数病毒VLPs在原核表达体系中构建成功。FRENCH等[14]和王健伟等[15]分别通过昆虫杆状病毒/昆虫细胞表达体系(Bac-to-Bac)成功制备了BTV-10、BTV-17和BTV-13 的VLPs,而THUENEMANN等[13,16]在植物细胞中共表达BTV-8 VP2、VP5、VP3和VP7这4种结构蛋白,成功制备出BTV-8 VLPs[13,16]。他们共同的特点均是通过构建双表达重组病毒(VP2+VP5组合和VP3+VP7组合),然后让这种病毒共感染真核细胞,实现4种蛋白在同一个细胞中共表达从而自组装形成VLPs。由于共感染几率相对较低,无法确保构成VLPs的4种蛋白能在同一个细胞中共表达,从而影响BTV VLPs形成的效率。为此。本研究对载体pFastBac-dual进行改造,使其具有4个多克隆位点(MSC)。虽然存在降低单个蛋白表达水平的可能,但通过这一方式能够确保4种蛋白在同一细胞中共表达,从而有利于4种蛋白实现自组装形成VLPs。
M.蛋白Marker;1.Sf9细胞蛋白;2.纯化的BTV VLPs
M.蛋白Marker;1.纯化的BTV VLPs;2.正常Sf9细胞对照
图10 电镜不同视野下观察到的VLPs(40 000×)
通过透射电镜观察BTV VLPs的大小、形态和结构,发现存在多种中空颗粒形态共存的现象,有无突起、直径在50 nm左右的中空颗粒(SCLPs),表面有非常明显的突起;直径为60~70 nm的中空颗粒(CLPs),外侧壁明显增厚(25 nm左右),表面突起不明显;还有直径为75~85 nm的中空颗粒(VLPs),以及少量形态和直径介于CLPs和VLPs之间的中空颗粒。这一结果与王健伟等[15]在昆虫细胞表达系统制备VLPs和THUENEMANN等[13,16]在植物细胞表达系统制备VLPs的结果相一致。这一现象揭示了BTV VLPs的结构和组装过程,即首先VP3自组装成亚核心颗粒(直径最小、侧壁最薄),VP7在其外层形成突起结构(CLPs的表面突起),VP2和VP5共同构成CLPs的外层结构(侧壁增厚、直径最大,同时VP2和VP5蛋白在最外层从而遮掩住了VP7形成的突起结构)。而THUENEMANN等[13,16]利用CPMV-HT 和相应的pEAQ载体系统(non-replicating system)在植物细胞中制备BTV VLPs,结果发现降低VP3表达水平可提高植物细胞中VLPs组装效率。由于本研究所用的Bac-to-Bac系统属于可复制体系,无法控制VP3的表达水平,因此并未对其结果进行验证。
本研究成功地构建了可共表达BTV-16的4种结构蛋白VP2、VP5、VP3和VP7的昆虫杆状病毒,并制备出结构完整的BTV-16 VLPs,为下一步BTV-16 VLPs免疫效果评价以及相关疫苗的研制打下基础。
