两性霉素B抗真菌作用机制与病原性土曲霉对其耐药机制的研究进展
2021-03-04梁天宇李若瑜刘伟
梁天宇,李若瑜,刘伟
北京大学第一医院皮肤性病科,国家皮肤与免疫疾病临床医学研究中心,北京大学真菌和真菌病研究中心,北京市皮肤病分子诊断重点实验室,北京 100034
侵袭性真菌病(invasive fungal disease, IFD)是一类由真菌感染引起的死亡率较高的感染性疾病,多见于骨髓移植受者、实体器官移植受者、艾滋病患者等免疫功能受损的患者,其临床预后有赖于早期诊断和有效的抗真菌药物治疗[1-2]。目前临床上用于治疗IFD的抗真菌药物有唑类、棘白菌素类、多烯类和氟胞嘧啶。其中,多烯类抗真菌药两性霉素B(amphotericin B, AMB)自20世纪50年代问世以来,尽管存在严重的肾毒性,但因其抗菌谱广、耐药性低,被广泛用于治疗曲霉、隐球菌、假丝酵母(念珠菌)、毛霉、球孢子菌等引起的侵袭性真菌感染(invasive fungal infections, IFIs)[3-4]。为克服其毒副作用,对AMB进行结构改造并发展出了脂质剂型的AMB[5-7],目前已应用于临床实践。
病原性土曲霉对AMB天然耐药[8],新近还有耐AMB的构巢曲霉和黄曲霉引起感染的报道[9-11]。既往认为,AMB通过直接作用于真菌细胞膜上的麦角固醇而引起膜通透性增加,最终发挥抗真菌作用,但详细的作用机制仍然不清楚。最近有学者在土曲霉对AMB耐药性方面进行了系列研究[12-17],提出了土曲霉对AMB耐药的新机制,还对AMB在土曲霉中的作用机制提出新观点[13]。这些研究虽然是针对土曲霉的,但对于认识AMB在临床上其他病原性曲霉中的作用机制和耐药机制也具有重要的借鉴意义。本文针对这方面的研究进展进行综述。
1 AMB的杀菌作用机制
以往认为,AMB通过特异性结合真菌细胞膜上重要的脂质组分麦角固醇而嵌入细胞膜中,形成跨膜离子通道(离子通道模型),进而导致细胞膜通透性增加、钾离子外流发挥其杀菌活性[18-21];进一步研究认为,AMB主要通过在细胞膜表面直接结合麦角固醇(表面吸附模型),或通过聚合形成巨大的膜外聚合物(固醇海绵模型)、从膜磷脂双分子层中吸附并绑定麦角固醇而发挥杀真菌作用,而跨膜离子通道的作用较小[22-23];与此同时,AMB形成的膜外聚合物也结合人体细胞膜上的胆固醇,这是导致其毒性作用的主要原因[24]。最近研究揭示,AMB通过影响土曲霉线粒体呼吸链功能,导致细胞内源性活性氧(reactive oxygen species, ROS)增加,引起细胞内氧化损伤,从而发挥其抗真菌作用[25]。
1.1 真菌线粒体呼吸链结构
真菌细胞中线粒体内膜包含5个呼吸链膜蛋白复合体[26-27](见图1)。
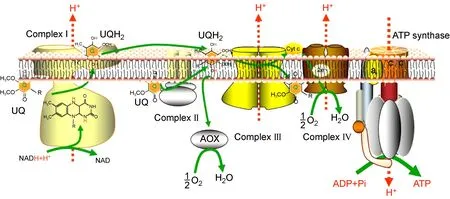
图1 真菌线粒体电子传递链模式图(UQ:泛醌;UQH2:还原性泛醌)
复合体Ⅰ:还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotide,NADH)-泛醌还原酶,由至少35个亚基构成,其中7个主要亚基为线粒体基因编码,其余附属亚基为核基因编码。这些亚基在线粒体内膜上共同参与组装构成复合体Ⅰ并维持其稳定,调控其活性。复合体Ⅰ催化NADH的电子传递给泛醌,并将质子由线粒体基质转移至线粒体膜间隙中。
复合体Ⅱ:又称琥珀酸-泛醌还原酶,由4个亚基构成,均由核基因编码,可氧化琥珀酸生成延胡索酸,并将电子传递给泛醌,但并不伴随质子转移。
复合体Ⅲ:泛醌-细胞色素C还原酶,由10个亚基组成,其中1个为线粒体编码,其余由核基因编码,其作用是将泛醌携带的电子传递给细胞色素C。
复合体Ⅳ:细胞色素C氧化酶,由12个亚基组成,其中4个亚基为线粒体基因编码,其余为核基因编码,其作用是催化氧分子生成水。
复合体V:即三磷酸腺苷(adenosine-triphosphate,ATP)合成酶,由F0、F1子复合体构成,其作用是利用复合体Ⅰ、Ⅲ、Ⅳ产生的跨膜质子梯度来合成ATP。
1.2 真菌呼吸链上的电子传递
来自NADH的电子经由复合体Ⅰ传递给泛醌,来自琥珀酸的电子经由复合体Ⅱ传递给泛醌,泛醌接受复合体Ⅰ、Ⅱ的电子生成还原性泛醌,并继续将电子传递给复合体Ⅲ,复合体Ⅲ上的电子经由细胞色素C传递给复合体Ⅳ,进一步将电子传递给氧分子,催化氧分子生成水。复合体Ⅰ、Ⅲ、Ⅳ在传递电子的同时,可将质子从线粒体基质泵入膜间隙中,在线粒体内膜两侧产生质子电化学梯度,复合体V利用这一质子电化学梯度催化二磷酸腺苷(adenosine diphosphate,ADP)和无机磷酸生成ATP[28]。同时,复合体Ⅰ、Ⅱ、Ⅲ也是产生ROS的主要部位[29-30]。
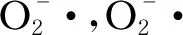
除上述经典呼吸链上的复合体Ⅰ~Ⅳ外,土曲霉线粒体氧化磷酸化系统中还存在一类替代氧化酶(alternative oxidase, AOX),包括AOX1和 AOX2,由核基因编码。AOX位于线粒体内膜,可绕过复合物Ⅲ和Ⅳ而接受复合体Ⅰ、Ⅱ传递给泛醌的电子,从而将氧还原为水,但较少生成ROS;这一替代氧化过程并不伴随质子的跨膜转移,因此较少产生ATP[27]。
真菌在高能量需求或指数生长期时,由经典复合体Ⅰ~Ⅳ途径进行电子传递,可产生大量ATP满足生长需要;而在低能量需求或稳定生长阶段,则由AOX替代途径进行电子传递,生成水和极少量ATP,ROS生成也少[35-36]。
1.3 AMB对真菌线粒体呼吸链的作用
经AMB作用的敏感土曲霉(susceptibleAspergillusterreus, ATS)产生大量内源性ROS,菌落生长受到明显抑制[12],这种情况在对AMB敏感的烟曲霉[37]和念珠菌[38]中亦可见到;抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine, NAC)为非特异性巯基供体,可清除ROS,发挥抗氧化作用[39];联合使用NAC和AMB可降低内源性ROS累积水平,并使AMB对ATS的最小抑菌浓度(minimum inhibitory concentration, MIC)升高,提示AMB通过引起ATS产生内源性ROS而发挥抗真菌作用。进一步研究发现,AMB作用的ATS中,分别以ndufs1(复合体Ⅰ亚基)、sdhc(复合体Ⅱ亚基)、cytc1(复合体Ⅲ亚基)、cox15(复合体Ⅳ亚基)基因的转录水平代表的复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ表达水平均明显增加,表明AMB可以促进复合体Ⅰ~Ⅳ的表达,增强线粒体呼吸链的功能。利用抑制剂萎锈灵(复合体Ⅱ抑制剂)、抗霉素A(复合体Ⅲ抑制剂)、氰化钾(复合体Ⅳ抑制剂)分别抑制复合体Ⅱ、Ⅲ、Ⅳ时,并未影响ATS对AMB的敏感性,但利用鱼藤酮(复合体Ⅰ抑制剂)抑制复合体Ⅰ后可使AMB的MIC升高[12],AMB引起的内源性ROS的产生明显降低。
综上所述,AMB可增强线粒体复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ的功能,并通过增强复合体Ⅰ的功能促进内源性ROS产生,从而发挥抗真菌作用。
2 病原真菌对AMB的耐药机制
2.1 麦角固醇合成途径中基因的作用
已报道白念珠菌、光滑念珠菌、新型隐球菌、土曲霉、黄曲霉、烟曲霉等对AMB可产生耐药性[3]。在酵母菌中,麦角固醇合成途径中的一系列基因的缺失或突变(包括erg1、erg2、erg3、erg4、erg6和erg11等)[40]可影响细胞膜上固醇类的生物合成,进而导致细胞膜上麦角固醇含量减少,由于缺乏可替代的中间产物供AMB靶向结合,从而导致对AMB耐药[3]。譬如,Vincent等[41]通过全基因组测序发现,临床分离的耐AMB的白念珠菌存在erg2或erg6突变,热带念珠菌存在erg3和erg11双突变,通过分别构建上述基因定向敲除菌株,证明上述erg基因突变可导致对AMB耐药。
但是,Blum等[13-14]发现临床分离的ATS、AMB天然耐药株(resistantAspergillusterreus, ATR)及对AMB敏感的烟曲霉(susceptibleAspergillusfumigatus, AFS)菌株细胞膜麦角固醇的含量并无差异,提示土曲霉对AMB耐药的机制与麦角固醇含量无关,与上述酵母菌中的情况不同。
2.2 热休克蛋白的作用
热休克蛋白90(heat shock protein 90, Hsp90)是广泛存在于真核细胞中的进化上高度保守的分子伴侣蛋白,由N端结构域(amino-terminal domain, NTD)、中间结构域(middle domain, MD)、C端结构域(carboxy-terminal domain, CTD)及MEEVD(Met-Glu-Glu-Val-Asp)基序组成,其中:NTD负责结合ATP;MD负责结合客户蛋白(client proteins)并帮助后者正确折叠,形成成熟、稳定的构象;CTD负责形成Hsp90二聚体;而MEEVD基序则主要结合共伴侣分子(co-chaperones),后者可以辅助客户蛋白的正确折叠。在酿酒酵母中,Hsp90可以与约10%的蛋白相互作用[42-43],通过调节其客户蛋白如转录因子、激酶及其他信号转导因子的折叠、转运、成熟和降解,从而广泛参与细胞内信号通路的调节以及适应性表型的产生和维持[43]。
Hsp90可通过MD结构域直接与其客户蛋白钙调磷酸酶(calcineurin)的催化亚单位相互作用,帮助后者维持构象稳定。钙调磷酸酶是一种Ca2+-钙调蛋白(calmodulin, CaM)调节的丝氨酸/苏氨酸蛋白磷酸酶,在菌丝生长、刺激适应、菌核和附着孢发育及胞壁完整性的调节中发挥重要作用[44-45]。在大多数丝状真菌中[46-48],钙调磷酸酶是由一个催化亚基CnA和一个调节亚基CnB构成的异二聚体,CnA亚基包含催化结构域(catalytic domain)、 CnB结合域(CnB binding domain)、 CaM结合域(CaM binding domain)和自身抑制域(auto-inhibitory domain, AID)共4个结构域;CnB亚基是一种Ca2+结合蛋白,结合Ca2+后可形成紧密构象,引起CnA亚基中AID及催化结构域的构象变化和活性位点暴露,帮助其发挥催化功能。
Cowen等[49]证明Hsp90通过快速选择机制,在多种真菌耐药突变及表型的产生和维持过程中发挥重要作用,但不同种的真菌影响的药物种类不同:抑制Hsp90或calcineurin可明显降低由临床分离的白念珠菌对氟康唑和伏立康唑的耐药性,但其对卡泊芬净的敏感性无明显影响;相反,抑制Hsp90或calcineurin可明显降低土壤中分离的土曲霉菌株对卡泊芬净的耐药性,但并未影响其对氟康唑的耐药性。在体外,Hsp90抑制剂格尔德霉素(geldanamycin)或其衍生物17-dimethylaminoethylamino-17-demethoxygeldanamycin (17-DMAG)与AMB具有协同作用,可显著降低 AMB 对 ATR 的MIC;AMB与钙调磷酸酶抑制剂环孢素A联用也具有相似的作用;与AFS相比,ATR和ATS具有更高的Hsp90基础表达水平,这一点可能使土曲霉对AMB引起的细胞膜应激和环境变化具有更强的适应性[15],说明Hsp90或钙调磷酸酶活性增强促进了土曲霉对AMB所致应激的适应性。
热休克蛋白70(heat shock protein 70, Hsp70)家族是另一类与Hsp90共同组成细胞内监视网络的分子伴侣,除古生菌外在所有物种中高度保守,其家族成员N端均含有高度保守的核苷酸结合结构域(NBD)及位于C端的序列多变的底物结合结构域[16]。相比于Hsp90,Hsp70的靶蛋白更加庞杂,且可以与未折叠、错误折叠及相互聚集的底物蛋白相互作用,帮助其正确折叠并维持蛋白质的稳定性[50]。当体外暴露于AMB的ATR中,Hsp70家族成员ssa和ssb的量在转录水平和蛋白质水平均显著升高;利用抑制剂pifithrin-μ抑制Hsp70后,AMB对ATR的MIC明显降低(从≥32 μg/mL降至 ≤1 μg/mL);联合使用AMB和pifithrin-μ治疗感染ATR的大蜡螟,可改善疗效,提高生存率[16],也证实了这种协同作用。 Hsp70活性增强,可促进AMB的耐药性;而抑制Hsp70活性可作为治疗ATR引起侵袭性曲霉病的潜在研究方向。
2.3 线粒体氧化磷酸化系统的作用
比较ATS和ATR时发现:未暴露于AMB时,ATS的基础耗氧速率是ATR的3.3倍,其线粒体拷贝数更高(高约23%),生长速度更快[12],毒力更强[51-52],这与敏感菌株生长快、毒力强的描述是一致的[41];暴露于AMB时,ATS的线粒体拷贝数进一步增加,内源性ROS大量产生,而ATR的线粒体拷贝数进一步减少,内源性ROS产生水平更低[12]。由于线粒体拷贝数的多寡与线粒体呼吸链活性高低一致,因此当ATR中线粒体拷贝数减少时,其耗氧速率降低,相应地内源性ROS生成减少,从而导致耐药性增强。
进一步研究发现[12],暴露于AMB的ATS线粒体复合体Ⅰ表达水平显著升高,aox表达水平轻度升高,ROS的生成增多;暴露于AMB的ATR的线粒体复合体Ⅰ表达水平仅轻度升高,而AOX表达水平显著升高,ROS的生成相对减少。如前所述,复合体Ⅰ活性的降低可减少ATS中ROS的生成,AOX高表达也可能参与抑制ROS生成[35-36];进一步利用水杨羟肟酸(salicylhydroxamic acid, SHAM)抑制ATR中AOX的活性,则内源性ROS水平明显增加、AMB的MIC明显下降[12],再次提示AOX的高表达可导致ATR中ROS生成减少,产生耐药性,因此AOX可作为抗真菌药物的潜在靶点。
总之,AMB通过增强呼吸链经典途径中线粒体复合体Ⅰ的功能而促进真菌细胞产生内源性ROS,最终发挥抗真菌作用。暴露于AMB的ATR中,呼吸链经典途径中线粒体复合体Ⅰ表达水平仅轻度升高,不及ATS中显著;而替代途径AOX功能显著增强,内源性ROS生成相对减少,最终产生耐药性。
2.4 ROS清除系统的作用
ROS是真核细胞呼吸链过程中产生的有害物质,及时清除ROS对于维持其正常的生命活动具有重要作用。真核细胞中存在多种ROS 清除系统,包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)等。当细胞内源性ROS生成增多引起氧化应激时,可诱导上述ROS清除酶的表达,减少细胞内的氧化损伤[26]。
研究表明,未暴露于AMB时[52],ATR中SOD的活性约为ATS中的2倍,而CAT 表达水平无明显差异,说明ATR较ATS清除ROS的能力更强;暴露于AMB后,ATS中SOD和CAT的表达水平无明显变化,但在ATR中均明显增加,说明AMB可促使ATR增强对ROS的清除能力。利用抑制剂N,N-二甲基二硫代氨基甲酸(N-N-diethyldithiocarbamate, DDC)和3-氨基-1,2,4-三氮唑(3-amino-1,2,4-triazole, 3-AT)分别抑制SOD和CAT的活性,均可使ATR中内源性ROS水平明显增加,AMB的MIC降至敏感水平;且在ATS中,抑制SOD或CAT可使AMB的MIC进一步降低。总之,ATR中SOD和CAT活性增强,可快速清除内源性ROS,是ATR对AMB耐药的可能机制之一;且抑制真菌SOD和CAT活性,可作为潜在的抗真菌治疗靶点。
3 结语
如图2总结所示,AMB的抗真菌作用机制包括:①AMB直接结合真菌细胞膜麦角固醇和(或)形成细胞膜离子通道,破坏真菌细胞膜结构的完整性,影响细胞内外离子水平和渗透压改变;②AMB增加土曲霉线粒体拷贝数,增强线粒体呼吸链经典途径中复合体Ⅰ的活性,产生大量内源性ROS,从而引起真菌细胞的氧化损伤。
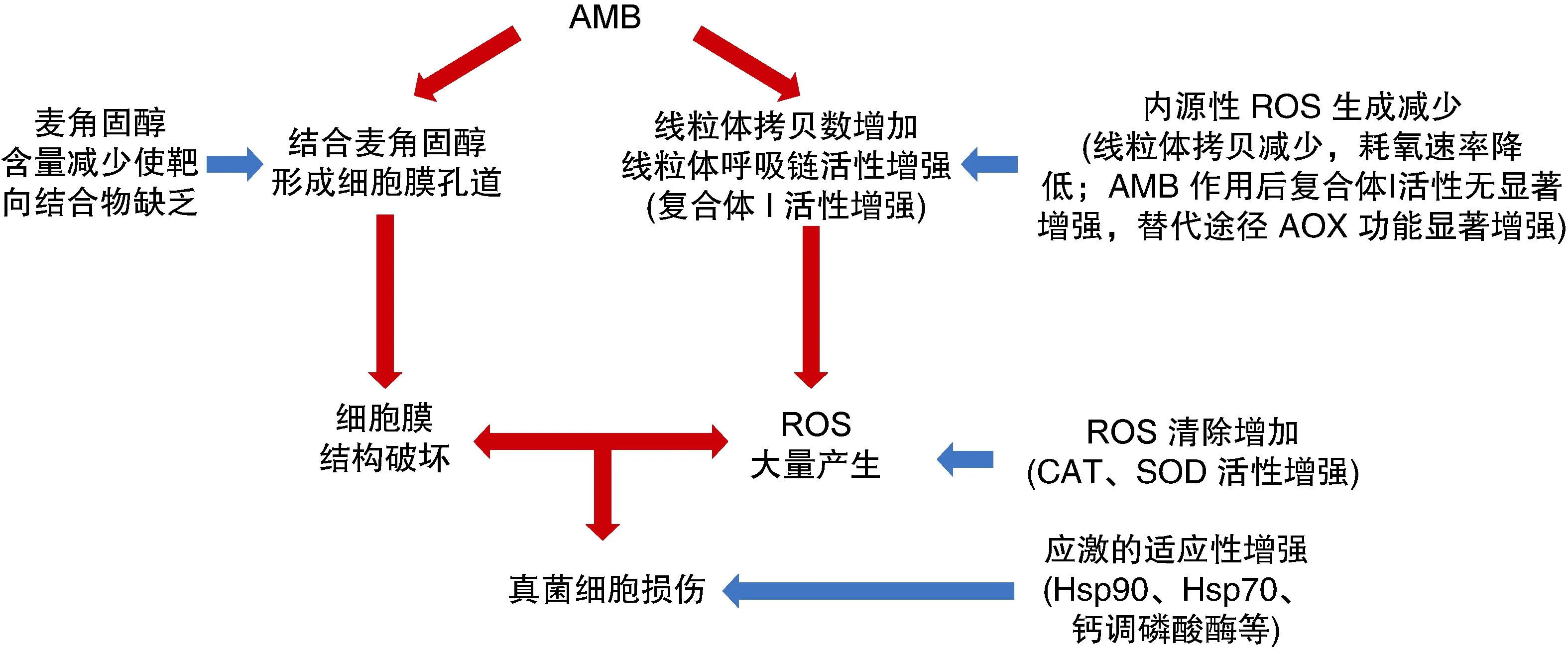
图2 AMB抗真菌作用机制和耐药机制(红色箭头代表作用机制,蓝色箭头代表耐药机制)
病原真菌对AMB的耐药机制包括:①酵母中麦角固醇合成途径基因突变或缺失,导致细胞膜麦角固醇含量减少而使靶向结合物缺乏;②土曲霉中分子伴侣Hsp90、钙调磷酸酶及Hsp70的活性升高,增强了其对AMB所致应激的适应性;③土曲霉线粒体拷贝数减少,耗氧速率降低,内源性ROS生成减少;④土曲霉经AMB作用后,呼吸链经典途径中线粒体复合体Ⅰ活性无显著升高,同时替代途径AOX功能显著增强,内源性ROS生成减少;⑤土曲霉ROS清除酶CAT、SOD活性增强所致的内源性ROS清除增强。
