流感病毒感染巨噬细胞对缺氧诱导因子-1α诱导炎症反应通路的机制研究
2021-03-04何燕超张静冯净净揭志军
何燕超,张静,冯净净,揭志军
1. 复旦大学附属上海市第五人民医院呼吸内科,上海 200240; 2. 复旦大学社区健康研究中心(筹),上海 200240
甲型H1N1流感病毒(简称H1N1)是最常见的呼吸道病毒,呈季节性流行,部分H1N1感染可进展为重症,出现病毒性肺炎,进展速度快,早期即可出现呼吸衰竭,病死率高。目前研究发现,H1N1重症感染可能与过度的炎症反应相关,但具体作用机制仍不明确[1]。
缺氧诱导因子(hypoxia inducible factor,HIF)-1α是一种异源二聚体,由α和β 2个亚基组成。HIF-1α主要存在于细胞质内,而HIF-1β存在于细胞核内。生理状态下HIF-1α会被脯氨酸羟化酶(prolyl hydroxylases,PHDs)识别并迅速泛素化进而降解。缺氧状态下PHDs活性受抑制,导致HIF-1α水平升高,HIF-1α可转移到核内与HIF-1β结合形成活性HIF-1,继而作用于DNA激活一系列反应[2]。目前,HIF-1α已被证明可以参与血管生成、内皮细胞分化及纤维化,其与肿瘤的发病及自身免疫性疾病的活动密切相关。而HIF-1α在呼吸道病毒感染中的相关研究较少,尚不明确其作用[3-4]。近年来,一些动物研究发现,机体感染H1N1后,即使在不缺氧的炎症状态下亦可诱导肺HIF-1α水平升高,因此推测HIF-1α可能参与了H1N1感染的炎症反应[5-6]。鉴于此,本研究检测肺巨噬细胞感染H1N1后HIF-1α、干扰素(interferon,IFN)-γ、白细胞介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α和M蛋白(M protein,MBP)的变化,并将HIF-1α活性抑制后,检测IL-6、TNF-α相关通路核转录因子-κB(nuclear factor-κB,NF-κB)、促分裂原活化的蛋白激酶(mitogenactivated protein kinase,MAPK)、磷脂酰肌醇3激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)等蛋白的表达变化,探讨HIF-1α在H1N1感染诱导的炎症反应中的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒小鼠巨噬细胞系(RAW264.7)、犬肾细胞系(MDCK)、流感病毒A/PR/8(H1N1)病毒株来源于美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.1.2 试剂实时聚合酶链反应(real-time polymerase chain reaction,real-time PCR)试剂盒、Trizol、RNA溶解液购自北京全式金生物技术有限公司;反转录试剂盒、BCA蛋白定量试剂盒、聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜、标准蛋白质溶液(BSA)、噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)和二甲基亚砜(dimethyl sulfoxide,DMSO)购自上海碧云天生物技术有限公司;HIF-1α抗体、NF-κB抗体、MAPK抗体、Akt抗体、MBP抗体、β-actin抗体购自美国Affinity公司;羊抗鼠-HRP购自中国索莱宝公司;蛋白marker购自美国Thermo Scientific 公司;2-甲氧基雌二醇(2-methoxyestradiol,2-MeOE2)购自美国Selleck Chemicals公司。
1.1.3 主要仪器生物倒置显微镜购自日本Olympus公司;台式低速离心机购自上海医疗器械股份有限公司医疗设备厂;离心机、荧光定量PCR仪购自德国Eppendorf公司;低温(4 ℃)离心机、酶标仪购自德国Thermo公司;电泳仪购自中国君意公司。
1.2 方法
1.2.1 H1N1 PR8病毒悬液的制备此操作在生物安全二级(biosafety level 2,BSL-2)实验室完成,复苏MDCK细胞,加入细胞培养基(90% MEM细胞培养液+10%小牛血清),在37 ℃、5% CO2培养箱中传代培养2代,将H1N1 PR8病毒原液稀释后用T25细胞瓶接种于MDCK细胞,用40×物镜每日观察细胞的生长状态。当75%~100%细胞出现病变时,反复冻融2次,用10 mL 无菌移液管吸取病毒液置于15 mL无菌离心管中,混匀病毒。收获的病毒液用半数组织培养物感染量(50% tissue culture infectious dose,TCID50)法测定病毒悬液的毒力:将病毒液作连续10倍稀释,计算各组出现阳性孔率。lgTCID50=L-D(S-0.5),L:最高浓度稀释度的对数,D:稀释对数之间的差,S:阳性孔比率总和。将病毒液冻于 -80 ℃冰箱待后续实验使用。
1.2.2 H1N1PR8感染细胞复苏RAW264.7细胞,加入细胞培养基(90% MEM细胞生长液+10%小牛血清),在37 ℃、5% CO2培养箱中传代培养2代后接种于12孔板,设3个复孔,用H1N1PR8感染细胞,调整感染复数(multiplicity of infection, MOI;MOI是指病毒感染单位数与细胞数的比值)为1,分别在0、6、12、24、48 h后收集细胞,提取总蛋白及RNA待检测。以感染灭活H1N1PR8的RAW264.7细胞为对照组。
1.2.3 H1N1PR8感染抑制试验复苏RAW264.7细胞传代培养(方法同感染实验)2代后接种于12孔板,设3个复孔,应用H1N1PR8(MOI=1)感染细胞,同时加入HIF-1α抑制剂 2-MeOE-2 (10 nmol/L),培养细胞24 h,对照组加入蛋白酶体抑制剂对照品。
1.2.4 PCR检测细胞因子mRNA水平收集细胞加入1 mL Trizol、200 μL氯仿振荡裂解细胞提取RNA,用异丙醇沉淀、乙醇清洗,再加入适量RNA溶解液溶解沉淀物,运用两步法实时PCR进行反转录RNA并扩增(95 ℃ 3 min、95 ℃ 30 s+55 ℃ 20 s 40个循环、72 ℃ 20 s;95 ℃ 15 s+60 ℃ 15 s;20 min升温 95 ℃ 15 s),具体引物序列如表1所示。

表1 引物序列
1.2.5 蛋白质印迹法(Western blot, WB)检测关键蛋白将蛋白裂解液加入经胰酶消化的各组细胞以提取蛋白,用BCA蛋白定量试剂盒测定蛋白浓度。每孔上样100 μg细胞总蛋白,经分离胶凝胶电泳分离后转移至PVDF膜(条件:4 ℃,100 V/100 mA),用含3% 标准蛋白质溶液(BSA)的封闭液浸泡PVDF膜,置室温摇床封闭2 h。分别加入HIF-1a抗体、β-actin抗体、NF-κB抗体、MAPK抗体、AKT抗体、MBP抗体4 ℃孵育过夜,洗去多余抗体;加入羊抗鼠-HRP置室温孵育2 h,洗去多余抗体(同前);经底物化学发光反应后用X线胶片压片,依次放入显影液显影。
1.2.6 细胞存活和生长实验(MTT比色法)用10%胎牛血清悬浮细胞,将细胞接种到96孔板,104个/孔,设3个复孔,给予H1N1 PR8(MOI=1)感染细胞(抑制试验需加入2-MeOE-2);在培养0、6、12、24、48 h后每孔加入MTT溶液(储存浓度5 mg/mL)20 μL,继续在37 ℃,CO2培养箱中孵育4 h,吸除上清液,每孔加入150 μL DMSO,振荡10 min使结晶物充分融解;选择490 nm波长,在酶联免疫检测仪上测定各孔光吸收值,记录结果,绘制细胞生长曲线。
1.3 统计学处理
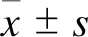
2 结果
2.1 H1N1感染巨噬细胞后的表型变化
H1N1 PR8感染小鼠巨噬细胞RAW264.7后,在显微镜下观察可见其在感染后6 h即出现细胞聚集现象,感染后24 h见坏死细胞增多,细胞量减少,感染后48 h见坏死细胞明显增多,细胞量明显减少。H1N1 PR8-MBP mRNA水平变化基本与细胞病变表现一致,其在感染后24 h达到高峰,到48 h 开始下降。MTT细胞生长实验结果显示,感染后12 h小鼠巨噬细胞RAW264.7吸光值较于正常对照开始显著下降。具体结果如图1、图2所示。

A: 0 h post infection. B: 6 h post infection. C: 12 h post infection. D: 24 h post infection. E: 48 h post infection. F: Virus titer of PR8 infect RAW264.7. Note: compared with 0 HPI, *P<0.05, **P<0.01, *** P<0.001; HPI: hour post infection.
A: Compared with un-infected group. B: Compared with 0 HPI.
2.2 H1N1感染巨噬细胞后HIF-1α及炎症因子mRNA水平增高
通过PCR检测H1N1 PR8感染小鼠巨噬细胞RAW264.7后HIF-1α及其他细胞因子mRNA表达水平的变化,发现HIF-1α在感染后6 h开始升高,感染后12 h迅速上升,24 h达到峰值。IFN-γ、IL-6、TNF-α变化趋势基本与HIF-1α一致,在感染6 h开始升高,感染24 h达到高峰,但在感染12 h并未进入快速上升期。具体结果如图2所示。
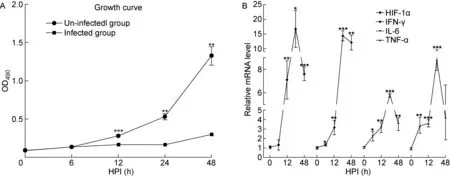
2.3 H1N1感染巨噬细胞后HIF-1α蛋白及NF-κB通路蛋白表达增高
通过WB进一步检测了H1N1 PR8感染小鼠巨噬细胞RAW264.7后HIF-1α及炎症相关信号通路蛋白表达变化,结果发现HIF-1α蛋白在感染后6 h明显增多,24 h达到峰值,与mRNA水平变化基本一致。NF-κB通路蛋白在感染后12 h明显增多,48 h开始减少,而MAPK、AKT等通路蛋白并未见显著变化。另外,检测RAW264.7细胞内H1N1PR8的MBP水平,结果发现其在12 h开始增多,24 h达到峰值,结果与其mRNA变化基本一致。结果如图3所示。
Note: NF-κB, nuclear factor-κB; MBP, PR8 M protein; MAPK, mitogenactivated protein kinase; HIF-1a, hypoxia inducible factor-1a; AKT, phosphoinositide 3-kinase/protein kinase B; ACTB, β-actin.
2.4 HIF-1α蛋白与参与炎症反应
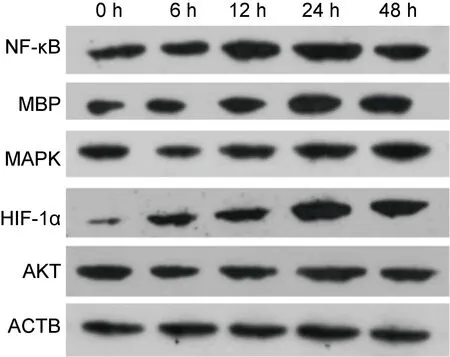
在给予小鼠巨噬细胞感染H1N1的同时,加入2-MeOE-2(10 nmol/L)/蛋白酶体抑制剂对照品,培养细胞24 h,在显微镜下观察可见加入抑制剂组(简称实验组)细胞数量较加入蛋白酶体抑制剂对照品组(简称对照组)多,坏死细胞亦较对照组少,MTT细胞生长实验亦显示实验组吸光度值高于对照组。同时,通过PCR检测炎症因子mRNA的水平,发现实验组IL-6、TNF-α等炎症因子的mRNA水平较对照组显著下降(P<0.05)。另外,IFN-γ及MBP mRNA的水平亦有下降(P<0.05)。结果如图4所示。
A: Co-culture with placebo 24 h post infection. B: Co-culture with 2-MeOE-2 24 h post infection. C: The changes of HIF-1α、IFN-γ、IL-6、TNF-α and M-protein mRNA level when co-culture with 2-MeOE-2. D: The change of cell growth when co-culture with 2-MeOE-2.
2.5 HIF-1α可通过NF-κB通路促进炎症反应
重复上述试验,进一步通过WB检测发现实验组NF-κB通路蛋白表达下降,而MAPK、AKT等通路蛋白无变化,同时发现H1N1PR8的MBP亦表达减少。另外, 2-MeOE-2可在细胞感染后 24 h 显著抑制HIF-1α蛋白表达。结果如图5所示。
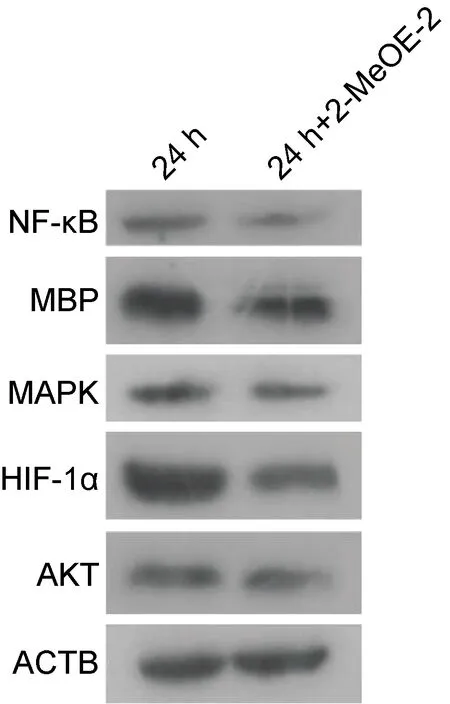
Note: NF-κB, nuclear factor-κB; MBP, PR8 M protein; MAPK, mitogenactivated protein kinase; HIF-1α, hypoxia inducible factor-1α; AKT, protein kinase B; ACTB, β-actin; 24 h: co-culture with placebo 24 h post infection; 24 h+2-MeOE-2: co-culture with 2-MeOE-2 24 h post infection.
3 讨论
全球每年有300万~500万严重流感病例。据美国疾病预防控制中心(Centers for Disease Control and Prevention,CDC)调查,2019—2020年流感季中有 1 900 万人感染流感病毒,至少有1万人死亡[7]。流感病情严重程度与其诱导的过度炎症反应密切相关,但其具体机制尚不明确。因此,本研究从 HIF-1α 参与H1N1诱导炎症反应机制的角度出发,探索其炎症反应机制。已有研究论证巨噬细胞一方面可以吞噬并识别流感病毒,从而分泌 IL-6/TNF-α等炎症因子诱导炎症反应;另一方面,它也可以直接分泌IFN-γ等,具有直接抗病毒的作用[8-9]。因此,本研究建立流感病毒感染巨噬细胞模型,探索HIF-1α在其中诱导炎症反应的机制。
本研究发现,巨噬细胞感染流感病毒后6 h出现聚集现象,12 h出现细胞坏死现象,48 h可见大量细胞坏死。由MTT细胞生长曲线结果可知,巨噬细胞感染H1N1PR8后12 h生长受抑制,48 h明显受抑制。进一步研究发现,病毒复制率在24 h达到高峰,IFN-γ、IL-6、TNF-α mRNA表达水平与病毒复制率基本一致。这些结果说明巨噬细胞可分泌IFN-γ抗病毒,同时可分泌IL-6、TNF-α 参与炎症反应。其他一些动物研究结果与本研究结果一致。Halstead等[9]研究发现小鼠感染H1N1PR8后可促进M1型巨噬细胞分化,促进炎症反应,同时亦可诱导巨噬细胞分泌IFN-γ;Xu和Liu[10]进一步研究发现,巨噬细胞感染H1N1PR8后可通过NF-κB通路诱导炎症反应。本研究中HIF-1α mRNA水平相对IL-6、TNF-α等炎症因子更早升高,说明 HIF-1α 可能更早参与流感病毒诱导的炎症反应。在蛋白水平检测HIF-1α,发现其在6 h即开始显著上升,24 h达到最高峰。HIF-1α、IFN-γ、IL-6、TNF-α 等在48 h表达下降,可能与流感病毒感染巨噬细胞导致坏死相关。之前筛查细胞感染病毒后NF-κB、APK、AKT等炎症相关通路蛋白[11-13]表达在上述时间点变化,发现NF-κB通路蛋白在感染12 h开始增高。这可能说明,NF-κB通路是HIF-1α的通路蛋白,此结果与Xu和Liu[10]的研究结果一致。目前,关于HIF-1在流感领域的研究较少。Guo等[14]给予肺上皮细胞A549、单核细胞THP-1不同滴度的H1N1PR8感染,24 h后收样,并未发现HIF-1α mRNA在感染后有变化,进一步研究发现A549、THP-1细胞感染流感病毒后,HIF-1α转入细胞核内量增多,这与本研究得到的结果有相似之处。
因各类蛋白在24 h变化最明显,本研究选择在感染24 h加入HIF-1α抑制剂2-MeOE-2,发现加入2-MeOE-2后坏死细胞数较单纯感染组明显减少;在mRNA水平,IL-6、TNF-α、IFN-γ、MBP等均有明显下降;在蛋白水平,NF-κB、MBP表达均有下降。结果表明,HIF-1α通过NF-κB通路上调IL-6、TNF-α等参与H1N1诱导的炎症反应。MBP蛋白受抑制可能为炎症反应受抑制的间接表现,不能说明HIF-1α有直接抗病毒作用。本研究得到的结论仍有其局限性,须通过更进一步的动物试验及临床检测结果来验证。
综上所述,H1N1感染后巨噬细胞中的HIF-1α可直接诱导炎症反应的产生,其途径可能是通过激活NF-κB通路促进IL-6、TNF-α等炎症因子的分泌参与炎症反应。在本研究的细胞试验中,HIF-1α展现出良好的前景,可能为流感治疗提供一个新视点。
