刃天青微量板法对沙门氏菌的抗菌敏感性试验
2021-03-01任奕婧孙嘉笛孙秀兰
任奕婧 孙嘉笛 孙秀兰


摘要 采用刃天青微量板法检测多株沙门氏菌对抗生素的耐药性,得到最小抑菌浓度(MIC)。通过肉眼观察和荧光检测都可判定沙门氏菌的耐药性,判定时间仅需5 h,刃天青法与微量肉汤稀释法检测得到的耐药性结果一致。其中用颜色观察能更清晰明确地分辨出耐药折点,荧光检测可以动态地反映细菌随时间变化的生长情况。刃天青微量板法具有简便、快速、灵敏度高的特点,能确定抗生素的耐药性和精确耐药MIC值。
关键词 沙门氏菌;药敏试验;刃天青微量板法
中图分类号 R446.5 文献标识码 A 文章编号 0517-6611(2021)03-0199-04
doi:10.3969/j.issn.0517-6611.2021.03.053
Abstract The resazurin microplate method was used to detect the resistance of several Salmonella strains to antibiotics, and the minimum inhibitory concentration (MIC) was obtained.The drug resistance of Salmonella could be determined by visual inspection and fluorescence detection, and the determination time was only 5 hours. The drug resistance results obtained by the resazurin method and the micro broth dilution method were consistent. Among them, color observation could more clearly distinguish drugresistant turning points, and fluorescence detection could dynamically reflect the growth of bacteria over time. The resazurin microplate method was simple, fast and highly sensitive. It could determine antibiotic resistance and precise resistance MIC values.
Key words Salmonella;Antibiotic sensitivity test;Resazurin microplate method
沙門氏菌(Salmonella)作为一种食源性病原体,对人类健康构成了巨大威胁。沙门氏菌可通过受污染的畜禽产品、蛋、奶乃至海洋产品感染人类[1-7]。近年来,由于抗生素的广泛使用,出现了沙门氏菌耐药株和多重耐药株,导致沙门氏菌耐药性问题日益严重,对畜牧业和人类健康都构成了潜在威胁[8-9]。
为了应对这种威胁,迫切需要进行抗生素敏感测试(AST),以快速诊断这些危险细菌的耐药性,确保快速、准确地使用抗生素。当前,各种传统实验室方法可用来表征微生物对抗生素的体外敏感性,如常量肉汤稀释和微量肉汤稀释法、圆盘扩散法和抗菌梯度法等。但是,这些方法多数都需要冗长的测试程序,通常需要经历收集样品、富集培养物,在这之后还至少需要孵育16 h才能进行检测[10-11]。耐药细菌的流行率增加表明现在迫切需要能够在数小时而不是数天之内提供药敏性数据的AST。除了常规检测方法,mPCR法和全自动微生物分析仪测定法等新型检测技术也已运用在耐药性检测中[12]。基于已知和赋予细菌抗性基因的扩增和检测技术,与常规培养方法相比,酶促扩增技术减少了检测时间[13-14]。但这些技术需要大型且昂贵的仪器,这限制了它们在资源受限的环境中的使用。
刃天青(resazurin)作为一种氧化还原染料,活细菌可以将刃天青转化为粉红色的荧光染料试卤灵(resorufin),继续反应可以变为白色无荧光的二氢试卤灵(dihydroresorufin)。因其安全无毒、经济实惠的优点,已被越来越多地应用于细胞活力和细胞增殖能力的评估[15-16]。以刃天青为指示剂的低成本药敏试验方法,能动态地反映细菌的生长情况,可以检测药物的作用时间和细菌的耐药情况。该研究采用刃天青法检测沙门氏菌对几种抗生素的敏感性,确定最佳试验条件,为沙门氏菌的快速、简便检测提供一种新方法。
1 材料与方法
1.1 试材
氧氟沙星(Ofloxacin)、环丙沙星(Ciprofloxacin)购自上海麦克林生化科技有限公司;氯金酸(AuCl3·HCl·4H2O)购自美国Sigma试剂有限公司;氨苄西林(Ampicillin)、美罗培南(Meropenem)、四环素(Tetracycline)、刃天青(Resazurin)、盐酸(HCl)购自上海国药集团;营养肉汤(NB)、营养琼脂(NA)购自上海博威生物医药有限公司。所有溶液均用超纯水制备,所有试剂均为分析纯。鼠伤寒沙门氏菌ATCC14028(Salmonella typhimurium)为实验室保存菌株,其余沙门氏菌(Salmonella)分离株均来自华中农业大学,-80 ℃保存备用。
1.2 仪器
Lab Dancer漩涡仪,IKA公司;Spectra MAX M5酶标仪,美国Molecular Devices;WGZ-XT细菌浊度仪,杭州齐威仪器有限公司;平底96孔细菌培养板,南通市海之星实验器材有限公司;VB-40立式高温高压灭菌锅,德国SYSTEC;BSC-1300超净工作台,苏州安泰空气技术有限公司;SHP-150生化培养箱,上海森信实验仪器有限公司;EX-OHOUS电子天平,美国奥豪斯公司;Milli-Q超纯水仪,美国Millipore公司。
1.3 细菌培养
取沙门氏菌接种于NB培养基,在37 ℃摇床培养,通过细菌浊度仪检测细菌浓度。将浓度为0.5 MCF的菌液进行梯度稀释,取100 μL涂布NA琼脂平板,37 ℃培养24 h,进行菌落计数,计算出0.5 MCF菌液对应的细菌培养物的菌落数及菌落形成单位(CFU/mL)。最后用NB将菌液稀释成所需浓度,4 ℃冰箱保存备用。
1.4 微量肉汤稀释法药敏试验
按美国临床和实验室标准协会(CLSI)方案,将倍比稀释的不同浓度的抗生素分别加到无菌的96孔培养板中,1~11孔加入系列稀釋抗生素100 μL,第12孔不加抗生素作为阳性生长对照。将培养的沙门氏菌菌悬液稀释至7.5×106 CFU/mL,向每孔中加100 μL,在37 ℃恒温培养箱中孵育[10]。此时,1~11孔药物浓度分别为128.000、64.000、32.000、16.000、8.000、4.000、2.000、1.000、0.500、0.250、0.125 μg/mL。20 h后,观察96孔培养板中的液体浑浊情况,判断沙门氏菌是否生长及其对所试抗生素的敏感性。
1.5 刃天青工作条件的优化
用NB肉汤将沙门氏菌进行连续梯度稀释,分装96孔培养板中,每孔加入100 μL,终浓度分别为 7.5×106、7.5×105、7.5×104、7.5×103、7.5×102、7.5×10 CFU/mL,菌液浓度列间递减;同时每孔加入用NB肉汤稀释的不同浓度刃天青溶液100 μL,终浓度为1.600、0.800、0.400、0.200、0.100、0.050、0.025 mmol/L,刃天青浓度行间递减。设无刃天青含菌的NB肉汤为阳性对照,无菌含刃天青的NB肉汤为阴性对照,37 ℃恒温培养箱中培养12 h,每隔1 h观察颜色变化,检测荧光值,荧光激发波长为530 nm,发射波长为590 nm,并记录荧光数据。该试验测量荧光值和观察颜色变化来评价药物的抑菌效果,选用变为粉红色的时间为试验所需测试时间,并且将能明显显示细菌生长的刃天青浓度选为工作浓度。
1.6 沙门氏菌生长动态观察
取培养的沙门氏菌,用NB肉汤稀释成不同浓度7.5×106、7.5 ×105、7.5×104、7.5×103、7.5×102、7.5×10 CFU/mL,分装于96孔板中,100 μL/孔,再每孔加入100 μL的工作浓度刃天青溶液,37 ℃恒温培养10 h,每隔1 h观察结果并同时检测荧光值。
1.7 刃天青微量板药敏试验
将NB肉汤稀释的刃天青溶液100 μL加到无菌的96孔培养板中,将抗生素加入第1孔,1~11孔进行梯度稀释,第12孔不加抗生素作为阳性生长对照。向每孔中加100 μL培养的沙门氏菌菌悬液,在37 ℃恒温培养箱中孵育。选择对5种抗生素耐药或敏感的6株沙门氏菌进行药敏试验,根据颜色变化及荧光值来判断沙门氏菌是否生长及其对所试抗生素的敏感性。
1.8 刃天青微量板的应用
将蛋洗净并浸泡在75%乙醇溶液中后,将蛋清和蛋黄在无菌条件下移入无菌均质袋中,并用均质器打浆2 min以制备悬浮液。通过将25 mL鸡蛋混合物添加到175 mL营养肉汤中来制备1∶10样品稀释液。用该稀释液将鼠伤寒沙门氏菌稀释成7.5×106 CFU/mL,然后按照“1.7”方法进行药敏试验。另取样品100 μL,涂布NA琼脂平板,37 ℃培养24 h观察是否杂菌污染。
2 结果与分析
2.1 细菌浓度的确定
为了便于细菌定量检测,用细菌浊度仪测定沙门氏菌浊度,取定量稀释液涂布NA琼脂平板,培养24 h后进行菌落计数。经菌落计数,计算出0.5 MCF菌液对应的细菌培养物的菌落数为4.15×108 CFU/mL。
2.2 刃天青工作条件优化
该试验测试沙门氏菌浓度与刃天青浓度的荧光值和颜色变化,根据其变化来优化测试条件。其中挑选3个时间点来进行结果说明。当培养3 h时,7.5 ×106 CFU/mL浓度细菌可使0.025~0.200 mmol/L刃天青变粉红色。当培养6 h时,细菌浓度≤103 CFU/mL,均不能使所用7种刃天青浓度变色,这显示沙门氏菌没有生长;当细菌浓度≥104 CFU/mL,0.025~0.400 mmol/L刃天青可以显示沙门氏菌生长,≥0.800 mmol/L刃天青的显色时间相对滞后,其中高浓度细菌(7.5×106 CFU/mL)在全浓度刃天青溶液中都变粉红色。培养12 h后,只有7.5×10 CFU/mL浓度的细菌在1.600 mmol/L刃天青浓度下不变色,其余浓度的细菌均可使刃天青变为粉色。荧光检测结果所得趋势同上。从7.5×105 CFU/mL细菌在不同刃天青浓度下随孵育时间的荧光检测结果(图1)可以看出,细菌与刃天青反应2 h后荧光差异明显,0.025~0.100 mmol/L刃天青在5 h内还原趋于饱和,0.200~0.800 mmol/L刃天青在5~6 h还原饱和;0.050~0.800 mmol/L刃天青的饱和荧光值接近,说明特定浓度细菌已被刃天青饱和或过饱和。试验结果表明,低浓度刃天青产生的荧光信号低,反应不灵敏,而过高浓度的刃天青会导致反应时间过长且荧光检测滞后。综合颜色变化和荧光值,在5个变色较快的浓度中,0.100 mmol/L刃天青的显色清晰,荧光值明显,因此选为刃天青微量板的工作浓度。
2.3 沙门氏菌的生长动态
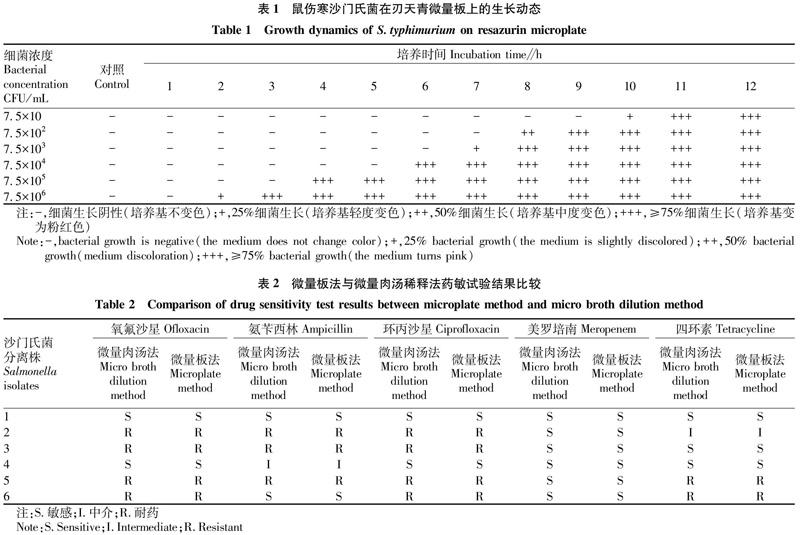
将不同浓度的沙门氏菌在刃天青微量板上培养12 h,每隔1 h观察结果。结果显示(表1),当细菌浓度为7.5×102、7.5×104和7.5×105 CFU/mL时,分别培养8、6和4 h即可见沙门氏菌生长;其中细菌浓度为7.5×10、7.5×103和7.5×106 CFU/mL时,分别在10、7和2 h显示为部分沙门氏菌生长。由此可见,刃天青微量板进行沙门氏菌药敏试验的判断时间可以控制在5 h。
2.4 刃天青微量板药敏试验
用配制好的标准浓度抗生素进行沙门氏菌药敏试验,结果显示(表2),不同沙门氏菌分离株对抗生素氧氟沙星、氨苄西林、环丙沙星、美罗培南、四环素或敏感或耐药。依据CLSI的最新判断标准,刃天青微量板与微量肉汤稀释法药敏试验得到的耐药结果一致。这表明用刃天青微量板法可以在短时间内更为直观地观察到耐药结果。但在检测沙门氏菌对美罗培南耐药性时发现,因为所用沙门氏菌对美罗培南均为完全敏感,可以观察到在耐药折点有些菌株会有极轻微的变色。
在测量菌株耐药情况的同时,选择性地扩大抗生素的浓度范围,发现用刃天青微量板法得到的MIC值和微量肉汤稀释法的MIC值会有些许差异,沙门氏菌对环丙沙星和美罗培南的耐药性如表3所示。扩大浓度范围后,用2种方法测得的4株菌的MIC有差异。其中3株菌在测量对美罗培南耐药性时发现,用刃天青微量板法检测可以得到相对应的MIC值,但用微量肉汤稀释法检测得到的却为敏感,没有确切的MIC值。这可能是因为刃天青变色敏感,更易被人肉眼和荧光检测到,而微量肉汤稀释法只关注培养基的浑浊程度,无法精确得到耐药值。这间接表明刃天青微量板法比肉汤稀释法更灵敏,对研究菌株在低浓度抗生素中的生长情况有帮助,有益于在公共衛生方面的用药安全。
2.5 刃天青微量板的应用
用氧氟沙星、氨苄西林、环丙沙星、美罗培南、四环素5种抗生素对实际样品进行刃天青微
量板快速药敏试验,并同时进行微量肉汤稀释法药敏试验对照,结果显示(表4),2种药敏试验方法的结果具有良好的一致性。
3 结论
该研究以刃天青为检测物质,对食源性致病菌沙门氏菌的耐药性进行检测。所用刃天青微量板法得到的MIC与微量肉汤稀释法进行判断的结果具有良好的一致性,且更为灵敏、直观,在5 h内就可以得出药敏结果。其中肉眼观察在实际应用中较为方便,不受试验设备、场地的制约;荧光检测可以更清晰地明确耐药情况,获得整个耐药进程,且更为准确、客观和结果可量化。刃天青微量板法弥补了琼脂法等常规药敏试验方法无法动态检测细菌生长情况的缺陷,其优势在于其可清晰辨别耐药折点,动态地检测细菌的生长状况,在低浓度抗生素下可以得到更为精确的耐药值。刃天青微量板法具有简便、快速、灵敏、经济等优点,在检测各种细菌对抗生素的敏感性中有显而易见的优势。同时刃天青法为非特异性检测,在实际检测中有更好的应用价值。
参考文献
[1] CARVALHO F C,SOUSA O V,CARVALHO E M R,et al.Antibiotic resistance of Salmonella spp.isolated from shrimp farming freshwater environment in northeast region of Brazil[J].Journal of pathogens,2013,2013:1-5.
[2] PEEK S F,HARTMANN F A,THOMAS C B,et al.Isolation of Salmonella spp. from the environment of dairies without any history of clinical salmonellosis[J].Journal of the American veterinary medical association,2004,225(4):574-577.
[3] HURD H S,MCKEAN J D,WESLEY I V,et al.The effect of lairage on Salmonella isolation from market swine[J].Journal of food protection,2001,64(7):939-944.
[4] BRADEN C R.Salmonella enterica serotype Enteritidis and eggs:A national epidemic in the United States[J].Clinical infectious diseases,2006,43(4):512-517.
[5] FELDSINE P T,LIENAU A H,LEUNG S C,et al.Detection of Salmonella in fresh cheese,poultry products,and dried egg products by the ISO 6579 Salmonella culture procedure and the AOAC official method:Collaborative study[J].Journal of AOAC International,2003,86(2):275-295.
[6] SOKOLOV D M,SOKOLOV M S.Rapid methods for the genus Salmonella bacteria detection in food and raw materials[J].Voprosy pitaniia,2013,82(1):33-40.
[7] 张燕,朱超.我国沙门氏菌病和菌型分布概况[J].现代预防医学,2002,29(3):400-401.
[8] VELASQUEZ C G,MACKLIN K S,KUMAR S,et al.Prevalence and antimicrobial resistance patterns of Salmonella isolated from poultry farms in southeastern United States[J].Poultry science,2018,97(6):2144-2152.
[9] CUYPERS W L,JACOBS J,WONG V,et al.Fluoroquinolone resistance in Salmonella:Insights by wholegenome sequencing[J].Microbial genomics,2018,4(7):1-9.
[10] JORGENSEN J H,FERRARO M J.Antimicrobial susceptibility testing:General principles and contemporary practices[J].Clinical infectious diseases,1998,26(4):973-980.
[11] MACH K E,WONG P K,LIAO J C.Biosensor diagnosis of urinary tract infections:A path to better treatment?[J].Trends in pharmacological sciences,2011,32(6):330-336.
[12] 李少博,贺稚非,李洪军,等.食源性沙门氏菌耐药机制及药敏性检测方法研究现状[J].食品与发酵工业,2016,42(9):257-262.
[13] GEYER C N,HANSON N D.Rapid PCR amplification protocols decrease the turnaround time for detection of antibiotic resistance genes in Gramnegative pathogens[J].Diagnostic microbiology and infectious disease,2013,77(2):113-117.
[14] STRAUSS C,ENDIMIANI A,PERRETEN V.A novel universal DNA labeling and amplification system for rapid microarraybased detection of 117 antibiotic resistance genes in Grampositive bacteria[J].Journal of microbiological methods,2015,108:25-30.
[15] 袁高慶,黎起秦,秦健,等.噻唑蓝法和刃天青法检测植物成分对两种病原细菌的抑菌活性[J].植物保护学报,2011,38(4):306-312.
[16] 陈军,陈志飞,饶有益,等.微量刃天青显色法快速测定结核分枝杆菌MIC及菌型鉴定[J].临床检验杂志,2011,29(3):174-175.
